
La nutrition représente un enjeu majeur en hématologie puisque jusqu'à 30 % des patients présentent des critères de dénutrition1. Parmi les traitements d'hématologie, un des traitements les plus à risque de dénutrition est l'allogreffe de cellules souches hématopoïétiques, un traitement intensif avec un objectif curatif dans plusieurs types d'hémopathies... La dénutrition et la perte de poids, fréquemment observées au cours de l'allogreffe, sont des facteurs de risque défavorables, associés à une augmentation de l'incidence des complications infectieuses, un allongement de la durée de d'hospitalisation et une diminution de la survie globale2. Il est donc indispensable d'identifier précocement les patients à risque de dénutrition fin d'optimiser leur prise en charge nutritionnelle.
Cet article se propose d'étudier les recommandations actuelles concernant la prise en charge nutritionnelle des patients allogreffés tout au long de leur parcours de soins.
Identification des patients à risque de dénutrition
La Haute Autorité de Santé propose un algorithme de diagnostic de la dénutrition, conformément aux critères du GLIM (Global Leadership Initiative on Malnutrition)3. Le patient doit présenter au moins un critère phénotypique (degré de perte de poids, indice de masse corporelle ou réduction de masse ou de fonction musculaire) associé à au moins un critère étiologique (réduction des apports alimentaires, diminution de 'l'absorption, pathologie responsable d'un hypercatabolisme protéique). La dénutrition est considérée comme modérée ou sévère en fonction de certains paliers définis. L'albuminémie n'est pas un critère diagnostique mais plutôt un marqueur de sévérité de la dénutrition4. Les diététiciens doivent être impliqués à chaque étape de la prise en charge du patient, pour l'identification des patients dénutris, la mise en place du support nutritionnel et l'optimisation de leur suivi.
Par ailleurs, il est essentiel de surveiller régulièrement le poids du patient, bien que son interprétation puisse être biaisée en cas de surcharge hydro-sodée5.
Les apports nutritionnels oraux avant l'hospitalisation pour la réalisation de la greffe doivent être évalués, car souvent altérés par les effets secondaires des traitements préalables à l'allogreffe5, 6. L'activité physique peut également être appréciée à l'aide de diverses échelles permettant d'estimer à la fois le niveau d'activité quotidienne et la fonction musculaire5.
Enfin, la sévérité de l'inflammation systémique, responsable d'un catabolisme accru, peut être évaluée par le dosage de la CRP et de l'albuminémie, qui sont liées à une augmentation du risque de morbidité et de mortalité7
Les apports nutritionnels durant l'hospitalisation doivent être évalués de manière régulière et standardisée de façon hebdomadaire8. Les besoins énergétiques totaux chez l'adulte sont estimés à 35 kcal/kg/jour, avec des besoins protéiques augmentés à au moins 1,5 g/kg/jour9.
Pendant l'allogreffe : l'enjeu de la nutrition artificielle
La mise en place d'un support nutritionnel est préconisé lorsque la prise alimentaire orale est diminuée de plus de 60 % pendant 3 jours consécutifs, et chez tous les patients ayant une dénutrition préexistante ou un IMC terrain nutritionnel et de l'acceptation du patient9.
L'alimentation orale doit être encouragée le plus longtemps possible à travers l'adaptation des repas aux préférences personnelles, l'ajout de compléments hypercaloriques et hyperprotéinés et l'enrichissement des plats par des poudres hyperprotidiques8, 10.
Si les objectifs nutritionnels ne sont pas atteints par ces mesures, un support artificiel doit être débuté. Les caractéristiques de chaque type d'alimentation artificielle sont décrites dans le tableau 1.
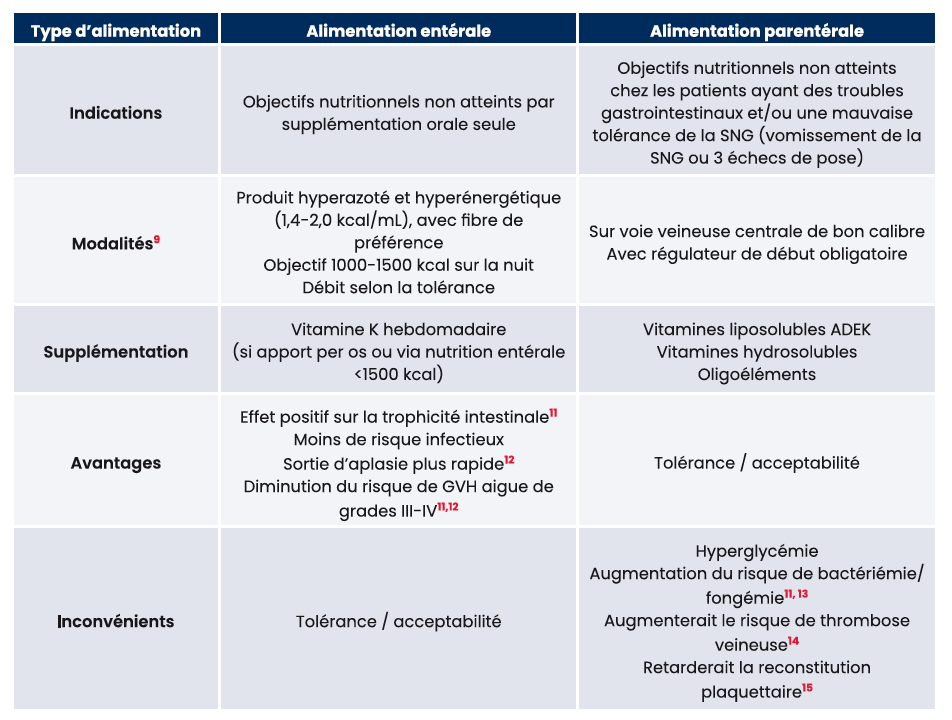
Tableau 1 : Indications et supplémentations selon le type de nutrition artificielle8
Le poids doit être surveillé quotidiennement et interprété en fonction de la surcharge hydro-sodée éventuelle. Une surveillance biologique est recommandée8 :
• Natrémie, kaliémie et créatininémie quotidiennes ;
• Calcémie, phosphorémie, magnésémie, bilan hépatique et bilan de coagulation bi-hebdomadaires, dosage des triglycérides en cas de nutrition parentérale ;
• Albuminémie hebdomadaire (avec supplémentation si nécessaire) ;
• Dosage de la vitamine D et de la vitamine B12 à l'admission, avec supplémentation si besoin. L'arrêt de la nutrition artificielle est recommandé lorsque plus de 50% des objectifs nutritionnels sont atteints grâce à la nutrition orale 5. La poursuite de l'alimentation per os doit d'ailleurs être encouragée lors de la supplémentation artificielle afin de favoriser sa reprise précoce.
À la sortie d'hospitalisation : la place de l'alimentation thérapeutique protégée
Le « régime neutropénique » ou « régime protégé » repose sur l'exclusion d'aliments pouvant contenir des agents pathogènes susceptibles de coloniser le tube digestif puis d'entraîner une translocation bactérienne voire une bactériémie. Toutefois, ce type d'alimentation thérapeutique très restrictif expose les patients au risque de carence nutritionnelle et d'altération de la qualité de vie 16. Plusieurs études randomisées contrôlées ont montré que le « régime neutropénique » n'est pas supérieur à une alimentation thérapeutique adaptée moins restrictive pour la prévention de la colonisation intestinale et des bactériémies6, 17.
Les consignes alimentaires à la sortie d'hospitalisation doivent garantir un apport nutritionnel optimal, tout en satisfaisant le plaisir gustatif du patient et en limitant le risque infectieux. La SFGM-TC a ainsi proposé une harmonisation des recommandations alimentaires avec actualisation du carnet patient 18.
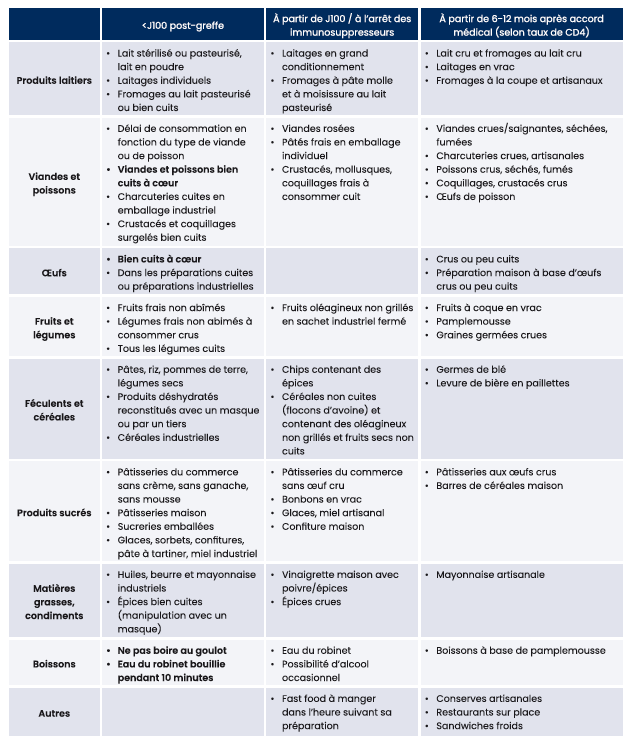
Tableau 2 : Aliments autorisés à la sortie d'hospitalisation d'allogreffe 18
Adaptations nécessaires en cas de GVHd
Jusqu'à 60 % des patients allogreffés vont présenter une GVHd aiguë au niveau du tractus gastro-intestinal haut, provoquant anorexie, nausées, vomissements et dyspepsie19. Ces symptômes peuvent avoir un impact sur la prise alimentaire, qui doit donc être surveillée et adaptée en fonction de la gravité.
L'atteinte de la muqueuse buccale peut perturber l'alimentation, la mastication et la déglutition, par fibrose tissulaire et/ou dysfonction salivaire. Les patients rapportent une sensibilité aux aliments épicés, acides et salés et aux boissons alcoolisées20. L'hydratation fréquente doit être encouragée. La mastication et la salivation peuvent être stimulées par des chewing-gum ou bonbons sans sucre21.
Une atteinte gastro-intestinale basse est également possible, provoquant douleurs abdominales, diarrhées et malabsorption, les patients étant ainsi à haut risque de dénutrition (plus de 50 % des patients atteints de GVHd) et de perte de poids22. Les besoins protéiques sont augmentés (minimum 1.5g/kg si pas d'insuffisance rénale)5.
La nutrition orale doit être adaptée, en limitant les glucides peu fermentants, les fibres, les lipides, la caféine et autres irritants intestinaux (dont le lactose qui favoriserait la survenue de GVHd23). La densité et la consistance des aliments doivent être progressivement augmentées en fonction de la tolérance digestive. Une stabilité des symptômes digestifs pendant au moins 3 jours permet le passage au palier supérieur (tableau 3)24
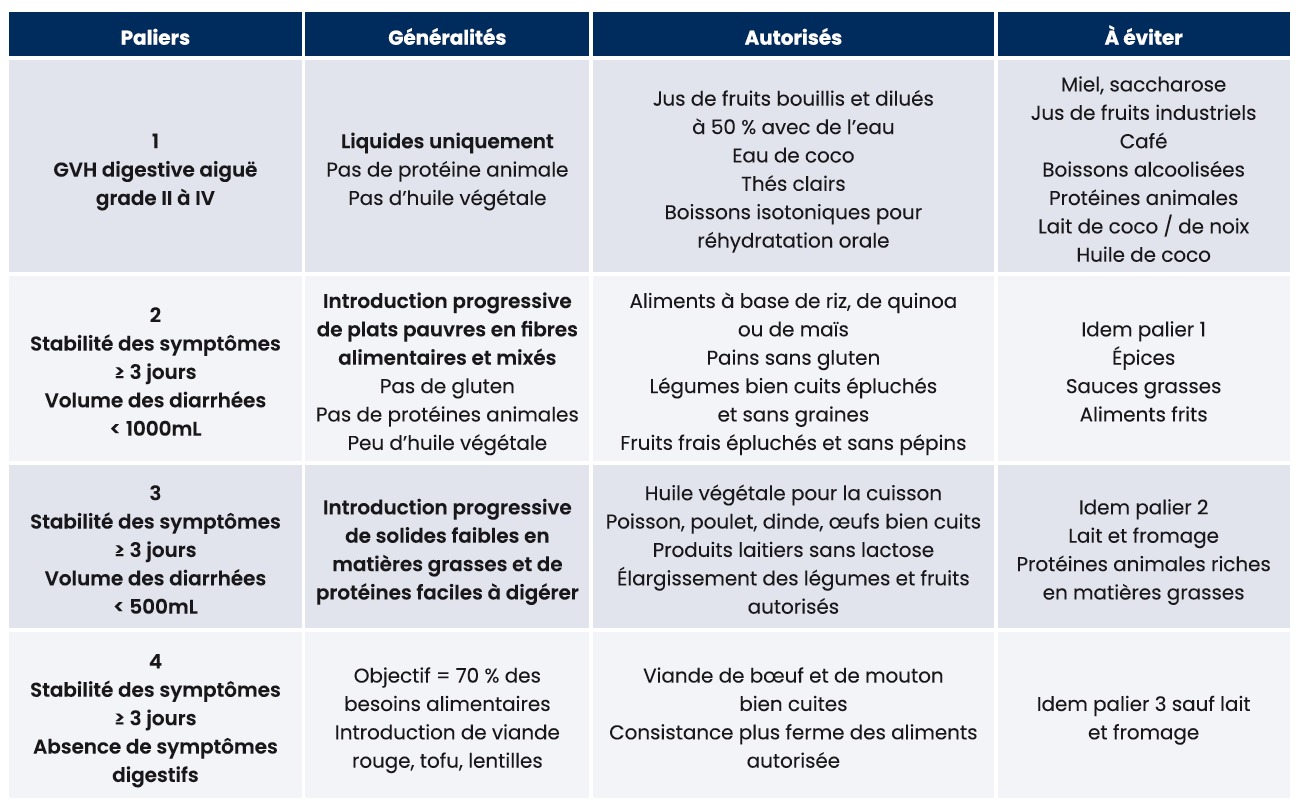
Tableau 3 : Adaptation de l'alimentation orale en cas de GVHd digestive aiguë24
La nutrition artificielle doit être débutée lorsque les objectifs énergétiques journaliers ne sont pas atteints par l'alimentation orale seule. La plupart des patients atteints de GVHd présentant une mauvaise tolérance de la nutrition per os ou entérale, notamment lorsque la diarrhée est sévère (supérieur à1L/ jour), le soutien nutritionnel peut reposer sur la nutrition parentérale exclusive, le jeûne permettant également de soulager les troubles gastro-intestinaux22.
La reprise de poids doit être surveillée avec attention et interprétée selon l'éventuelle surcharge hydro-sodée, qui peut être liée à l'utilisation des corticoïdes.
Y-a-t-il une place pour les pré- et probiotiques ?
De plus en plus d'études montrent une interaction entre microbiote et système immunitaire, qui aurait un rôle dans la reconstitution immunitaire post-allogreffe, la réaction GVL, la survenue de GVHd et d'infection25. Dans ce contexte, les pré- et probiotiques pourraient avoir un intérêt pour réguler la dysbiose liée aux traitements préalables à la greffe, cependant aucune étude n'a étudié leur intérêt comparé à un placebo8.
Conclusion
L'optimisation de l'alimentation, qu'elle soit orale ou artificielle, est un enjeu majeur de la prise en charge des patients allogreffés. Les patients à risque de dénutrition doivent être identifiés et leur prise alimentaire monitorée afin de débuter un support nutritionnel dès que nécessaire, par enrichissement des prises orales ou initiation d'une alimentation artificielle. À la sortie d'hospitalisation, l'alimentation thérapeutique est initialement adaptée pour limiter le risque d'infection, puis est progressivement élargie en fonction des traitements et de la reconstitution immunitaire, jusqu'au retour à une alimentation normale. En cas de GVHd, l'alimentation orale doit être adaptée à la symptomatologie et une alimentation artificielle doit être débutée si nécessaire.

Estelle HAMON
Interne en Hématologie clinique au CHU de Saint-Etienne
Avec la relecture de Sophie ESTRAN, nutritionniste au CHU de Nice
Bibliographie
1. Yilmaz M, Atilla FD, Sahin F, Saydam G. The effect of malnutrition on mortality in hospitalized patients with hematologic malignancy. Support Care Cancer. mars 2020;28(3):1441-8.
2. Baumgartner A, Zueger N, Bargetzi A, Medinger M, Passweg JR, Stanga Z, et al. Association of Nutritional Parameters with Clinical Outcomes in Patients with Acute Myeloid Leukemia Undergoing Haematopoietic Stem Cell Transplantation. Ann Nutr Metab. 2016;69(2):89-98.
3. Cederholm T, Jensen GL, Correia MITD, Gonzalez MC, Fukushima R, Higashiguchi T, et al. GLIM criteria for the diagnosis of malnutrition – A consensus report from the global clinical nutrition community. Clinical Nutrition. févr 2019;38(1):1-9.
4. HAS. HAS • Diagnostic de la dénutrition chez l'enfant, l'adulte, et la personne de 70 ans et plus • Novembre 2021 [Internet]. 2021. Disponible sur : https://www.has-sante.fr/upload/docs/application/pdf/2021-11/reco368_fiche_outil_denutrition_pa_ cd_20211110_v1.pdf
5. Bozzetti F, Arends J, Lundholm K, Micklewright A, Zurcher G, Muscaritoli M. ESPEN Guidelines on Parenteral Nutrition: Non-surgical oncology. Clinical Nutrition. août 2009;28(4):445-54.
6. Isenring E, Elia M. Which screening method is appropriate for older cancer patients at risk for malnutrition? Nutrition. avr 2015;31(4):594-7.
7. McMillan DC. The systemic inflammation-based Glasgow Prognostic Score: A decade of experience in patients with cancer. Cancer Treatment Reviews. août 2013;39(5):534-40.
8. Baumgartner A, Schuetz P. Nutritional Support. In: Sureda A, Corbacioglu S, Greco R, Kröger N, Carreras E, éditeurs. The EBMT Handbook [Internet]. Cham: Springer International Publishing; 2024 [cité 16 déc 2024]. p. 211-7. Disponible sur : https://link.springer.com/10.1007/978-3-031-44080-9_25
9. Bay JO, Dendoncker C, Angeli M, Biot T, Chikhi M, Combal C, et al. Prise en charge nutritionnelle des patients hospitalisés pour allogreffe de CSH : recommandations de la Société francophone de greffe de moelle et de thérapie cellulaire (SFGM-TC). Bulletin du Cancer. nov 2016;103(11):S201-6.
10. Jésus P, Eyraud E, Flori N, Zeanandin G, Attalin V, Bouchoud L, et al. DÉNUTRITION CHEZ L'ADULTE DE 18 À 69 ANS ET LA PERSONNE DE 70 ANS ET PLUS - Diagnostic, prise en charge et surveillance d'après les recommandations de la HAS (2019 et 2021). 2021.
11. Guièze R, Lemal R, Cabrespine A, Hermet E, Tournilhac O, Combal C, et al. Enteral versus parenteral nutritional support in allogeneic haematopoietic stem-cell transplantation. Clin Nutr. juin 2014;33(3):533-8.
12. Seguy D, Duhamel A, Rejeb MB, Gomez E, Buhl ND, Bruno B, et al. Better Outcome of Patients Undergoing Enteral Tube Feeding After Myeloablative Conditioning for Allogeneic Stem Cell Transplantation. Transplantation. 15 août 2012;94(3):287-94.
13. Baumgartner A, Bargetzi A, Zueger N, Bargetzi M, Medinger M, Bounoure L, et al. Revisiting nutritional support for allogeneic hematologic stem cell transplantation-a systematic review. Bone Marrow Transplant. avr 2017;52(4):506-13.
14. Layec S, Stefanescu C, Corcos O, Amiot A, Pingenot I, Messing B, et al. Les vraies indications de la nutrition parentérale [Internet]. 2011. Disponible sur : https://www.fmcgastro.org/postu-main/archives/postu-2011-paris/textes-postu-2011-paris/les-vraiesindications-de-la-nutrition-parenterale/
15. Çetin T, Arpaci F, Dere Y, Turan M, Öztürk B, Kömürcü Ş, et al. Total parenteral nutrition delays platelet engraftment in patients who undergo autologous hematopoietic stem cell transplantation. Nutrition. juill 2002;18(7-8):599-603.
16. Taggart C, Neumann N, Alonso PB, Lane A, Pate A, Stegman A, et al. Comparing a Neutropenic Diet to a Food Safety-Based Diet in Pediatric Patients Undergoing Hematopoietic Stem Cell Transplantation. Biology of Blood and Marrow Transplantation. juill 2019;25(7):1382-6.
17. Moody K. Neutropenic Dietary Restrictions for Hematopoietic Stem Cell Patients: Time for a Change. Biology of Blood and Marrow Transplantation. juill 2019;25(7):e223-5.
18. Farrugia C, Lhostette A, Brasseur M, Biot T, Calmes H, Dendoncker C, et al. Consignes alimentaires pour les patients adultes et pédiatriques en sortie d'hospitalisation post-allogreffe de cellules souches hématopoïétiques (SFGM-TC). Bulletin du Cancer. juin 2024;S0007455124001930.
19. Harris AC, Young R, Devine S, Hogan WJ, Ayuk F, Bunworasate U, et al. International, Multicenter Standardization of Acute Graftversus-Host Disease Clinical Data Collection: A Report from the Mount Sinai Acute GVHD International Consortium. Biology of Blood and Marrow Transplantation. janv 2016;22(1):4-10.
20. Fall-Dickson JM, Pavletic SZ, Mays JW, Schubert MM. Oral Complications of Chronic Graft-Versus-Host Disease. J Natl Cancer Inst Monogr. 1 août 2019;2019(53):lgz007.
21. Dean D, Sroussi H. Oral Chronic Graft-Versus-Host Disease. Front Oral Health. 2022;3:903154.
22. Van Der Meij BS, De Graaf P, Wierdsma NJ, Langius JAE, Janssen JJWM, Van Leeuwen PAM, et al. Nutritional support in patients with GVHD of the digestive tract: state of the art. Bone Marrow Transplant. avr 2013;48(4):474-82.
23. Stein-Thoeringer CK, Nichols KB, Lazrak A, Docampo MD, Slingerland AE, Slingerland JB, et al. Lactose drives Enterococcus expansion to promote graft-versus-host disease. Science. 29 nov 2019;366(6469):1143-9.
24. Chiconato GC, Campos DJ, Thomaz AC, Moreira Funke VA, Vilela RM. Oral nutritional support to adult patients with acute intestinal Graft Versus Host Disease (GVHD): A proposal for dietary intervention as a model to clinical trials. Clinical Nutrition ESPEN. déc 2020;40:369-75.
25. Andermann TM, Peled JU, Ho C, Reddy P, Riches M, Storb R, et al. The Microbiome and Hematopoietic Cell Transplantation: Past, Present, and Future. Biology of Blood and Marrow Transplantation. juill 2018;24(7):1322-40.

