
Revue de la littérature
En avril 2025, les recommandations de l'European Conference on Infections in Leukemia (ECIL) concernant la prophylaxie des infections fongiques chez les patients suivis pour une hémopathie maligne ont été publiées (1). Nous proposons une présentation de trois infections fongiques invasives rencontrées en hématologie, leur présentation clinique, leur prévention et leur traitement.
Liste des abréviations
A(P)I : aspergillose (pulmonaire) invasive, GM : galactomannanes, MP : mucormycose pulmonaire, ICAHT : Immune effector cell–associated hematotoxicity, IFI : infections fongiques invasives, NETs : Neutrophil Extracellular Traps.
Aspergillose invasive
Le pathogène
Cette infection est due à un champignon filamenteux septé du genre Aspergillus dont les principales espèces sont A.fumigatus, A.flavus et A.niger, son réservoir est principalement les sols et les végétaux en décomposition avec des spores aspergillaires ou conidies en suspension dans l'atmosphère (2). Chaque individu inhale des conidies présentes dans l'environnement, notamment autour de zones en travaux, proches de composts végétaux ou un habitat humide. Différentes entités cliniques sont décrites, allant de formes chroniques sans invasion des tissus (dont l'aspergillome) jusqu'à des formes angio-invasives avec une dissémination hématogène. Chez les patients d'onco-hématologie, l'infection est volontiers angio-invasive.
L'immunité innée représente la première ligne de défense via les macrophages alvéolaires qui phagocytent les conidies. Les neutrophiles détruisent les hyphes via dégranulation, phagocytose, et pièges extracellulaires à neutrophiles (NETs) qui limitent la dissémination du pathogène.
L'immunité adaptative assure une protection via l'activation des lymphocytes Th1 qui produisent IFN-γ et TNF-α. Les réponses Th17 (IL-17) contribuent au recrutement de neutrophiles.
La neutropénie prolongée, l'immunosuppression induite par les traitements et les ruptures des barrières cutanéo-muqueuses secondaires à la radiochimiothérapie favorisent ces formes d'infections
Épidémiologie et facteurs de risque
Les principaux facteurs de risque d'IFI sont : une induction pour une leucémie aiguë myéloblastique, une allogreffe de cellules souches hématopoïétiques dont le greffon est issu de sang de cordon ou de moelleosseuse, une GvH aiguë de stade III ou IV, une GvH corticorésistante ou corticodépendante (3).
L'environnement protégé n'écarte pas le risque fongique. La colonisation peut être préalable en cas d'alternance entre le domicile et les hospitalisations. Les facteurs de risque de contamination préalables sont la BPCO, des travaux au domicile ou une exposition professionnelle dans les six mois avant le traitement, un ECOG supérieure égale 2 (4).
Présentation clinicoradiologique
II n'existe pas de signes cliniques ou radiologiques spécifiques de l'aspergillose pulmonaire invasive.
Les signes cliniques sont : la fièvre réfractaire après 48 à 72H d'antibiothérapielarge spectre, dyspnée, douleur pleurale, hémoptysie, toux et/ou dégradation respiratoire malgré une antibiothérapie adaptée et un support ventilatoire adapté (5, 6).
Pour environ 10 % à 20 % des formes invasives, une atteinte du SNC est retrouvée motivant la réalisation, devant tout point d'appel clinique neurologique associé, d'une imagerie cérébrale et d'une ponction lombaire (7).
Les signes radiologiques à rechercher par TDM-thoracique injectée sont : opacités alvéolaires, infiltrats ou nodules aspécifiques, “halo sign (foyer d'infarctus périlésionnel), puis à une phase plus tardive : un “air-crescent sign” (cavitation avec croissant gazeux périphérique) (5, 6).
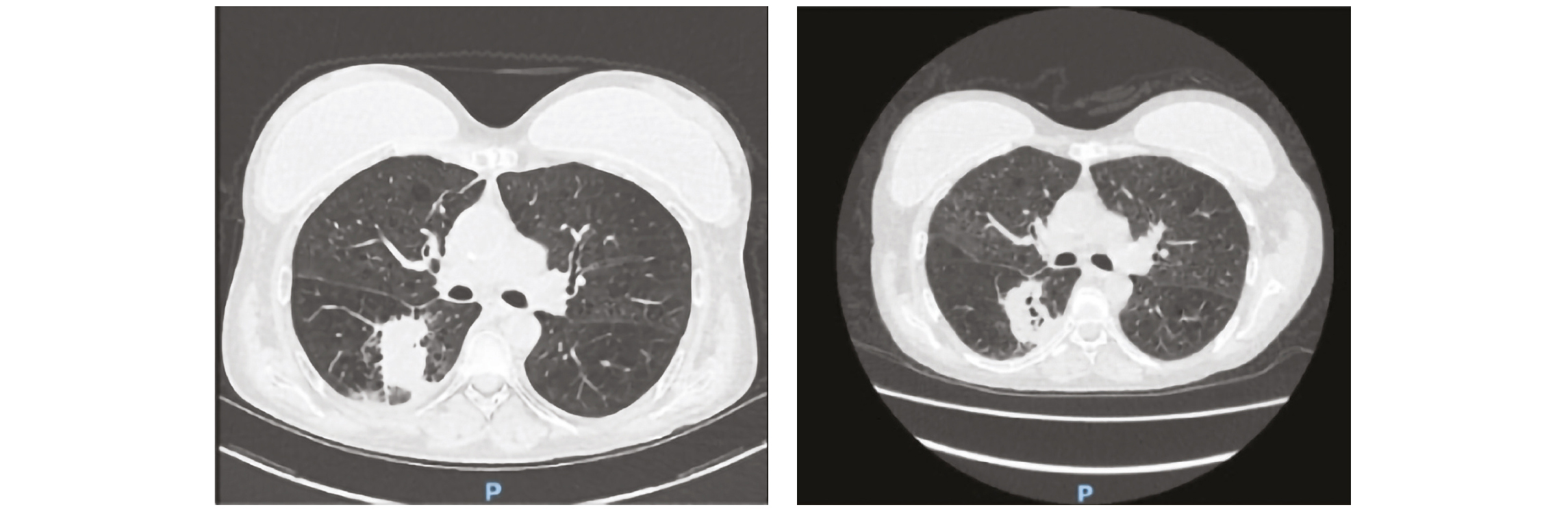
Patient avec diagnostic API
Imagerie au diagnostic (à droite) puis à J10 du traitement antifongique (à gauche)
Diagnostic
Le diagnostic repose sur un faisceau d'arguments cliniques, radiologiques et biologiques chez des patients immunodéprimés. Les critères diagnostiques de EORTC/MSGERC (2019) permettent d'établir 3 tableaux diagnostiques :
- Aspergillose invasive prouvée :
Présence d'Aspergillus spp. Sur prélèvement histopathologique/ cytopathologique/examen direct d'une biopsie avec signe d'invasion ou culture d'Aspergillus spp sur site normalement stérile. - Aspergillose invasive probable :
Présence d'au moins un signe clinico-radiologique évocateur, et d'un argument microbiologique (examen direct positif/culture positive sur prélèvement respiratoire notamment, galactomannanes (GM) sériques et/ ou LBA et/ou LCS positifs, PCR sériques et/ou LBA positives) chez des patients avec un terrain à risque. - Aspergillose invasive possible :
Présence d'au moins un signe clinico-radiologique évocateur chez des patients avec un terrain à risque.
Les galactomannanes sont des polysaccharides retrouvés spécifiquement dans la paroi d'Aspergillus spp.
Le bilan d'extension d'une AI comportera : TDM-thoracique injectée, TDM sinus et imagerie cérébrale (idéalement une IRM).
Traitement
L'indication de traitement est justifiée pour les aspergilloses invasives prouvées et probables et sera discutée pour les aspergilloses invasives possibles selon le contexte clinique.
Le traitement des API repose en 1ère intention sur le Voriconazole 6mg/kg à J1 puis 4 mg/kg (à privilégier dans les formes sévères) ou Isavuconazole 200mg/12h pendant 48h puis 200mg/jour. Il faut prélever un dosage sérique du Voriconazole à J3-J4 et à J3 pour l'Isavuconazole.
Attention le Voriconazole est un puissant inducteur enzymatique du cytochrome P450.
Prophylaxie et monitoring
La prophylaxie primaire concerne les LAM et SMD éligibles aux traitements intensifs et aux agents hypométhylants tel que l'azacitidine. Elle repose sur l'utilisation de posaconazole (AI) ou isavuconazole (BII). Elle n'est pas recommandée de manière systématique dans les LAL du fait des interactions médicamenteuses avec la vincristine. Le traitement reste le voriconazole (AI) ou isavuconazole (1, 8, 9).
Un screening bi-hebdomadaire par GM sérique chez les patients à risque très élevé (induction LAM/LAL, allogreffe) (grade A I). Il est recommandé d'ajouter une PCR sérique ou LBA si les GM sont négatifs en cas de suspicion clinique (grade B II).
Mucormycose
Le pathogène
La mucormycose est une infection fongique causée par des champignons filamenteux non septés de l'ordre des Mucorales avec, Rhizopus, Mucor et Lichtheimia représentant plus de 90 % des genres (10).
La morbi-mortalité de cette infection est importante avec des taux de mortalité à 90 jours d'environ 56-59 % pour la mucormycose pulmonaire (11, 12).
L'inhalation de sporangiospores environnementaux (sols, céréales, moisissures) est à l'origine de mucormycose pulmonaire associée ou non à une atteinte des sinus et/ou une mucormycose sino-cérébrale, qui sont les deux manifestations les plus couramment rencontrées chez les patients d'onco-hématologie. L'infection aux Mucorales est à l'origine d'une angioinvasion locale avec des phénomènes de thrombose vasculaire puis d'ischémie et nécrose des tissus, voire d'une dissémination hématogène.
Épidémiologie et facteurs de risque
L'incidence de la mucormycose est en ascension depuis environ 20 ans en particulier chez les patients allogreffés, les patients transplantés d'organes solides et les patients diabétiques (13). La neutropénie prolongée, la corticothérapie (14) et la GvH contribuent au risque de mucormycose (15).
Présentation clinico-radiologique
Aucun signe clinique ou radiologique n'est spécifique. Concernant la mucormycose pulmonaire, A. Coste et al. ont enregistré 114 cas entre 2008 et 2019 en France, et ont pu décrire les signes cliniques et radiologiques avec une comparaison des formes cliniques selon la présence ou non d'une neutropénie au diagnostic (12) :
- Les signes cliniques évocateurs de la MP : fièvre (80 %), toux (51 %), dyspnée (58 %), douleur thoracique (25 %), hémoptysie (15 %), invasion de la paroi thoracique (16 %), atteinte des sinus associée (13 %).
- Les signes radiologiques évocateurs de la MP : atteinte pulmonaire bilatérale (63 %), lésion unique (26 %), masse (42 %) et/ou nodule (33 %) et/ou condensation (58 %), verre dépoli (65 %), cavité (23 %), “halo sign”(24 %) ou “halo sign inversé” (26 %), épanchement pleural (52 %).
Dans la cohorte de A. Coste et al., chez le patient neutropénique la fièvre est présente dans 97 % (vs 52 % chez le non-neutropénique P inférieure à 0.01) et la mucormycose disséminée (notamment cérébrale dans 44 % des cas) est plus fréquente (50 % vs 25 % ; P inférieure à 0.01) (12).
Diagnostic
Le diagnostic repose sur un faisceau d'arguments. Selon les critères diagnostiques de EORTC/MSGERC (2019) :
Mucormycose prouvée : Présence de champignon sur un prélèvement histopathologique/cytopathologique/ examen direct d'une biopsie avec signe d'invasion tissulaire ou culture de Mucorales sur site normalement stérile.
Mucormycose probable : Présence d'au moins un signe clinico-radiologique évocateur, et d'un argument microbiologique (examen direct positif/culture positive prélèvements respiratoire/sinus notamment, PCR sérique et/ou LBA positives) chez des patients avec un terrain à risque. À noter la qPCR sérique est positive dans 91 % des PM chez patient neutropénique (moins performant chez le non-neutropénique).
Mucormycose possible : Présence d'au moins un signe clinico-radiologique évocateur chez des patients avec un terrain à risque.
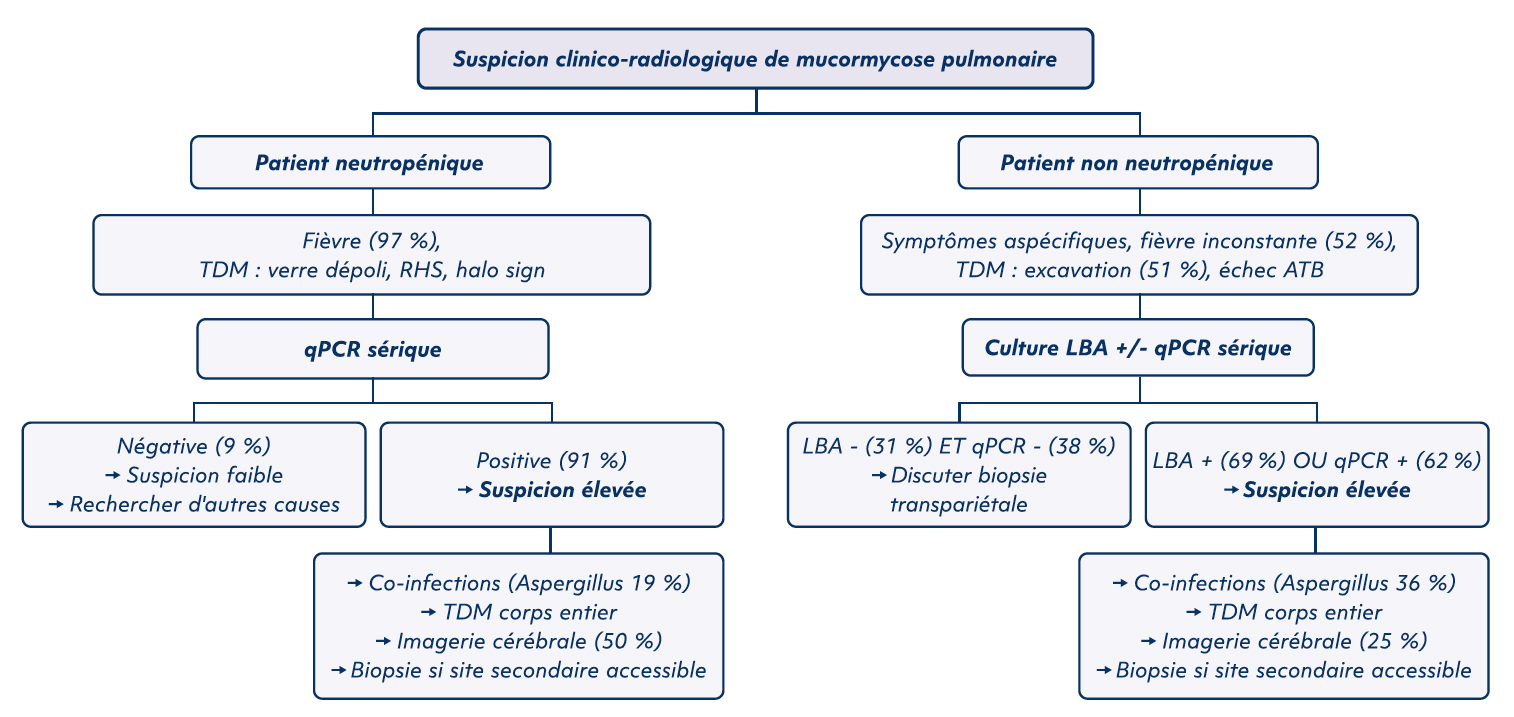
Proposition d'un algorithme diagnostique selon présence ou non d'une neutropénie
Improving Diagnosis of Pulmonary Mucormycosis, A.Coste et al. (12)
Traitement
Il associe un antifongique (Amphotéricine B liposomale à 7,5 à 10mg/kg pendant 6 à 8 semaines, avec un relais possible par Posaconazole ou Isavuconazole) et une chirurgie pour débridement des tissus nécrosés.
Les candidoses invasives
Le pathogène
Elles sont causées par des levures du genre Candida, des champignons opportunistes commensaux du tube digestif à l'origine de manifestations cliniques diverses allant des infections superficielles cutanées aux infections invasives disséminées.
Épidémiologie et facteurs de risque
En hématologie, les candidoses invasives représentent environ 10 à 25 % des IFI (16). C. tropicalis semble être l'espèce la plus fréquemment isolée (17), 18.
S. Cesaro et al. ont mesuré l'incidence d'une candidémie à J100 d'une allogreffe pour une LA chez 28542 patients greffés entre 2000 et 2012. A J100, 347 patients (1,2 %) présentaient une candidémie. Les principaux facteurs de risques sont un greffe de moelle osseuse ou de sang de cordon, ICT et la GvH (19).
Présentation clinico-radiologique
Elle se traduit souvent par une fièvre prolongée malgré antibiothérapie à large spectre. En revanche, cela ne doit pas motiver une escalade thérapeutique vers un antifongique en probabiliste devant une fièvre persistante sous antibiothérapie large spectre.
La candidémie motive la réalisation d'un fond d'œil et d'une échographie cardiaque. Les hémocultures doivent être répétées et les cathéters profonds doivent être retirés.
Dans les formes invasives, la documentation peut être réalisée sur une aspiration, une biopsie ou un drainage. En cas de suspicion de forme invasive, un scanner TAP voire TEP scanner doit être réalisé.
Traitement
Le traitement initial probabiliste repose sur une échinocandine, ou l'amphotéricine B liposomale en cas d'atteinte oculaire ou du système nerveux central (20). Le traitement sera ensuite adapté selon l'espèce identifiée et l'antifongigramme.
Concernant la candidémie, en l'absence de localisation secondaire ou complication, la durée de traitement est de 14 jours à compter de la négativation des hémocultures.
Prévention et monitoring
Si le posaconazole reste la prévention de choix pour les inductions des LAM et SMD, le fluconazole est recommandé pour les allogreffes et devrait être débuté au moment du conditionnement jusqu'à J75 (20).
Conclusion
Le diagnostic d'infection fongique invasive est difficile et repose sur des faisceaux d'argument clinico-biologiques et est grevé d'une morbi-mortalité importante.
Bien que les patients présentant des SMD/LA éligibles à des traitements intensifs et les allogreffés représentent la population la plus vulnérable, l'émergence des anticorps bispécifiques et des CAR-T cells impose une vigilance particulière en cas d'ICAHT.
Messages clés
Pathologies myéloïdes
- LAM : L'isavuconazole peut être utilisé en cas de contre-indication au posaconazole dans les LAM traitées par chimiothérapie intensive. La prophylaxie anti-fongique primaire sera maintenue pendant la consolidation.
- SMD : Une prophylaxie primaire par posaconazole est indiquée lors des quatre premiers cycles d'azacytidine dans les SMD de haut risque. Elle n'est pas nécessaire pour les SMD de bas risque sous EPO ou luspartercept.
- SMP : Pas de prophylaxie antifongique dans les SMP traités par ITK ou inhibiteur de JAK.
Pathologies lymphoïdes
- LAL : Aucune recommandation claire. Problématique de l'interaction avec le CYP3A4 qui métabolise la vincristine.
- LLC : Pas de recommandation claire, à discuter chez patients réfractaires sous IBTK.
- Lymphome : Pas de recommandation.
- Myélome multiple : Pas de recommandation, y compris pour les patients traités par anticorps bispécifques et CAR-T cells.
Références
1. Pagano L, Maschmeyer G, Lamoth F, Blennow O, Xhaard A, Spadea M, et al. Primary antifungal prophylaxis in hematological malignancies. Updated clinical practice guidelines by the European Conference on Infections in Leukemia (ECIL). Leukemia. 9 avr 2025;
2. Desoubeaux G, Bailly É, Chandenier J. Diagnosis of invasive pulmonary aspergillosis: updates and recommendations. Med Mal Infect. mars 2014;44(3):89-101.
3. Girmenia C, Ferretti A, Barberi W. Epidemiology and risk factors for invasive fungal diseases in hematopoietic stem cell transplantation. Curr Opin Hematol. nov 2014;21(6):459-65.
4. Caira M, Candoni A, Verga L, Busca A, Delia M, Nosari A, et al. Pre chemotherapy risk factors for invasive fungal diseases: prospective analysis of 1,192 patients with newly diagnosed acute myeloid leukemia (SEIFEM 2010-a multicenter study). Haematologica. févr 2015;100(2):284-92.
5. Donnelly JP, Chen SC, Kauffman CA, Steinbach WJ, Baddley JW, Verweij PE, et al. Revision and Update of the Consensus Definitions of Invasive Fungal Disease From the European Organization for Research and Treatment of Cancer and the Mycoses Study Group Education and Research Consortium. Clin Infect Dis Off Publ Infect Dis Soc Am. 12 sept 2020;71(6):1367-76.
6. Blot SI, Taccone FS, Van den Abeele AM, Bulpa P, Meersseman W, Brusselaers N, et al. A clinical algorithm to diagnose invasive pulmonary aspergillosis in critically ill patients. Am J Respir Crit Care Med. 1 juill 2012;186(1):56-64.
7. Serris A, Benzakoun J, Danion F, Porcher R, Sonneville R, Wolff M, et al. Cerebral aspergillosis in the era of new antifungals: The CEREALS national cohort study Nationwide CEREbral Aspergillosis Lesional study (CEREALS). J Infect. févr 2022;84(2):227-36.
8. Letailleur V, Jullien M, Garnier A, Peterlin P, Vantyghem S, Fourmont AM, et al. Posaconazole versus fluconazole as primary antifungal prophylaxis for patients at high risk of invasive fungal infections receiving allogeneic hematopoietic stem cell transplantation. Bone Marrow Transplant. 16 avr 2025;
9. Ullmann AJ, Aguado JM, Arikan-Akdagli S, Denning DW, Groll AH, Lagrou K, et al. Diagnosis and management of Aspergillus diseases: executive summary of the 2017 ESCMID-ECMM-ERS guideline. Clin Microbiol Infect Off Publ Eur Soc Clin Microbiol Infect Dis. mai 2018;24 Suppl 1:e1-38.
10. Alqarihi A, Kontoyiannis DP, Ibrahim AS. Mucormycosis in 2023: an update on pathogenesis and management. Front Cell Infect Microbiol. 2023;13:1254919.
11. Lanternier F, Dannaoui E, Morizot G, Elie C, Garcia-Hermoso D, Huerre M, et al. A global analysis of mucormycosis in France: the RetroZygo Study (2005-2007). Clin Infect Dis Off Publ Infect Dis Soc Am. févr 2012;54 Suppl 1:S35-43.
12. Coste A, Conrad A, Porcher R, Poirée S, Peterlin P, Defrance C, et al. Improving Diagnosis of Pulmonary Mucormycosis: Leads From a Contemporary National Study of 114 Cases. Chest. Nov 2023;164(5):1097-107.
13. Abdulkader RS, Mohan M, Saravanakumar D, Ponnaiah M, Bhatnagar T, Devika S, et al. Survival and quality-of-life in mucormycosis: a multicentric ambispective cohort study. Clin Microbiol Infect Off Publ Eur Soc Clin Microbiol Infect Dis. 12 juin 2025;S1198-743X(25)00286-1.
14. Jeong W, Keighley C, Wolfe R, Lee WL, Slavin MA, Kong DCM, et al. The epidemiology and clinical manifestations of mucormycosis: a systematic review and meta-analysis of case reports. Clin Microbiol Infect Off Publ Eur Soc Clin Microbiol Infect Dis. janv 2019;25(1):26 34.
15. Zagaliotis P, Walsh TJ. Recognizing the Early Risk-Based Clinical Manifestations of Mucormycosis: Cornerstones for Improved Survival and Therapeutic Outcomes. J Fungi. juill 2025;11(7):507.
16. Neofytos D, Horn D, Anaissie E, Steinbach W, Olyaei A, Fishman J, et al. Epidemiology and outcome of invasive fungal infection in adult hematopoietic stem cell transplant recipients: analysis of Multicenter Prospective Antifungal Therapy (PATH) Alliance registry. Clin Infect Dis Off Publ Infect Dis Soc Am. 1 févr 2009;48(3):265-73.
17. Said AM, Afridi F, Redell MS, Vrana C, O'Farrell C, Scheurer ME, et al. Invasive Candidiasis in Pediatric Hematologic Malignancy: Increased Risk of Dissemination With Candida tropicalis. Pediatr Infect Dis J. 1 janv 2025;44(1):58-63.
18. Vargas-Espíndola LA, Cuervo-Maldonado SI, Enciso-Olivera JL, Gómez-Rincón JC, Jiménez-Cetina L, Sánchez-Pedraza R, et al. Fungemia in Hospitalized Adult Patients with Hematological Malignancies: Epidemiology and Risk Factors. J Fungi Basel Switz. 24 mars 2023;9(4):400.
19. Cesaro S, Tridello G, Blijlevens N, Ljungman P, Craddock C, Michallet M, et al. Incidence, Risk Factors, and Long-term Outcome of Acute Leukemia Patients With Early Candidemia After Allogeneic Stem Cell Transplantation: A Study by the Acute Leukemia and Infectious Diseases Working Parties of European Society for Blood and Marrow Transplantation. Clin Infect Dis Off Publ Infect Dis Soc Am. 1 août 2018;67(4):564-72.
20. Cornely OA, Sprute R, Bassetti M, Chen SCA, Groll AH, Kurzai O, et al. Global guideline for the diagnosis and management of candidiasis: an initiative of the ECMM in cooperation with ISHAM and ASM. Lancet Infect Dis. mai 2025;25(5):e280-93.

Eva DESBROUSSES
Interne en Hématologie
au CHU de Tours

Pierre-Emmanuel PERDRIAU
interne en maladies
infectieuses et tropicales
au CHU de Tours

