
Généralités
Les GIST ou Tumeurs Stromales Gastro-Intestinales sont des tumeurs rares, elles représentent 1 % des tumeurs du tube digestif soit environ 1000 nouveaux cas par an en France. Elles font partie de la grande famille des sarcomes et en sont même la forme la plus fréquente (18 % des sarcomes sont des GIST).
Elles se développent aux dépens des cellules interstitielles de Cajal, cellules situées au niveau de la musculeuse de la paroi de l'ensemble du tube digestif et permettant le péristaltisme de ce dernier. Ainsi les GIST peuvent toucher l'ensemble du tube digestif, on les retrouve principalement au niveau de l'estomac (60 %) et de l'intestin grêle (30 %).
La plupart des GIST sont d'origine sporadiques, les cas familiaux sont très rares. Il n'existe pas de facteur de risque identifié de GIST, elles touchent autant les hommes que les femmes et la médiane d'âge au diagnostic est de 60 ans.
80 à 90 % des GIST sont diagnostiquées au stade localisé résécable (1), elles ont la particularité d'avoir un faible tropisme ganglionnaire et lorsqu'elles métastasent, c'est principalement par voie hématogène au niveau hépatique et péritonéale (=sarcomatose péritonéale), l'arrivée des TKI a révolutionné les durées médianes de survie chez ces patients.
Diagnostic et bilan initial
La biopsie à visée diagnostic n'est pas systématique (notamment en cas de GIST radiologiquement évidente et opérable d'emblée) car elle pose plusieurs problèmes, tout d'abord le risque de faux négatif en cas de biopsie superficielle en endoscopie car la tumeur se développe plus en profondeur dans la musculeuse du tube digestif, ainsi quand elle est décidée il est recommandé de réaliser la biopsie en écho-endoscopie ou par voie transcutanée ou chirurgicale. De plus la biopsie présente des risques majeurs, en premier le risque de complication hémorragique car les GIST sont des tumeurs très vascularisées, et ensuite le risque de dissémination intrapéritonéale (prévenu au maximum par l'utilisation d'aiguilles protégées).
Une fois l'échantillon tumoral obtenu, l'histologie et la positivité des marqueurs KIT (CD117) ou DOG1 en immunohistochimie permet de faire le diagnostic de la grande majorité des GIST.
Il est recommandé de réaliser systématiquement un génotypage tumoral permettant de caractériser le sous-type moléculaire de GIST ce qui a un intérêt pronostic et prédictif de réponse au traitement. On retrouve dans la plupart des cas des mutations des gènes codant pour les récepteurs à activité tyrosine-kinase KIT (75 à 80 % des cas) ou PDGF (10 %) (2). La présence de la mutation D842V de l'exon 18 du gène PDGFRA (6 % des cas) rend la GIST primitivement résistante à l'imatinib, cela concerne principalement les GIST gastriques ++++ (2). Enfin, les mutations SDH sont moins fréquentes, principalement en cas de GIST KIT négatif et PDGFRA négatif, elles sont souvent de meilleur pronostic et associées à des formes syndromiques.
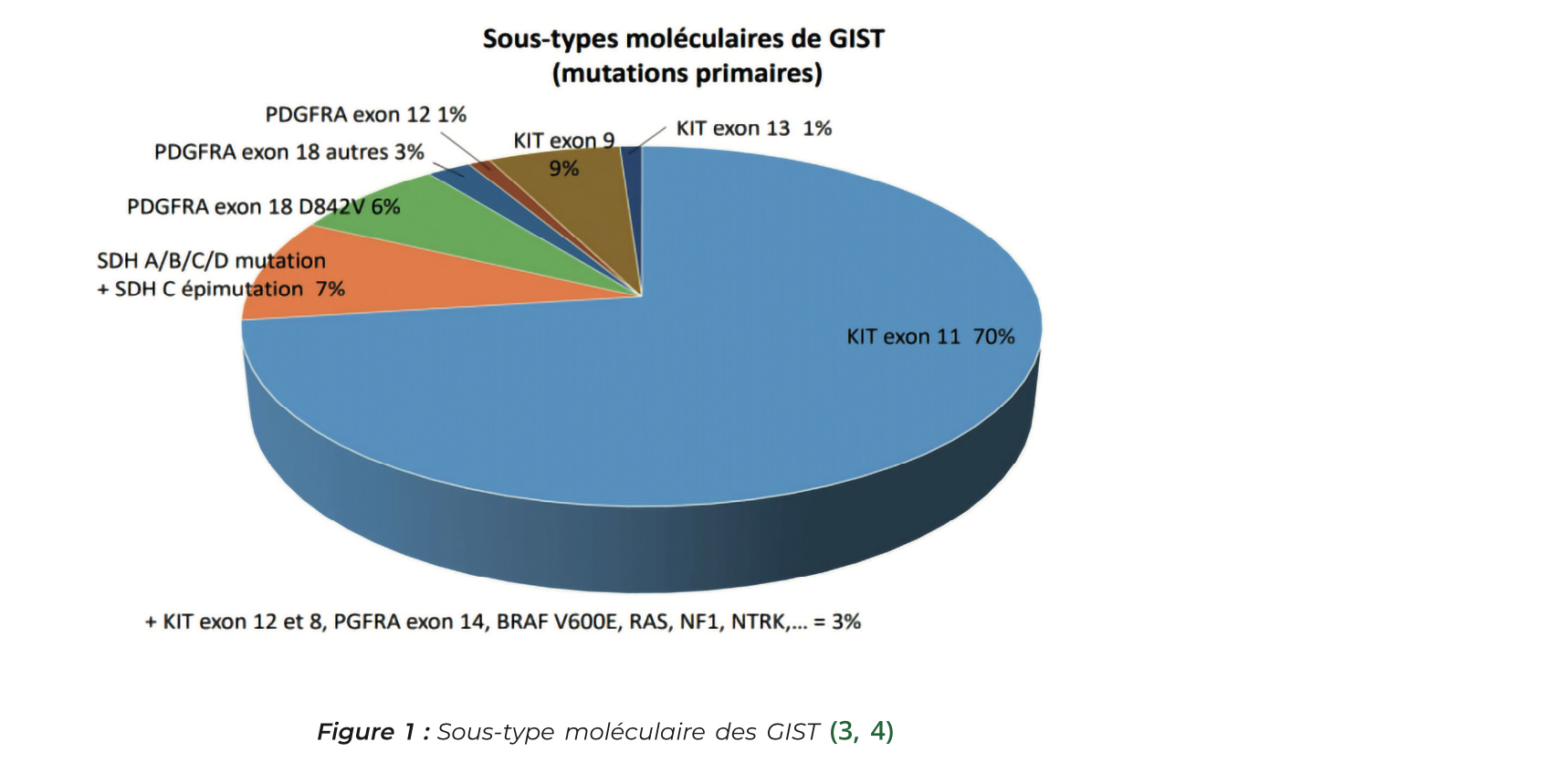
Le bilan systématique comprend un TDM TAP injecté qui permettra de faire le bilan d'extension locale et à distance. À l'imagerie la GIST typique est de grande taille, à contours réguliers avec un aspect hétérogène (présence de nécrose et de remaniements hémorragiques fréquents), elle a un développement extra luminal depuis la paroi du tube digestif, et elle se réhausse en périphérie lors de l'injection de produit de contraste.
Le bilan d'extension local est souvent complété par une écho-endoscopie en cas de discussion entre traitement chirurgical ou traitement néoadjuvant en cas de GIST localisée.
Prise en charge
La GIST étant rare, il est recommandé de présenter le dossier en RCP spécialisée dans l'un des 25 centre de référence NETSARC pour définir la prise en charge.
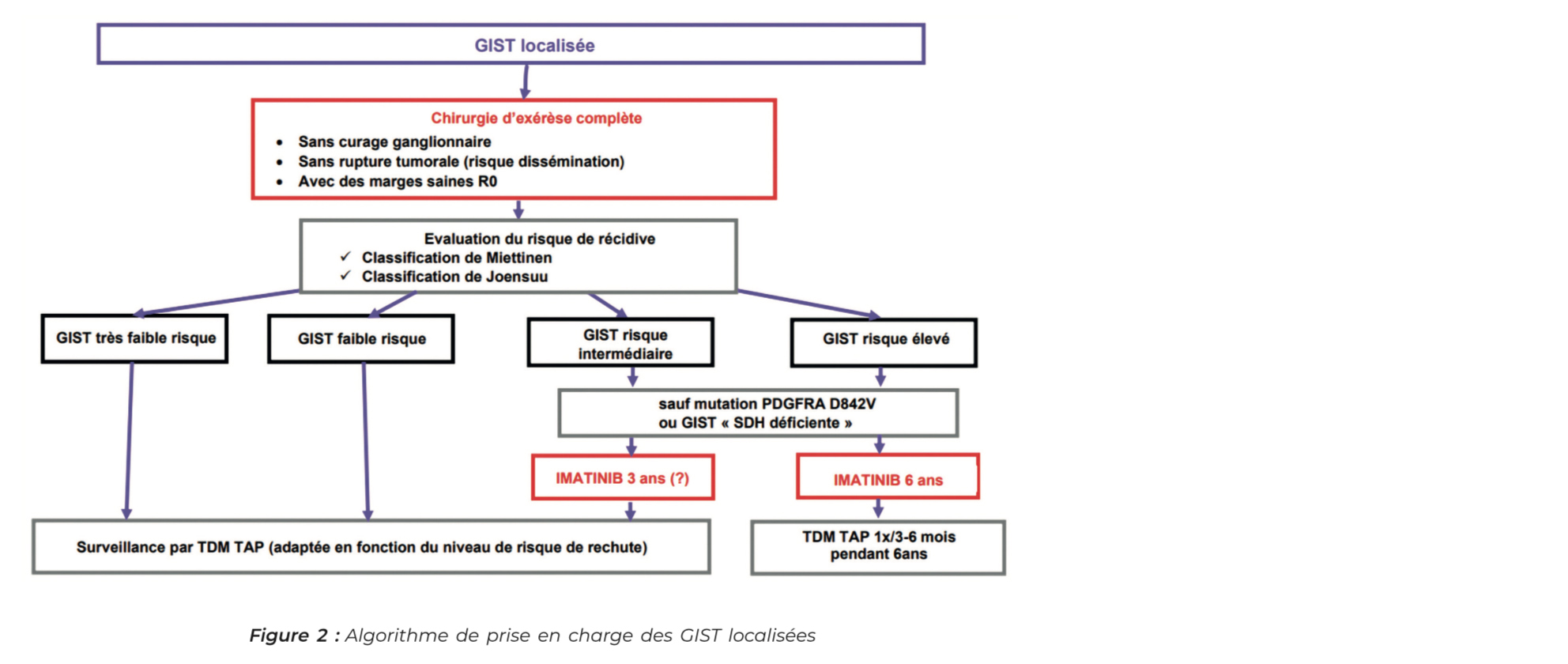
Stade localisé
1° La chirurgie
Les GIST de l'estomac inférieur à 2 cm sont probablement bénignes avec un risque métastatique quasi nul et pourraient même régresser spontanément ainsi on peut discuter pour ces patients, en RCP spécialisée, une surveillance par écho-endoscopie en alternative à la résection chirurgicale (5-7).
La prise en charge des GIST résécables non métastatiques repose sur une chirurgie d'exérèse qui doit être R0 (7, 8), et absolument éviter l'effraction tumorale en raison du risque hémorragique et du risque de dissémination tumorale.
Il n'y a en général, pas d'indication à un traitement néoadjuvant sauf en cas de GIST de résécabili- té douteuse ou de chirurgie mu- tilante, on peut réaliser un traitement néoadjuvant par imatinib 6 à 12 mois puis une résection chirurgicale secondaire dans un centre spécialisé puis un traitement adjuvant de nouveau par imatinib.
2° Traitement adjuvant
L'estimation du risque de récidive après chirurgie est fondamentale dans la prise en charge des GIST, sans traitement adjuvant les taux de récidive sont de 40 %.
La Classification TNM existe mais est peu utilisée en pratique, les 2 classifications les plus utilisées pour stratifier le risque de récidive sont les classifications de Miettinen (9) et NIH modifiée (ou classification de Joensuu) (10). Ces classifications assez proches, prennent en compte comme facteur de risque de récidive : le site tumoral, la taille tumorale, ainsi que l'index mitotique et la perforation qui est systématique- ment associée à un risque élevé de récidive (avec des pronostics similaires aux malades métastatiques) (10).
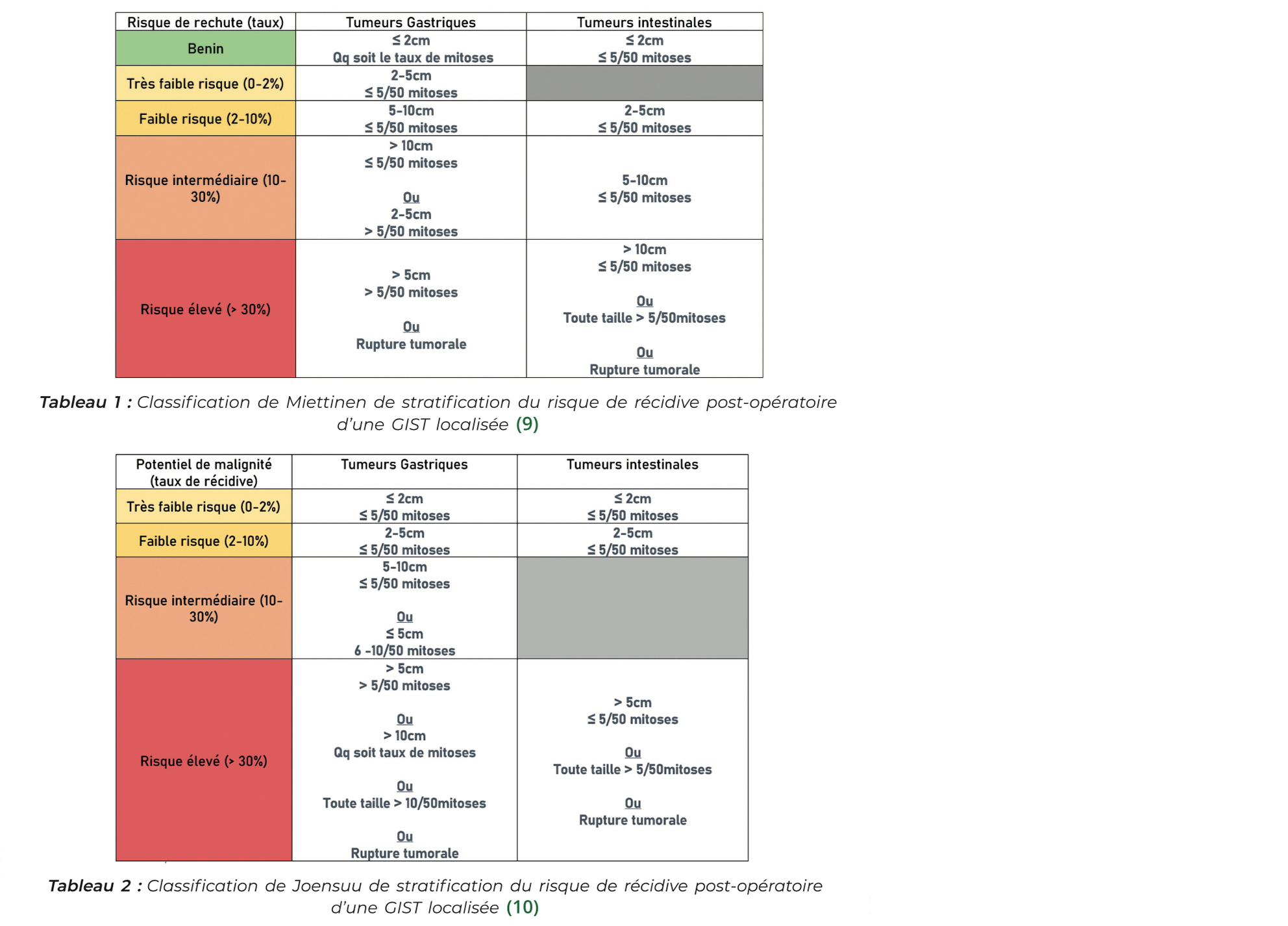
Pour les GIST à haut risque de récidive un traitement adjuvant par imatinib 6 ans est recommandé (11-14). Un traitement adjuvant de 3 ans pour les GIST à risque intermédiaire est à discuter en RCP spécialisée. Il n'y a pas d'indication à la réalisation d'un traitement adjuvant pour les GIST avec mutation PDGFRA de type p.D842V (20 % des GIST de l'estomac) qui ont une résistance primaire à l'imatinib et sont de bon pronostic. Le traitement adjuvant n'est également pas recommandé en cas de GIST « SDH déficiente ».
La surveillance est ensuite à adapter au niveau de risque de récidive et se fait par examen clinique et TDM TAP, la majorité des récidives surviennent dans les 5 ans suivant la chirurgie ou la fin du traitement adjuvant.
Stade avancé/métastatique
Il faut savoir que les GIST sont des tumeurs chimiorésistantes. L'arrivée des inhibiteurs de tyrosine kinase avec l'imatinib 400 mg/j (15) a permis de changer le pronostic de ces tumeurs avec des PFS passant de 20 à 30 mois dans l'étude princeps. Il y a indication à poursuivre le traitement jusqu'à progression, intolérance ou refus du patient. Les effets secondaires les plus fréquents de l'imatinib sont les œdèmes, l'asthénie, les crampes et les troubles digestifs, souvent d'intensité modérée et régressifs, il est important de les prendre en charge pour favoriser l'observance du traitement.
En cas de GIST métastatique avec mutation PDGFRA D842V (résistance primaire à l'imatinib), il existe un inhibiteur spécifique de cette mutation : l'avapritinib, indiqué en première ligne métastatique chez ces patients (16).
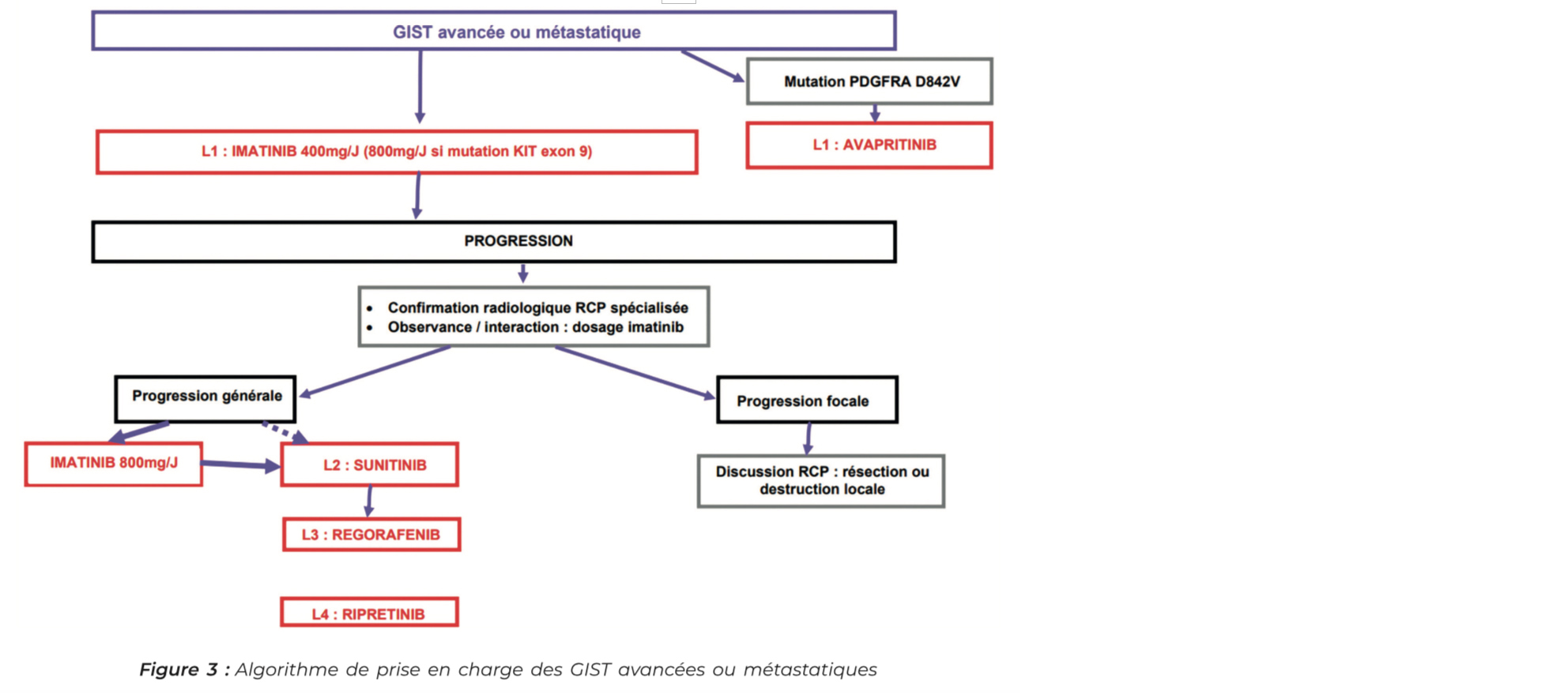
En cas de progression sous imatinib, il faut avoir plusieurs réflexes :
• Tout d'abord, il faut vérifier que la progression est effective en faisant relire l'imagerie en RCP spécialisée. Les critères RECIST de réponse tumorale ne sont pas adaptés à l'évaluation de la réponse tumorale dans les GIST traitées par imatinib. En effet en cas de réponse tumorale, la masse se nécrose et devient hypodense (intérêt de mesurer la densité tumorale) et la vascularisation diminue entraînant une diminution de la prise de contraste au temps injecté, mais la tumeur ne diminue pas forcément de taille et peut même initialement grossir. Des critères Recist modifiés ou critères CHOI (17) ont été développés et sont beaucoup plus adaptés pour évaluer la réponse scanographique des GIST.
• En cas de progression avérée à l'imagerie, il faut ensuite s'assurer de la bonne exposition du patient au traitement (observance, nombreuses interactions médicamenteuses notamment IPP) par dosage plasmatique du taux d'imatinib.
• Il est important ne pas arrêter immédiatement le traitement par imatinib lors du diagnostic de progression, en effet suspendre l'imatinib sans relais par un autre traitement par ITK est associé à un risque d'hyper progression tumorale par poussée des clones sensibles à l'imatinib, pouvant mener à une AEG compromettant les lignes de traitement ultérieur.
• En cas de progression primaire (inférieur à 6 mois) sous imatinib, il faut savoir également remettre en cause le diagnostic car c'est relativement rare inférieur à 10 % des cas.
Une fois la progression avérée, deux options thérapeutiques sont possible, la première est de majorer les doses d'Imatinib à 800 mg/j si la tolérance le permet, l'autre option est un Changement d'ITK par sunitinib qui agit sur plusieurs récepteurs tyrosine kinase transmembranaires (KIT, VEGF, PDGF), qui permet une PFS de 6.8 mois (18, 19).
Conclusion
Au total les GIST sont des tumeurs peu fréquentes, mais représentent le sous-type de sarcome le plus fréquent. Elles présentent une mutation de KIT ou PDGFRA dans 90 % des cas. Elles sont localisées dans 90 % des cas, avec un pronostic considérablement amélioré depuis l'arrivée des inhibiteurs de tyrosine kinase. Leur prise en charge doit systématiquement être discuté dans un réseau d'expertise spécialisé : NETSARC. Au stade localisé, la chirurgie est le pivot central de la prise en charge avec ensuite un traitement adjuvant par Imatinib selon le niveau de risque de récidive estimé. Les GIST sont chimiorésistantes, aux stades avancés, la prise en charge repose sur les ITK et notamment l'Imatinib en 1° ligne. Le génotypage tumoral présente un intérêt croissant avec le développement de biomarqueurs pronostic et prédictifs de la réponse au traitement.
Bibliographie
1. Emile JF, Brahimi S, Coindre JM, et al. Frequencies of KIT and PDGFRA mutations in the MolecGIST prospective population- based study differ from those of advanced GISTs. Med Oncol. 2012;29(3):1765-1772. doi:10.1007/s12032-011-0074-y.
2. Corless CL, Barnett CM, Heinrich MC. Gastrointestinal stromal tumours: origin and molecular oncology. Nat Rev Cancer. 2011;11(12):865-878. doi:10.1038/nrc3143.
3. Trent JC, Gómez-Peregrina D, Elliott A, et al. Multi-omic characterization of gastrointestinal stromal tumor (GIST) in a large real- world patient cohort. J Clin Oncol. 2023;41(16_suppl):11522-11522. doi:10.1200/JCO.2023.41.16_suppl.11522.
4. Landi B, Blay JY, Bonvalot S, et al. Gastrointestinal stromal tumours (GISTs): French Intergroup Clinical Practice Guidelines for diagnosis, treatments and follow-up (SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO). Dig Liver Dis. 2019;51(9):1223- 1231. doi:10.1016/j.dld.2019.07.006.
5. Yegin EG, Duman DG. Small EUS-suspected gastrointestinal stromal tumors of the stomach: An overview for the current state of management. Endosc Ultrasound. 2016;5(2):69-77. doi:10.4103/2303-9027.180469.
6. Fernández JÁ, Gómez-Ruiz ÁJ, Olivares V, et al. Clinical and pathological features of “small” GIST (≤2 cm). What is their prognostic value? Eur J Surg Oncol J Eur Soc Surg Oncol Br Assoc Surg Oncol. 2018;44(5):580-586. doi:10.1016/j.ejso.2018.01.087.
7. Casali PG, Blay JY, Abecassis N, et al. Gastrointestinal stromal tumours: ESMO–EURACAN–GENTURIS Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2022;33(1):20-33. doi:10.1016/j.annonc.2021.09.005.
8. Von Mehren M, Randall RL, Benjamin RS, et al. Gastrointestinal stromal tumors, version 2.2014. J Natl Compr Cancer Netw JNCCN. 2014;12(6):853-862. doi:10.6004/jnccn.2014.0080.
9. Miettinen M, Lasota J. Gastrointestinal stromal tumors: pathology and prognosis at different sites. Semin Diagn Pathol. 2006;23(2):70-83. doi:10.1053/j.semdp.2006.09.001.
10. Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor. Hum Pathol. 2008;39(10):1411-1419. doi:10.1016/j.humpath.2008.06.025.
11. Blay JY, Penel N, Schiffler C, Chabaud S, Perol D, Le Cesne A. Six years duration of adjuvant imatinib improves disease-free survival in GIST with a high risk of relapse. Ann Oncol Off J Eur Soc Med Oncol. 2025;36(1):120-121. doi:10.1016/j.annonc.2024.09.018.
12. DeMatteo RP, Ballman KV, Antonescu CR, et al. Placebo-Controlled Randomized Trial of Adjuvant Imatinib Mesylate Following the Resection of Localized, Primary Gastrointestinal Stromal Tumor (GIST). Lancet. 2009;373(9669):1097-1104. doi:10.1016/ S0140-6736(09)60500-6.
13. JoensuuH,ErikssonM,SundbyHallK,etal.AdjuvantImatinibforHigh-RiskGIStromalTumor:AnalysisofaRandomizedTrial.
J Clin Oncol. 2016;34(3):244-250. doi:10.1200/JCO.2015.62.9170.
14. Blay JY, Schiffler C, Bouché O, et al. A randomized study of 6 versus 3 years of adjuvant imatinib in patients with localized GIST at high risk of relapse. Ann Oncol Off J Eur Soc Med Oncol. 2024;35(12):1157-1168. doi:10.1016/j.annonc.2024.08.2343.
15. Demetri GD, von Mehren M, Blanke CD, et al. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med. 2002;347(7):472-480. doi:10.1056/NEJMoa020461.
16. Heinrich MC, Jones RL, Mehren M von, et al. Avapritinib in advanced PDGFRA D842V-mutant gastrointestinal stromal tumour (NAVIGATOR): a multicentre, open-label, phase 1 trial. Lancet Oncol. 2020;21(7):935-946. doi:10.1016/S1470-2045(20)30269-2.
17. Choi H. Response evaluation of gastrointestinal stromal tumors. The Oncologist. 2008;13 Suppl 2:4-7. doi:10.1634/ theoncologist.13-S2-4.
18. Demetri GD, van Oosterom AT, Garrett CR, et al. Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: a randomised controlled trial. Lancet Lond Engl. 2006;368(9544):1329-1338. doi:10.1016/S0140-6736(06)69446-4.
19. Heinrich MC, Owzar K, Corless CL, et al. Correlation of kinase genotype and clinical outcome in the North American Intergroup Phase III Trial of imatinib mesylate for treatment of advanced gastrointestinal stromal tumor: CALGB 150105 Study by Cancer and Leukemia Group B and Southwest Oncology Group. J Cli.

Par Alix CELARIER
Interne d'oncologie médicale AERIO

