Méthodes d'évaluation et utilisation en clinique
Méthodes d'évaluation
a. Le développement de l'évaluation médullaire
La cytométrie en flux (CMF)
La CMF repose sur l'identification des plasmocytes tumoraux par leurs caractéristiques phénotypiques. Cette méthode se base sur la bonne homogénéité et la stabilité phénotypiques du myélome multiple (MM) portant sur dix marqueurs, incluant des marqueurs spécifiques de la monotypie (en pratique, c'est souvent le panel EuroFlow qui est utilisé). Les avantages de la CMF incluent sa disponibilité et sa rapidité. Cependant, elle présente des inconvénients comme la nécessité d'analyser rapidement le prélèvement en raison de la survie limitée des plasmocytes in vitro. Pour atteindre une sensibilité de 10-6, comparable à la nouvelle génération de cytométrie en flux (NGF)1 , il faut analyser au moins 10 millions de cellules, ce qui pose des contraintes pratiques. Les coûts associés à l'évaluation de la MRD par CMF sont d'environ 80 €.
Le next generation sequencing (NGS)
Le NGS évalue les réarrangements clonaux des gènes d'immunoglobulines (IGH, IGK, IGL). L'ADN de la moelle osseuse est extrait, puis une PCR multiplex amplifie les séquences des gènes IGH, IGK et IGL permettant de créer une bibliothèque. Son avantage est la possibilité d'analyser du matériel congelé, éliminant ainsi les contraintes logistiques. Cependant, il est nécessaire d'analyser le prélèvement au diagnostic pour identifier les réarrangements clonaux spécifiques au patient, c'est la phase de calibration. L'évaluation économique de la MRD par NGS est d'environ 880 € par point de MRD.
Comparaison entre CMF et NGS pour la MRD
Il existe une bonne corrélation mais des discordances peuvent survenir entre les deux techniques : les plasmocytes apoptotiques non détectés par CMF ont leur ADN détecté par NGS. Des essais cliniques tels que FORTE2 et CASSIOPEIA3 ont montré une corrélation de 86 % et 84 % respectivement à une sensibilité de 10-5, avec des discordances principalement dues aux cas CMF- / NGS+.
b. Le développement de l'évaluation de la MRD circulante
L'évaluation de la MRD par NGS présente également un seuil de sensibilité inférieur par rapport à la MRD de cytométrie en flux4. Le séquençage du génome entier à faible passe (LPWGS) de l'ADNc tumoral est utilisé pour prédire la survie sans progression (SSP) en estimant le nombre de copies (CNV)5. Un défi persiste pour distinguer l'ADNc non tumoral de celui provenant des plasmocytes sains. L'analyse de la MRD circulante peut orienter le traitement, en identifiant des anomalies génétiques spécifiques comme une délétion d(BCMA) ou une translocation t(11;14).
c. La spectrométrie de masse
La spectrométrie de masse, notamment par MALDI-TOF ou chromatographie liquide, permet de détecter l'immunoglobuline produite par le clone plasmocytaire. Elle peut compléter les méthodes classiques d'évaluation de la MRD, offrant une sensibilité supérieure à l'électrophorèse des protéines6.
d. Une imagerie complémentaire, la TEP TDM
La tomographie par émission de positons (TEP) couplée au scanner compense les limites des prélèvements médullaires en permettant la détection de la maladie résiduelle extramédullaire. La disparition des lésions hypermétaboliques au TEP-scan conforte un statut MRD négatif. Ces patients « double négatif » bénéficient des SSP et survies globales (SG) les plus longues. La TEP est utile pour le diagnostic et le suivi, avec une excellente spécificité. Toutefois, des limitations existent, comme le risque de faux négatifs lié à une faible expression du gène de l'hexokinase 2, nécessitant parfois l'utilisation de traceurs alternatifs tels que la 11C-méthionine7 . Le rôle pronostique du TEP-scan est particulièrement pertinent en cas de rechute et chez les patients traités par cellules CAR T, car la maladie résiduelle extramédullaire (EMD) représente un facteur de mauvais pronostic.
e. Vers une MRD non invasive ?
Une étude positive réalisée dans le cadre de l'essai clinique PETHEMA /GEM a exploré la MRD « non invasive » à partir de différents échantillons : sang périphérique pour l'ADN tumoral circulant et sérum par spectrométrie de masse8. Dans cette étude, la validation d'une MRD négative en spectrométrie de masse, en médullaire et en circulant permettait d'obtenir une valeur prédictive positive (VPP) de 84 % équivalent à la VPP de la MRD obtenue en NGF en médullaire.
Utilisation en clinique
a. MRD négative, un nouvel objectif : « surrogate marker » ?
L'évaluation de la MRD est cruciale dans les études cliniques en raison de sa puissance pronostique. Elle est souvent l'objectif principal ou co-principal dans de nombreuses études, orientant le choix et la durée du traitement avec un impact significatif sur la SSP et la SG. La MRD est une méthode rapide pour évaluer la réponse au traitement, particulièrement nécessaire si l'on considère les longues SSP permises par les traitements actuels.
L'impact pronostique de la MRD est pertinent chez tous les sous-groupes de patients atteints de MM (jeunes, âgés, en rechute, de cytogénétique standard ou à haut risque). Plus la méthode d'évaluation est sensible, plus son impact pronostique est conséquent.
b. Profondeur, durée et rapidité pronostiques
La rapidité, la profondeur et la durée de la réponse MRD ont un impact pronostique significatif. L'IMWG propose d'évaluer la MRD chez les patients en très bonne réponse partielle. Une discordance apparente entre MRD indétectable et réponse complète peut exister en raison de la persistance de la protéine monoclonale.
c. Pratiques cliniques – outils d'adaptation thérapeutique
L'utilisation de la MRD en pratique clinique n'est pas encore recommandée hors essais cliniques. Cependant, la MRD est de plus en plus considérée comme un objectif primaire dans les nouveaux essais, en raison de son pouvoir prédictif. Des études comme celle de Munshi9 sur le critère de « prediction » de Prentice10 (ie la MRD doit être un marqueur indépendant de PFS) et celle de Pavia11 sur le critère de « capture » de Prentice (ie l'effet du traitement doit être le même sur la PFS et la MRD) explorent cette idée. Les autorités de santé, comme la FDA et l'EMA, n'ont pas encore reconnu la MRD comme marqueur de substitution pour son utilisation potentielle dans les essais d'enregistrement.
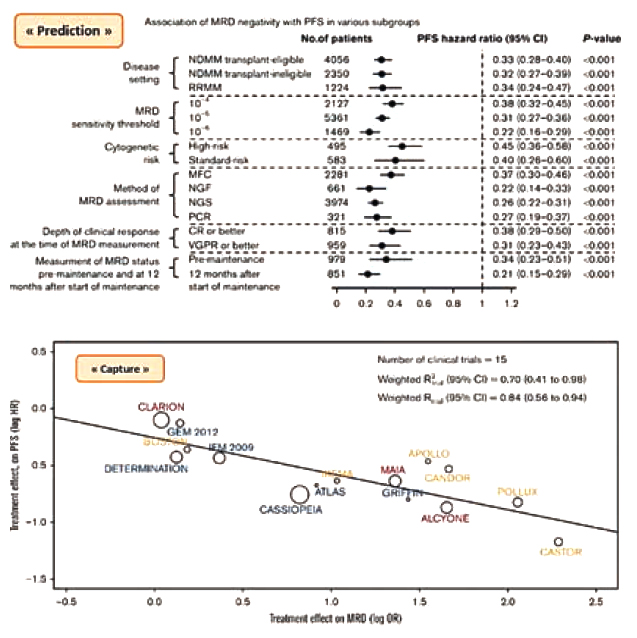
La MRD comme « surrogate » marqueur doit répondre aux critères de « prediction » et de « capture » de Prentice9-11.
La fréquence des évaluations de la MRD pourrait varier selon le profil du patient. Des essais cliniques spécifiques, tels que MIDAS(NCT04934475), MASTER(NCT03224507), AURIGA(NCT03901963), OPTIMUM(NCT02425644), DRAMMATIC(NCT04071457) et PERSEUS (NCT03710603), étudient l'adaptation thérapeutique basée sur le statut MRD et ses implications pour la SSP.
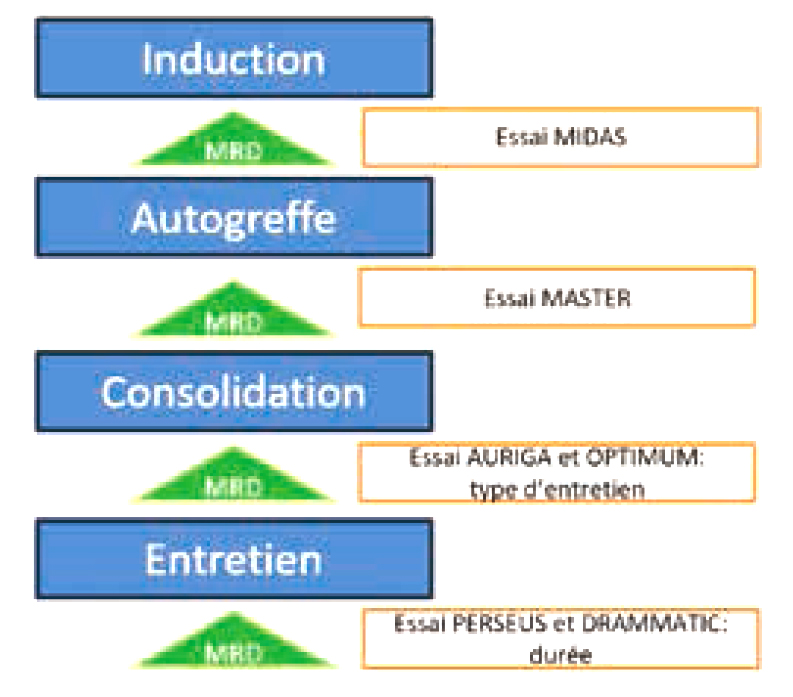
La MRD comme « driver » de négativité dans les différents essais clinique.
Conclusion
Les méthodes hautement sensibles comme le NGS et le NGF restent essentielles pour l'évaluation de la MRD dans le MM. Leur intégration avec l'imagerie et la MRD circulante pourrait fournir des évaluations plus robustes. La MRD est de plus en plus considérée comme un critère de substitution dans les essais cliniques, mais des limitations existent notamment le manque de consensus sur le moment optimal de mesure de la MRD. Certains patients atteignent la négativité de la MRD mais rechutent précocement, et il existe des incertitudes sur la nécessité de réévaluer la MRD dans le temps et sur la durée optimale de la négativité soutenue. Enfin, la MRD pourrait ne pas être un critère thérapeutique chez certains patients, comme ceux atteints de MGUS, ou chez les patients âgés. Dans l'essai MAIA, la proportion de patients atteignant une MRD négative était inférieure à 30 % malgré une PFS supérieure à 5 ans. Comme vu dans l'essai Bellini12, l'autre limitation majeure est que contrairement à la SG, la MRD n'inclut pas les décès, il conviendrait donc de combiner les résultats de MRD avec les données de sécurité.

Bénédicte PIRON
Interne en Hématologie
CHU de Nant
Références
1. Flores-Montero J, Sanoja-Flores L, Paiva B, Puig N, GarcíaSánchez O, Böttcher S, et al. Next Generation Flow for highly sensitive and standardized detection of minimal residual disease in multiple myeloma. Leukemia. oct 2017;31(10):2094-103.
2. Oliva S, Genuardi E, Paris L, D'Agostino M, Rogers J, RotaScalabrini D, et al. Prospective evaluation of minimal residual disease in the phase II FORTE trial: a head-tohead comparison between multiparameter fl ow cytometry and next-generation sequencing. EClinicalMedicine. juin 2023;60:102016.
3. Moreau P, Hulin C, Perrot A, Arnulf B, Belhadj K, Benboubker L, et al. Bortezomib, thalidomide, and dexamethasone with or without daratumumab and followed by daratumumab maintenance or observation in transplant-eligible newly diagnosed multiple myeloma: long-term follow-up of the CASSIOPEIA randomised controlled phase 3 trial. Lancet Oncol. 14 juin 2024;S1470-2045(24)00282-1.
4. Mazzotti C, Buisson L, Maheo S, Perrot A, Chretien ML, Leleu X, et al. Myeloma MRD by deep sequencing from circulating tumor DNA does not correlate with results obtained in the bone marrow. Blood Adv. 24 oct 2018;2(21):2811-3.
5. Waldschmidt JM, Yee AJ, Vijaykumar T, Pinto RA, Frede J, Anand P, et al. Cell-free DNA for the detection of emerging treatment failure in relapsed/ refractory multiple myeloma. Leukemia. avr 2022;36(4):1078-87.
6. Barrio S, Martinez-Laperche C, Martín-Muñoz A, Rodriguez M, Rufian L, de la Iglesia I, et al. Personalized Monitoring of Circulating Tumor DNA By a Specific Signature of Trackable Mutations after Chimeric Antigen Receptor t-Cell Therapy in Non-Hodgkin B Cell Lymphoma. Blood. 2 nov 2023;142(Supplement 1):6087.
7. Kraeber-Bodéré F, Zweegman S, Perrot A, Hulin C, Caillot D, Facon T, et al. Prognostic value of positron emission tomography/computed tomography in transplanteligible newly diagnosed multiple myeloma patients from CASSIOPEIA: the CASSIOPET study. Haematologica. 1 févr 2023;108(2):621-6.
8. Gonzalez C, Lasa M, Notarfranchi L, Agullo C, Buenache Cuenda N, Zherniakova A, et al. Minimally Invasive Assessment of Measurable Residual Disease (MRD) in Multiple Myeloma (MM). Blood. 2 nov 2023;142(Supplement 1):339-339.
9. Munshi NC, Avet-Loiseau H, Anderson KC, Neri P, Paiva B, Samur M, et al. A large meta-analysis establishes the role of MRD negativity in long-term survival outcomes in patients with multiple myeloma. Blood Adv. 8 déc 2020;4(23):5988-99.
10. Prentice RL. Surrogate endpoints in clinical trials: definition and operational criteria. Stat Med. avr 1989;8(4):431-40.
11. Paiva B, Zherniakova A, Nuñez-Córdoba JM, RodriguezOtero P, Shi Q, Munshi NC, et al. Impact of treatment effect on MRD and PFS: an aggregate data analysis from randomized clinical trials in multiple myeloma. Blood Adv. 9 janv 2024;8(1):219-23.
12. Kumar SK, Harrison SJ, Cavo M, de la Rubia J, Popat R, Gasparetto C, et al. Venetoclax or placebo in combination with bortezomib and dexamethasone in patients with relapsed or refractory multiple myeloma (BELLINI): a randomised, double-blind, multicentre, phase 3 trial. Lancet Oncol. déc 2020;21(12):1630-42.

