Premiers résultats de l'étude randomisée multicentrique de phase III triangle
Ibrutinib combined with immunochemotherapy with or without autologous stem-cell transplantation versus immunochemotherapy and autologous stem-cell transplantation in previously untreated patients with mantle cell lymphoma (triangle): a three-arm, randomised, open-label, phase 3 superiority trial of the european mantle cell lymphoma network.
M. Dreyling, J. Doorduijn, E. Gine et al, The Lancet, 2024
Le lymphome à cellules du manteau (LCM) représente 5-7 % des lymphomes non hodgkiniens (LNH) et s'exprime sous différentes formes (LCM in situ, classique, pléimorphe ou blastoïde) dont l'évolution varie également d'indolente à rapidement progressive. Concernant les formes agressives, plus de 80 % des LCM présentent des localisations extra-nodulaires.
L'autogreffe a prouvé son intérêt dans le traitement des lymphomes à cellules du manteau depuis quelques années maintenant. Ainsi en France, chez les patients de moins de 65 ans éligibles à l'autogreffe, le choix du traitement de 1e ligne repose sur 4 cures de R-DHAOx/R-DHAC puis une autogreffe conditionnée par R-BEAM suivie d'une maintenance par Rituximab pendant 3 ans avec un impact sur la survie sans progression et sur la survie globale1–3.
Alors que l'apport de l'Ibrutinib et autres IBTK dans les lymphomes à cellules du manteau réfractaires ou en rechutes n'est plus à prouver, l'essai de phase 3 SHINE4 a récemment montré son efficacité en 1e ligne en association avec la Bendamustine et le Rituximab suivi d'un traitement d'entretien par Rituximab chez les patients atteints de lymphome à cellules du manteau de 65 ans ou plus sans possibilité d'autogreffe de CSH. Mais qu'en est-il chez les patients de moins de 65 ans en 1e ligne avec ou à la place de l'autogreffe de CSH ?
Méthode
L'essai TRIANGLE est un essai de cohorte prospective randomisé multicentrique mené sur 165 centres (secondaires, tertiaires) de 14 pays (dont 13 en Europe). Il concernait les patients de moins de 65 ans, atteints d'un lymphome à cellules du manteau de stade II à IV sans traitement préalable. L'objectif était de comparer trois groupes randomisés (1:1:1) : le groupe contrôle traité par chimiothérapie puis autogreffe (groupe A) ; le groupe A+I avec ajout d'Ibrutinib (J1-J19) à la chimiothérapie puis autogreffe ; et le groupe I recevant l'Ibrutinib en association aux cycles de chimiothérapie sans autogreffe.
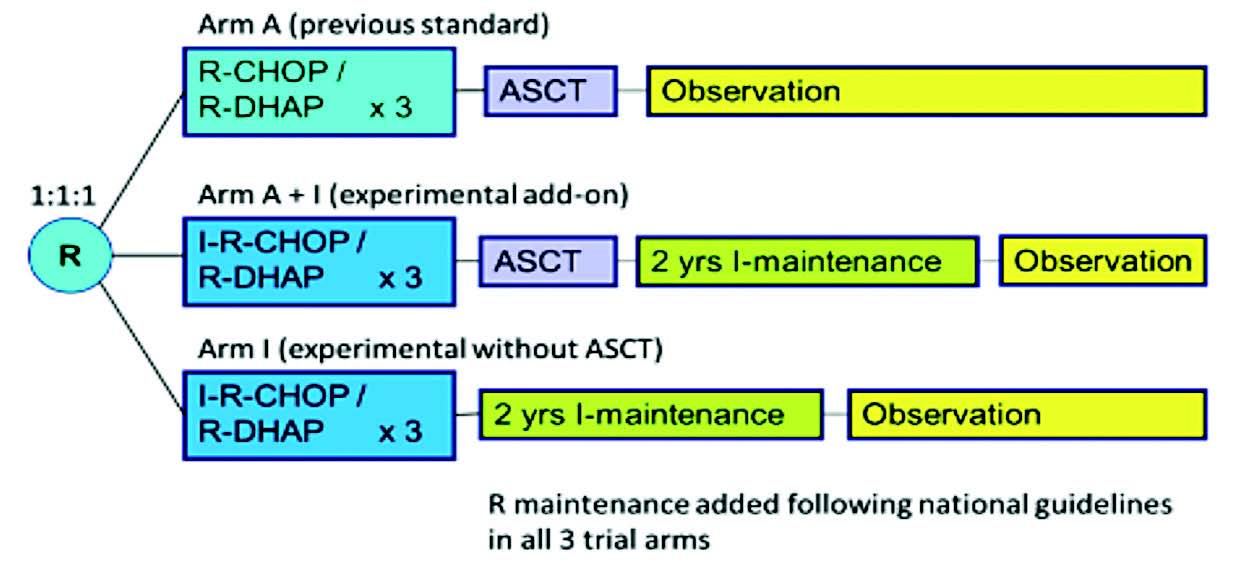
Figure 1 : Design de l'essai clinique
Les autogreffes étaient conditionnées par THAM/BEAM/TEAM. Dans chacun des groupes une maintenance par Rituximab +/- Ibrutinib selon le groupe de randomisation pouvait être instaurée au choix du centre. L'essai était un essai de supériorité évaluant 3 hypothèses statistiques : supériorité de A+I par rapport à I, supériorité de A+I par rapport à A et supériorité de A par rapport à I.
La survie sans échec était le critère de jugement principal, les analyses étaient réalisées en intention de traiter et intention de traiter modifié.
Résultats
De juillet 2016 à décembre 2020, 870 patients ont été randomisés dans les différents groupes : 288 dans le groupe A, 292 dans le groupe A+I et 290 dans le groupe I. La plupart des patients étaient des hommes (76 %, représentatif de la population d'intérêt)5, et l'âge médian de 57 ans. L'essentiel des patients (85 %) avait un MIPI de risque faible ou intermédiaire. Après un suivi médian de 31 mois, la survie sans échec était significativement supérieure pour le groupe A+I (88 %) par rapport au groupe A (72 %) (figure 2), sans impact de la forme cytologique, ou de la maintenance (ou non) par Rituximab (figure 2). En revanche, le bénéfice de l'apport de l'Ibrutinib à l'autogreffe était d'autant plus important dans les sous-groupes de patients de haut risque biologique (MIPI combiné élevé ou p53 > 50 %).
Parallèlement les patients traités dans le groupe contrôle (A) n'ont pas montré de meilleure survie sans échec que ceux traités dans le groupe I, quel que soit le sous-groupe d'analyse. Il en est de même pour la survie sans progression. Concernant la survie globale à 3 ans, elle est également supérieure dans les groupes avec Ibrutinib (groupe A+I 91 % et groupe I 92 %) par rapport au groupe contrôle autogreffe (86 %).
En cumulant les taux de réponse complète (RC) des groupes A+I et I, 45 % des patients sous Ibrutinib étaient en RC contre 36 % de ceux sans Ibrutinib. En revanche, cette tendance semble moins franche sur les taux de survie globale avec respectivement 98 % en cumulant les groupes traités par Ibrutinib vs 94 % pour le groupe des patients autogreffés sans IBTK associés, bien que cette analyse soit encore précoce.
Les effets indésirables de grade 3-5 concernaient principalement l'hémato-toxicité (anémie et thrombopénie) : 71 % des patients traités par R-CHOP/R-DHAC seul et 76 % du groupe A+I. Au cours de l'autogreffe, l'hémato-toxicité de grade 3-5 concernait 59 % des patients sans distinction de groupe de traitement (A ou A+I), suivi par la toxicité digestive (environ 20 %). Les infections concernaient 20 % des patients sous Ibrutinib et 17 % des patients autogreffés sans Ibrutinib.
Durant la phase d'induction, la mortalité non liée à la rechute était similaire entre les groupes : un patient est décédé de diarrhées de grade V, un autre de méléna et un dernier d'une infection pulmonaire. Dans le groupe avec Ibrutinib, un patient est décédé d'une infection pulmonaire et un autre s'est suicidé. Pendant l'autogreffe, les taux de décès étaient comparables (2 %), principalement dus à des complications infectieuses (sepsis et pneumopathie).
Au cours de la phase de maintenance, les décès dus à des infections graves étaient similaires dans les trois groupes de comparaison (1 %), principalement des infections à Coronavirus chez les patients sous Ibrutinib. Il n'y avait pas de surincidence des décès liés à des complications cardiovasculaires dans le groupe traité par Ibrutinib (0,5 % vs 0,5 % dans le groupe sans maintenance et 0 % dans le groupe Rituximab).
Pendant la phase de maintenance une sous-analyse a montré une meilleure durée de rémission en cas d'ajout du Rituximab à l'Ibrutinib respectivement 72 % vs 49 % dans le groupe A+I et 33 % dans le groupe I. On retiendra cependant un risque infectieux majoré avec plus de 60 % d'infections dont la moitié de grades 3-5.
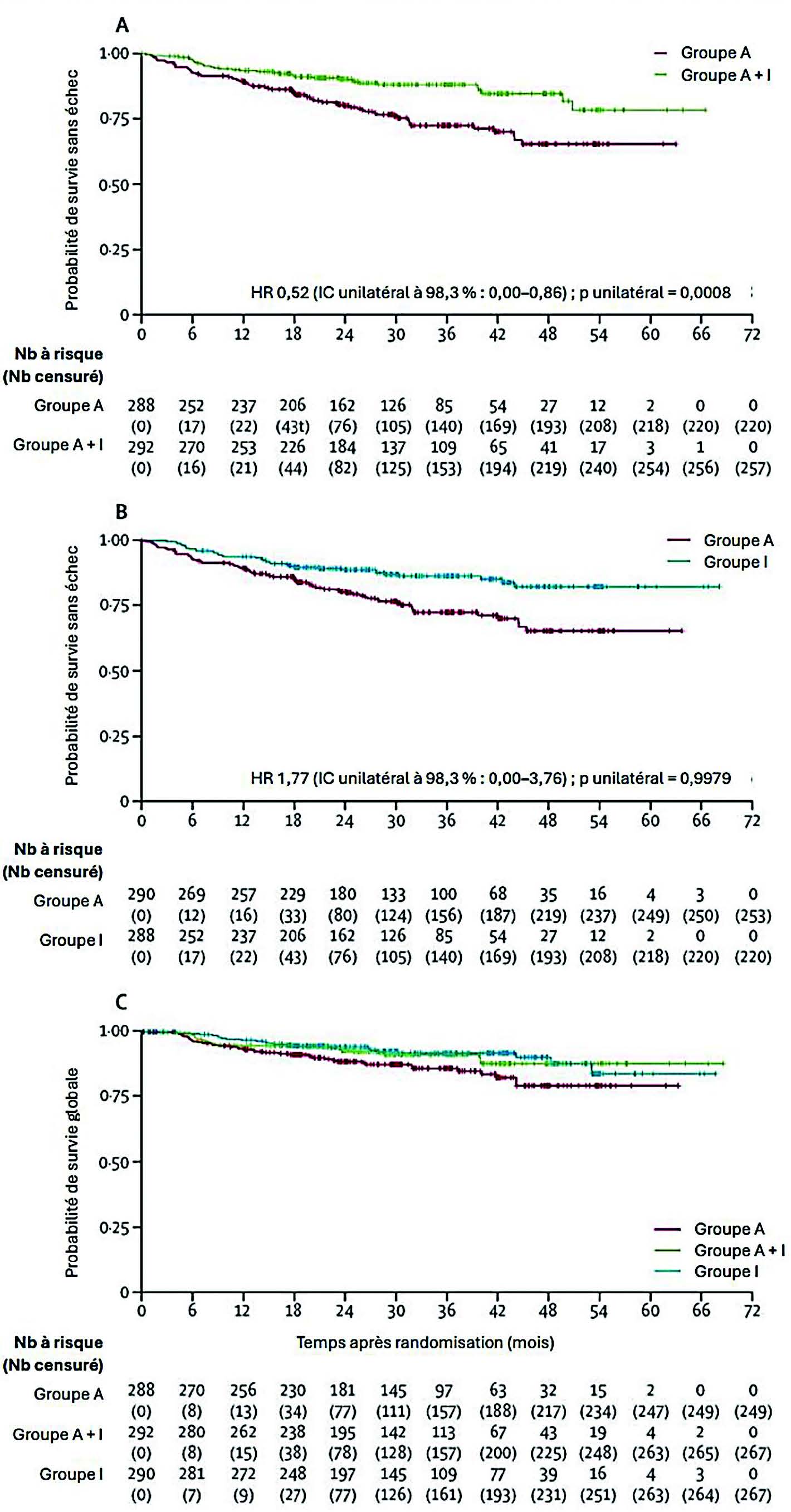
Figure 2 : Survie sans échec des groupe A+I vs groupe A (A), groupe A vs groupe I et survie globale de chaque groupe (C)
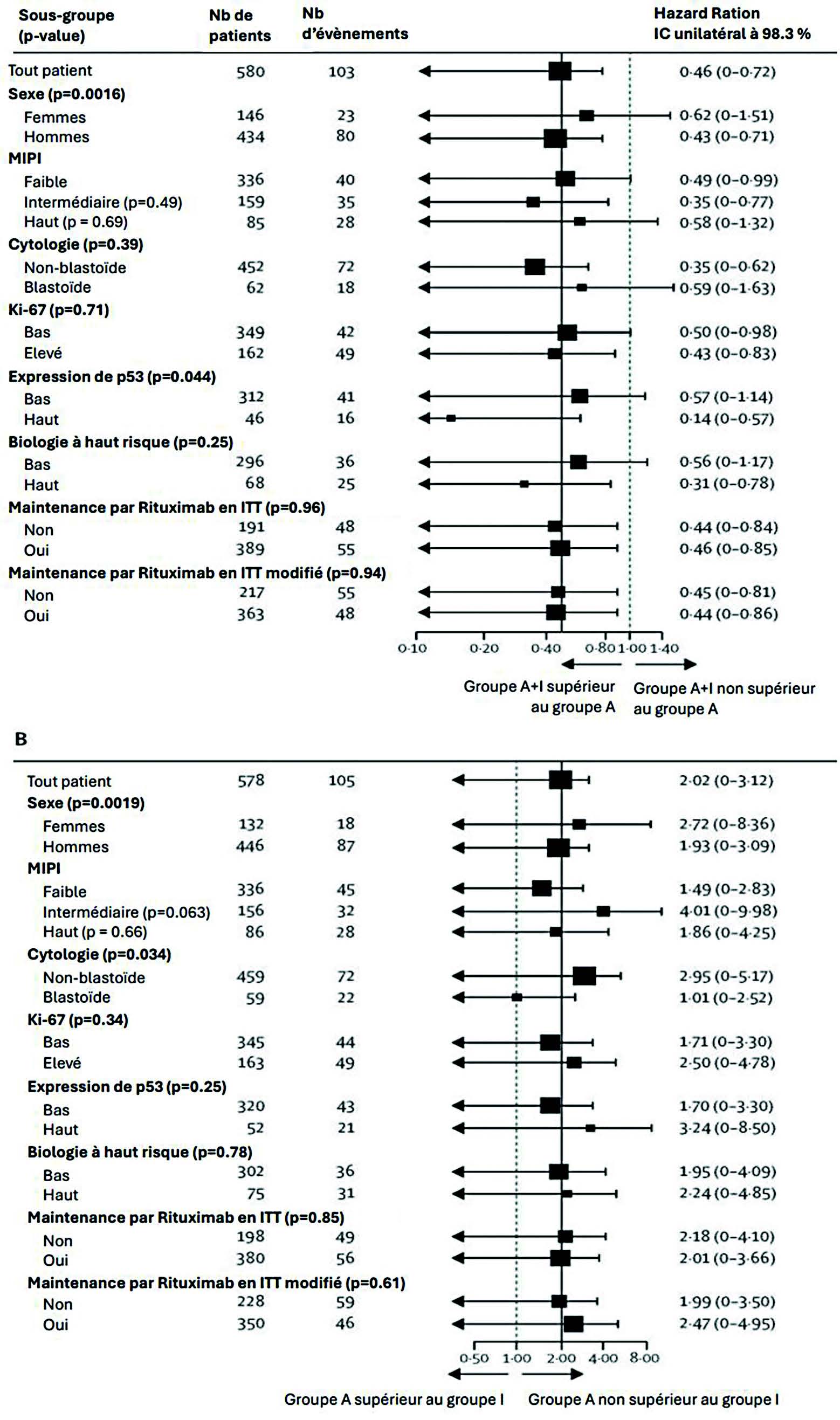
Figure 3 : Forest plot de l'analyse en sous-groupes de la survie sans échec dans les groupe A+I vs groupe A (A) et groupe A vs groupe I (B)
Discussion
L'essai TRIANGLE a montré une amélioration de la survie sans échec ainsi que de la survie globale via l'ajout de l'Ibrutinib à la polychimiothérapie du lymphome à cellule du manteau en ligne des patients jeunes. Plus particulièrement dans les groupes de patients mutés p53. Le choix de la survie sans échec comme critère de jugement principal permettait de prendre en compte la stabilité de la maladie, un facteur connu pour être de mauvais pronostic dans le lymphome du manteau. À noter que, sur le plan méthodologique, les auteurs ont bien anticipé et corrigé le phénomène d'inflation du risque alpha lié à la multiplicité des tests.
Cependant, alors que les résultats de la cohorte LyMa suggérait la supériorité d'une chimiothérapie d'induction comportant des sels de platine et notamment du R-DHAOx, bien moins néphrotoxique3, 6. Il est donc dommage qu'il n'apparaisse pas dans les différents groupes comparatifs. Par ailleurs, l'exclusion des patients sous anticoagulants, en plus d'induire un biais de sélection laisse la question en suspens dans cette population non négligeable en hématologie. C'est un point sur lequel il faudra rester vigilant en pratique clinique.
La comparaison des résultats des patients traités par autogreffe + Ibrutinib vs Ibrutinib, non encore disponible dans l'article, a fait l'objet d'une présentation au congrès de la Société Américaine d'Hématologie de 2024. Les résultats confirment la supériorité de l'Ibrutinib sans autogreffe par rapport au traitement par autogreffe seul à la fois en termes de PFS et d'OS. Le schéma intensification/autogreffe n'a donc pas montré de supériorité et présente des effets indésirables non négligeables. On assiste donc à un vrai changement de paradigme avec la possibilité d'une redéfinition des recommandations de 1e ligne de traitement des LCM des patients « fit » dans un avenir proche afin de privilégier un traitement par Ibrutinib+R-polychimiothérapie suivi d'une maintenance par Ibrutinib de 2 ans et sans autogreffe.
La demande d'AMM dans cette indication a été soumise.
Une affaire à suivre…

Ambre DENINIOLLE
Interne en Hématologie clinique
des Antilles-Guyane, en exercice au CHU de Nantes
Bibliographie
1. Hermine O, Jiang L, Walewski J, Bosly A, Thieblemont C, Szymczyk M, et al. High-Dose Cytarabine and Autologous Stem-Cell Transplantation in Mantle Cell Lymphoma: Long-Term Follow-Up of the Randomized Mantle Cell Lymphoma Younger Trial of the European Mantle Cell Lymphoma Network. J Clin Oncol OffJ Am Soc Clin Oncol. 20 janv 2023;41(3):479-84.
2. Zoellner AK, Unterhalt M, Stilgenbauer S, Hübel K, Thieblemont C, Metzner B, et al. Long-term survival of patients with mantle cell lymphoma after autologous haematopoietic stem-cell transplantation in first remission: a post-hoc analysis of an openlabel, multicentre, randomised, phase 3 trial. Lancet Haematol. 1 sept 2021;8(9):e648-57.
3. Le Gouill S, Thieblemont C, Oberic L, Moreau A, Bouabdallah K, Dartigeas C, et al. Rituximab after Autologous Stem-Cell Transplantation in Mantle-Cell Lymphoma. N Engl J Med. 28 sept 2017;377(13):1250-60.
4. Wang ML, Jurczak W, Jerkeman M, Trotman J, Zinzani PL, Belada D, et al. Ibrutinib plus Bendamustine and Rituximab in Untreated Mantle-Cell Lymphoma. N Engl J Med. 30 juin 2022;386(26):2482-94.
5. Dreyling M, Campo E, Hermine O, Jerkeman M, Le Gouill S, Rule S, et al. Newly diagnosed and relapsed mantle cell lymphoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. juill 2017;28:iv62-71.
6. Tessoulin B, Chiron D, Thieblemont C, Oberic L, Bouadballah K, Gyan E, et al. Oxaliplatin before autologous transplantation in combination with high-dose cytarabine and rituximab provides longer disease control than cisplatin or carboplatin in patients with mantle-cell lymphoma: results from the LyMA prospective trial. Bone Marrow Transplant. juill 2021;56(7):1700-9.

