Présentations en congrès
Les thromboses veineuses splanchniques (TVS) comprennent les thromboses de la veine porte, des veines mésentériques supérieure et inférieure, de la veine splénique et le syndrome de Budd-Chiari.
Le diagnostic d'une TVS chez un patient nécessite un bilan étiologique large. Des causes locales doivent être recherchées, telles que la présence d'une cirrhose, d'une tumeur solide ou d'une infection abdominale. Des causes systémiques peuvent également être impliquées dans la TVS, avec en premier lieu les néoplasies myéloprolifératives (NMP).
Nous détaillerons ici la prise en charge des patients chez qui la TVS est associée à la présence d'une NMP.
Les néoplasies myéloprolifératifs sont fortement associées aux thromboses splanchniques
Les NMP représentent la cause systémique de TVS la plus fréquente. Smalberg et al. ont montré cela dans leur article de 2012, étudiant les causes sous-jacentes du TVS après exclusion des causes cirrhotiques et tumorales. Ils ont retrouvé la présence d'une NMP chez 40,9 % des patients atteints d'un syndrome de Budd-Chiari, et 31,5 % des patients avec une thrombose porte (1).
De nombreux mécanismes rentrent en jeu dans cette association entre TVS et NMP. Même si tous ne sont pas élucidés, plusieurs hypothèses peuvent être faites pour expliquer ce lien.
Tout d'abord, de nombreuses anomalies prédisposent les patients avec NMP au risque de thromboses artérielles et veineuses, avec notamment les taux augmentés de cellules circulantes (2), ainsi que l'activation anormale de ces cellules avec expression de protéines d'adhésion (3, 4) et la formation de neutrophil extracellular traps (NET) (5, 6) notamment.
Au niveau splanchnique spécifiquement, il est décrit un flux sanguin plus lent, qui pourrait donc permettre plus d'interactions cellulaires, participant à la thrombose dans ce site (7).
Enfin, certaines équipes ont décrit la présence de cellules endothéliales de la vascularisation splanchnique ayant la mutation JAK2V617F, responsable d'un phénotype pro-adhésif et pro-thrombotique de celles-ci (8–10).
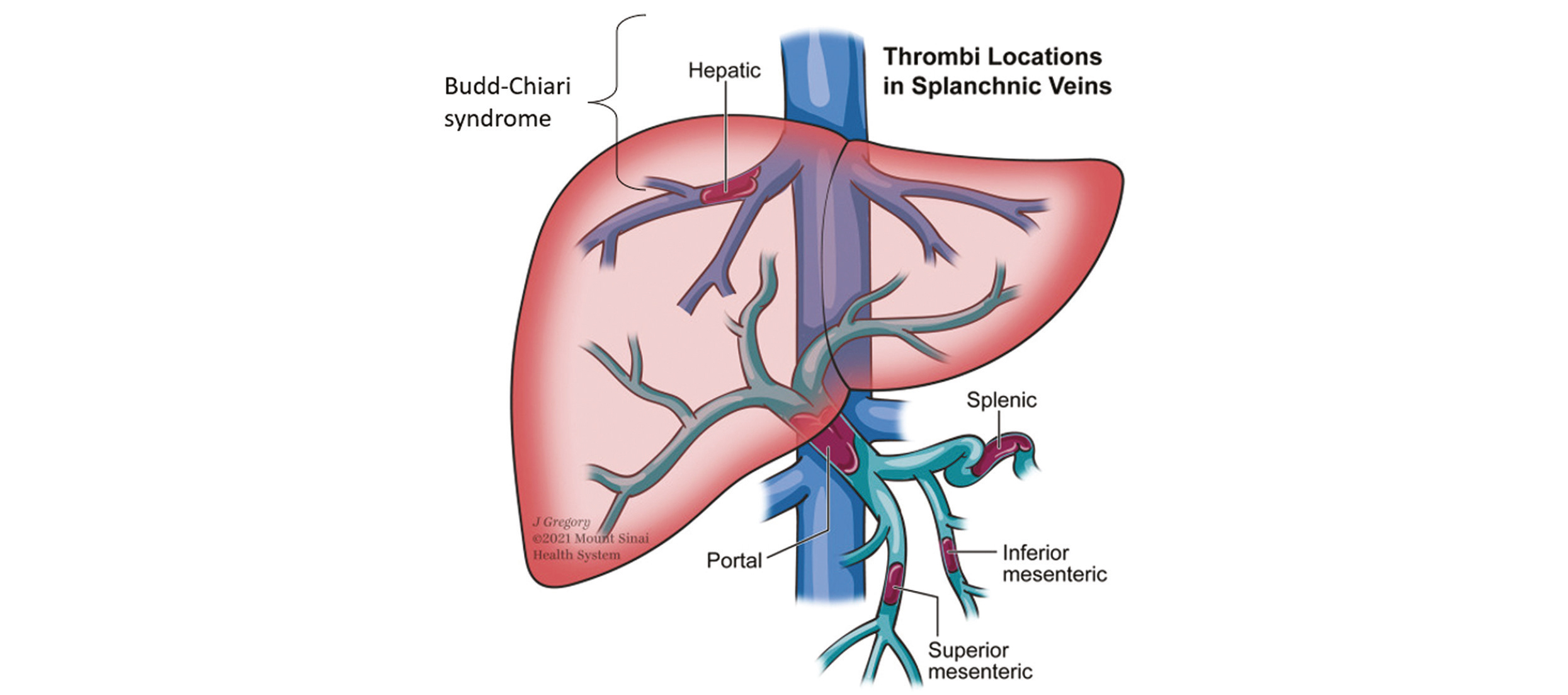
Figure 1 : Localisation des thromboses veineuses splanchniques.
Adapté de Tremblay et al. Thromb Res, 2022
Les patients avec néoplasie myéloproliférative qui font une thrombose splanchnique ont un profil particulier
On observe un profil particulier des patients avec NMP chez qui survient une TVS. Ils sont souvent plus jeunes et ont une charge allélique plus faible que les patients avec NMP sans thrombose ou avec thrombose d'un site classique (11) ; les femmes sont également sur-représentées (12).
Un élément important à noter est que la numération formule sanguine (NFS) de ces patients peut être normale, malgré la présence de la NMP (1). Ceci s'explique par les conséquences de la TVS. En effet, une hypertension portale peut se développer des suites de la thrombose, et entraîner le développement de varices œsophagiennes et gastriques, qui peuvent saigner à bas bruit, et causer une carence martiale. Un hypersplénisme peut également apparaître, et causer la séquestration de cellules sanguines.
Tous ces éléments expliquent la possibilité de retrouver une NFS normale chez ces patients. Ainsi, il est important de rechercher une NMP dans le bilan étiologique d'une TVS même si la NFS est sans anomalie.
Mon patient a fait une thrombose splanchnique : dois-je systématiquement rechercher une néoplasie myéloproliférative sous-jacente ?
D'après les recommandations 2022 du Groupe Français de Thrombose et d'Hémostase, la recherche d'une NMP doit être effectuée chez tout patient présentant une TVS sans cause locale ou régionale évidente (13).
La première étape est de rechercher la présence de la mutation JAK2V617F. Si elle est retrouvée, il est ensuite nécessaire de typer précisément la NMP. Pour cela, une mesure de la masse sanguine peut être utile, et permettre de poser le diagnostic de Polyglobulie de Vaquez malgré une NFS normale (14). En cas de masse sanguine normale, la réalisation d'une biopsie ostéomédullaire sera nécessaire.
Si la mutation JAK2V617F n'est pas retrouvée, on peut utiliser les critères proposés par Poisson et al. Pour déterminer si la recherche d'une mutation du gène CALR est nécessaire (15). L'association chez le patient d'une rate supérieure à 16 cm et d'un taux de plaquettes supérieure à 200 G/L doit entraîner la recherche de la mutation.
En l'absence de ces critères, ou en cas de recherche de la mutation de CALR négative, les explorations peuvent inclure un NGS, une recherche ciblée de la mutation de l'exon 12 de JAK2, ou encore la réalisation d'une biopsie ostéomédullaire, et se discutent au cas par cas.
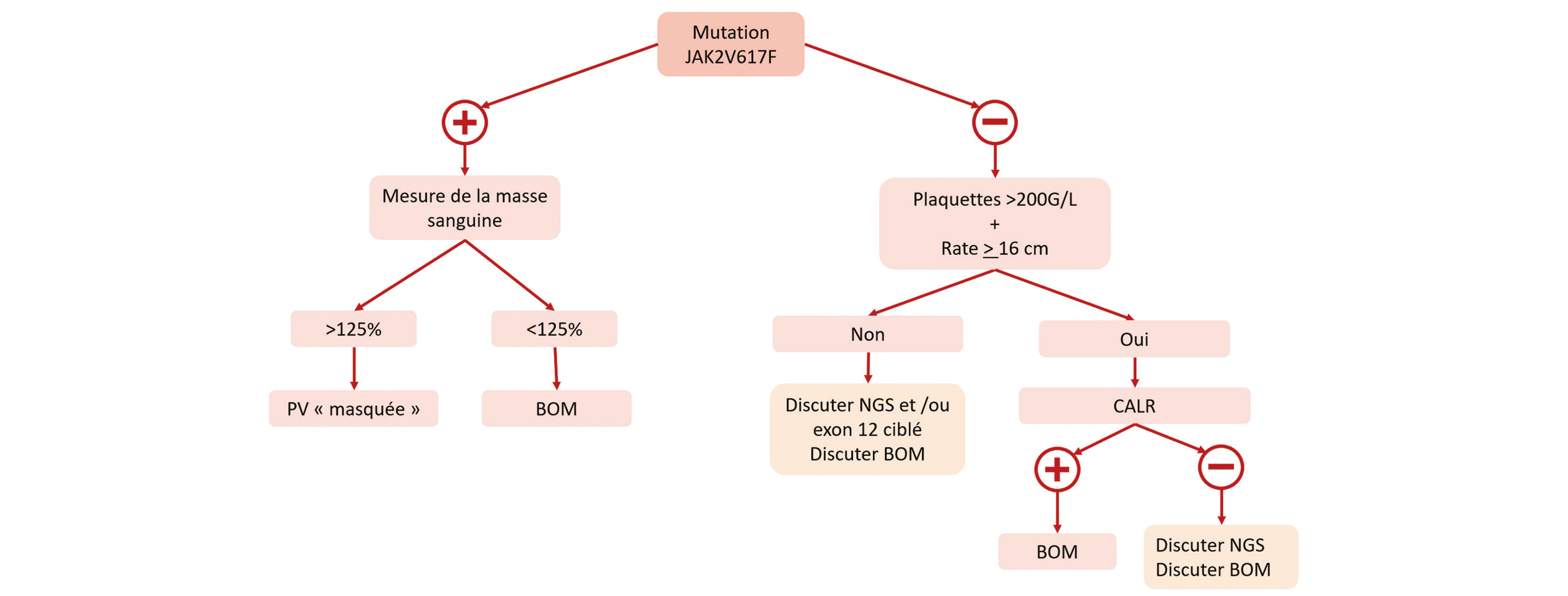
Figure 2 : Arbre diagnostique de recherche d'une néoplasie myéloproliférative après une thrombose splanchnique
Quelles sont les conséquences d'une thrombose splanchnique ?
Du fait de leur localisation, les TVS sont à risque de diverses complications qui nécessitent un suivi rapproché par un hépatologue.
Chez certains patients, une complication aiguë possible est l'ischémie digestive, pouvant nécessiter une résection chirurgicale, avec par la suite un risque de défaut d'absorption des traitements.
Comme vu précédemment, les patients peuvent développer une hypertension portale, avec notamment des varices oesophagiennes. Cette complication sera particulièrement importante à rechercher et prendre en charge, à cause du risque de saignement des varices, surtout dans ce contexte où un traitement anticoagulant est nécessaire.
Un cavernome porte peut également se développer, et exercer une compression sur le réseau biliaire, entraînant une cholangiopathie (16, 17).
Enfin, certaines complications sont plus spécifiques du syndrome de Budd-Chiari, notamment le risque d'insuffisance hépatique aiguë au moment du diagnostic, et, de façon plus chronique, l'apparition d'une fibrose, de nodules hépatiques, voire d'un carcinome hépatocellulaire (16, 18).
Comment prendre en charge ces patients ?
L'anticoagulation au long cours chez ces patients a montré son efficacité, à la fois sur les récidives de thrombose et sur les saignements (19, 20).
Ainsi, il sera à mettre en place chez tous les patients. Il faudra en parallèle réaliser un dépistage et une prise en charge des varices oesophagiennes pour minimiser le risque de complication hémorragique.
En ce qui concerne les antiagrégants plaquettaires, il n'est pas recommandé de les introduire en plus d'un anticoagulant, à cause du risque hémorragique accru des patients. L'association d'un anticoagulant et d'un antiagrégant sera uniquement réservé à des situations particulières, notamment en cas d'antécédents cardiovasculaires.
La prescription d'un antiagrégant plaquettaire seul n'est pas recommandée chez ces patients, les données sur leur efficacité sans association à un anticoagulant étant très limitées (21).
Enfin, en plus de l'anticoagulation, il est nécessaire d'introduire un traitement cytoréducteur chez ces patients qui ont une NMP et un antécédent thrombotique. Cependant, il peut être difficile d'établir une cible thérapeutique claire dans ce contexte où la NFS peut être normale. Dans la polyglobulie de Vaquez, on peut proposer de viser un hématocrite inférieur à 38-40 %, avec si possible une mesure de la masse sanguine lors du suivi. Pour les patients ayant une thrombocytémie essentielle, un objectif de taux de plaquettes compris entre 120 et 200 G/L peut être proposé. Cette attitude thérapeutique reste à valider au cours d'études prospectives.
Conclusion
Les patients avec NMP chez qui survient une TVS ont un profil particulier et des complications spécifiques, qui sont en lien avec la localisation de leur thrombose. Ils nécessitent ainsi une prise en charge multidisciplinaire, à la fois sur le plan hépatologique et hématologique. La recherche de varices œsophagiennes est notamment un point clé du suivi de ces patients. Pour ce qui est de la prise en charge thérapeutique, un traitement anticoagulant au long cours doit être instauré, associé à un traitement cytoréducteur.
Références
1. Smalberg JH, Arends LR, Valla DC, Kiladjian JJ, Janssen HLA, Leebeek FWG. Myeloproliferative neoplasms in Budd-Chiari syndrome and portal vein thrombosis: a meta-analysis. Blood. 13 déc 2012;120(25):4921-8.
2. Carobbio A, Ferrari A, Masciulli A, Ghirardi A, Barosi G, Barbui T. Leukocytosis and thrombosis in essential thrombocythemia and polycythemia vera: a systematic review and meta-analysis. Blood Advances. 11 juin 2019;3(11):1729-37.
3. Jensen MK, De Nully Brown P, Lund BV, Nielsen OJ, Hasselbalch HC. Increased platelet activation and abnormal membrane glycoprotein content and redistribution in myeloproliferative disorders. British Journal of Haematology. 2000;110(1):116-24.
4. Arellano‐Rodrigo E, Alvarez‐Larrán A, Reverter J, Colomer D, Villamor N, Bellosillo B, et al. Platelet turnover, coagulation factors, and soluble markers of platelet and endothelial activation in essential thrombocythemia: Relationship with thrombosis occurrence and JAK 2 V617F allele burden. American J Hematol. févr 2009;84(2):102-8.
5. Guy A, Favre S, Labrouche-Colomer S, Deloison L, Gourdou Latyszenok V, Renault MA, et al. High circulating levels of MPO-DNA are associated with thrombosis in patients with MPN. Leukemia. Oct 2019;33(10):2544-8.
6. Wolach O, Sellar RS, Martinod K, Cherpokova D, McConkey M, Chappell RJ, et al. Increased neutrophil extracellular trap formation promotes thrombosis in myeloproliferative neoplasms. Sci Transl Med. 11 avr 2018;10(436):eaan8292.
7. Sekhar M, McVinnie K, Burroughs AK. Splanchnic vein thrombosis in myeloproliferative neoplasms. Br J Haematol. Sept 2013;162(6):730-47.
8. Sozer S, Fiel MI, Schiano T, Xu M, Mascarenhas J, Hoff man R. The presence of JAK2V617F mutation in the liver endothelial cells of patients with Budd-Chiari syndrome. Blood. 21 mai 2009;113(21):5246-9.
9. Guadall A, Lesteven E, Letort G, Awan Toor S, Delord M, Pognant D, et al. Endothelial Cells Harbouring the JAK2V617F Mutation Display Pro-Adherent and Pro-Thrombotic Features. Thromb Haemost. sept 2018;118(09):1586-99.
10. Guy A, Gourdou-Latyszenok V, Lay NL, Peghaire C, Kilani B, Dias JV, et al. Vascular endothelial cell expression of JAK2V617F is sufficient to promote a pro-thrombotic state due to increased P selectin expression. Haematologica. 1 janv 2019;104(1):70-81.
11. How J, Trinkaus KM, Oh ST. Distinct clinical, laboratory and molecular features of myeloproliferative neoplasm patients with splanchnic vein thrombosis. Br J Haematol. oct 2018;183(2):310-3.
12. Tremblay D, Vogel AS, Moshier E, Hoff man R, Kremyanskaya M, Zhou S, et al. Outcomes of splanchnic vein thrombosis in patients with myeloproliferative neoplasms in a single center experience. European J of Haematology. janv 2020;104(1):72-3.
13. Prescription et réalisation d'un bilan biologique à la recherche d'une thrombophilie : propositions du GFHT 2022 Partie II : prescription en cas de thromboses atypiques et lors de situations particulières [Internet]. Revue Francophone d'Hémostase et Thrombose. [cité 28 juill 2025]. Disponible sur : https://www.rfht.fr/publication/prescription-et-realisation-dun bilan-biologiquea- la-recherche-dune-thrombophilie-propositions du-gfht-2022-partie-ii-prescription-en-cas-de-thromboses-atypiques-etlors-de-situ/
14. Galtier J, Drevon L, Le Bris Y, Giraudier S, Wemeau M, Legros L, et al. Role of red cell mass evaluation in myeloproliferative neoplasms with splanchnic vein thrombosis and normal hemoglobin value: a study of the France Intergroupe des Syndromes myeloprolifératifs. haematol [Internet]. 8 févr 2024 [cité 28 juill 2025]. Disponible sur : https://haematologica.org/article/view/haematol.2023.284488
15. Poisson J, Plessier A, Kiladjian JJ, Turon F, Cassinat B, Andreoli A, et al. Selective testing for calreticulin gene mutations in patients with splanchnic vein thrombosis: A prospective cohort study. Journal of Hepatology. sept 2017;67(3):501-7.
16. Elkrief L, Payancé A, Plessier A, d'Alteroche L, Ronot M, Paradis V, et al. Management of splanchnic vein thrombosis. JHEP Reports. avr 2023;5(4):100667.
17. Hernández-Gea V, De Gottardi A, Leebeek FWG, Rautou PE, Salem R, Garcia-Pagan JC. Current knowledge in pathophysiology and management of Budd-Chiari syndrome and non-cirrhotic non tumoral splanchnic vein thrombosis. Journal of Hepatology. juill 2019;71(1):175-99.
18. Garcia-Pagán JC, Valla DC. Primary Budd–Chiari Syndrome. Hardin CC, éditeur. N Engl J Med. 6 avr 2023;388(14):1307-16.
19. Sant'Antonio E, Guglielmelli P, Pieri L, Primignani M, Randi ML, Santarossa C, et al. Splanchnic vein thromboses associated with myeloproliferative neoplasms: An international, retrospective study on 518 cases. American J Hematol. févr 2020;95(2):156-66.
20. Chrysafi P, Barnum K, Gerhard GM, Chiasakul T, Narang A, Mcnichol M, et al. Anticoagulation for splanchnic vein thrombosis in myeloproliferative neoplasms: a systematic review and meta analysis. Journal of Thrombosis and Haemostasis. Déc 2024;22(12):3479-89.
21. Hoekstra J, Bresser EL, Smalberg JH, Spaander MCW, Leebeek FWG, Janssen HLA. Long‐term follow‐up of patients with portal vein thrombosis and myeloproliferative neoplasms. Journal of Thrombosis and Haemostasis. nov 2011;9(11):2208-14.

Juliette MAURIN
Interne en biologie médicale
CHU de Bordeaux

