
Cette année, nous avons organisé une soirée de formation AFIHGE/AERIO au mois de mars pour aborder 2 thèmes en oncologie digestive : tout d'abord une revue globale des différents biomarqueurs existants et leur implication thérapeutique dans les différentes localisations en oncologie digestive. Ensuite une seconde partie sous forme de cas clinique qui aborde l'aspect oncogénétique des cancers digestifs avec le Syndrome de Lynch mais également les autres formes génétiques de cancer digestif.
Dans ce format de Questions/Réponses nous vous proposons de revenir sur quelques points clés qui ont fait l'objet de discussions.
Remerciements au Professeur SELVES (CHU de Toulouse), au Docteur DARDENNE (Hôpital Saint-Antoine) et au Docteur DHOOGE (Hôpital Cochin) pour leur participation à cette formation ainsi que tous les gastroentérologues et oncologues en formation qui nous ont suivis ! Stay tuned...
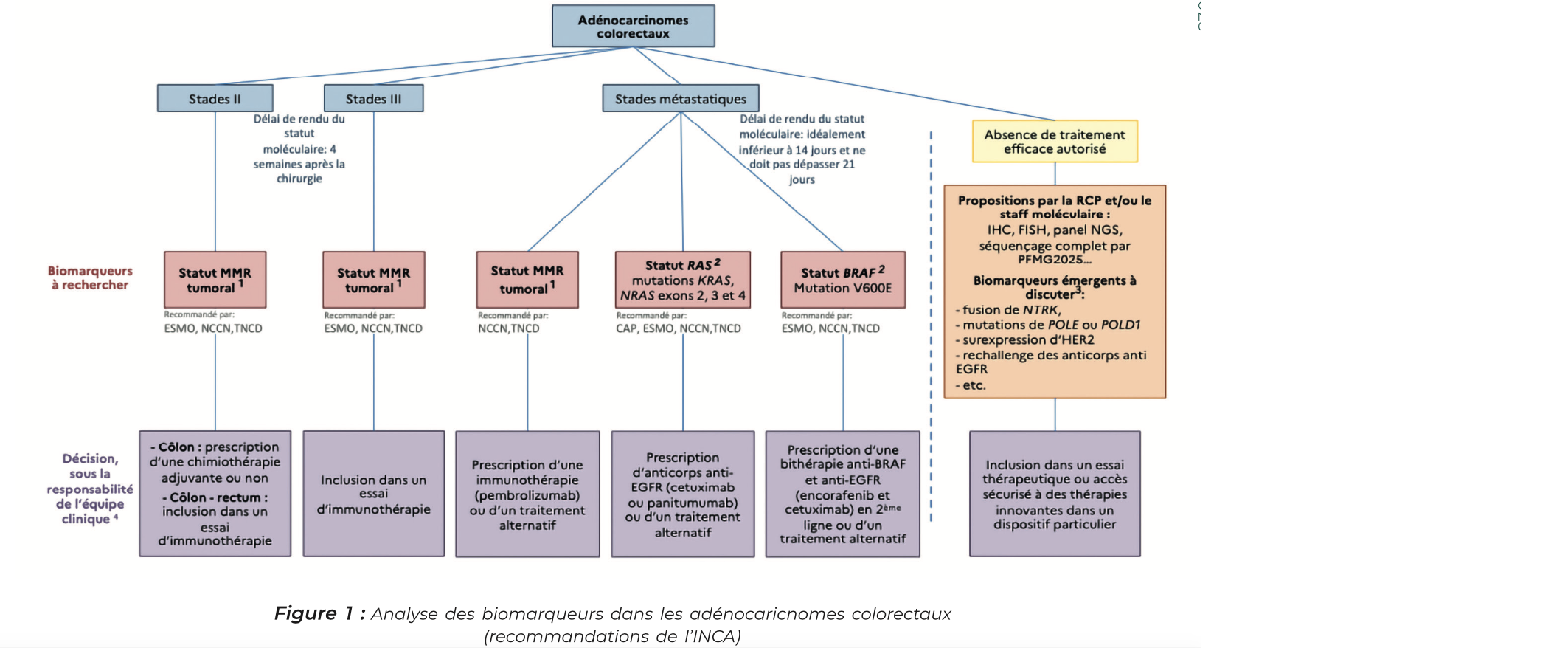
Aujourd'hui, la recherche d'un défaut de réparation des mésappariements de l'ADN (dMMR)/instabilité des microsatellites (MSI-H), des mutations KRAS (exons 2, 3 et 4), NRAS (exons 2, 3 et 4) et BRAF (exon 15) est indispensable dès le diagnostic de tout CCR métastatique. À partir de la 2e ligne, chez un patient RAS/BRAF sauvage, seront recherchés une hyperexpression/amplification d'HER2/ERBB2 (qui peut être effectuée par IHC/FISH) et une fusion NTRK (en particulier si statut dMMR/MSI-H) par RNASeq.
Quel est l'intéret thérapeutique des mutations des gènes RAS et BRAF (voie des MAPK) dans les adénocarcinomes colorectaux métastatiques ?
La carcinogénèse des cancers colorectaux est très souvent dépendante de l'activation consti- tutive de la voie de l'EGFR qui active en cascade la voie RAS/ RAF/MAP kinase et permet la prolifération tumorale.
Des anti-EGFR (cetuximab/pani- tumumab) sont utilisés en pratique clinique dans le traitement des cancers colorectaux pour bloquer cette voie de signalisation via un anticorps qui se fixe sur le récepteur à l'EGF.
Les protéines KRAS et NRAS et HRAS sont des protéines cytoplasmiques impliquées dans le transfert de l'information provenant des stimuli extracellulaires (via le rc à l'EGF par exemple) vers les protéines effectrices du noyau (facteurs de transcription et en protéines du cycle cellulaire) et entraîner la croissance, la différenciation, la prolifération et la survie des cellules.
Dans 50 % des CCR métastatiques, il existe une mutation au niveau des gènes qui codent pour ces protéines, Cette mutation est activatrice et entraîne l'activation constitutionnelle de la voie de signalisation RAS/RAF/ MAP kinase.
Ces mutations sont le plus souvent situées sur le gène KRAS (40 %), principalement au niveau de l'exon 2 et plus précisément des codons 12 (G12D, G12C et G12V) ou 13 (G13D). On peut plus rarement retrouver ces mu- tations sur le gène NRAS.
La protéine BRAF est une protéine également impliquée dans la voie de signalisation des MAPK. Elle est codée par le gène BRAF, une mutation de ce gène est retrouvée dans 10 % des CCR métastatiques, avec principalement la mutation BRAFV600E au niveau de l'exon 15, il existe d'autres mutations de BRAF qui n'ont, aujourd'hui, pas de valeur thérapeutique.
Les mutations BRAF-V600E et RAS sont habituellement mutuellement exclusives.
Le statut RAS/KRAS nous permet de :
1. Poser ou non l'indication d'un traitement par anti EGFR
En cas de mutation de RAS (KRAS ou NRAS) on observe une activation constitutive de la voie en aval du récepteur à l'EGF et donc une résistance aux anti-EGFR.
Ainsi les anti-EGFR tel que le cetuximab ou le panitumumab ne sont pas indiqués, car inefficaces en cas de mutation de RAS.
2. Prescrire de nouvelles thé- rapeutiques ciblant directe- ment ces mutations
Certaines mutations de KRAS sont ciblables spécifiquement par des thérapies ciblées avec beaucoup d'études en cours sur le sujet, c'est le cas de :
• La mutation KRAS G12C (3 % des CCR) avec le sotarasib, l'adagrasib et le divarasib semblant efficace en association avec un anti-EGFR et de la chimiothérapie ;
• La mutation KRAS G12D ou KRAS G12V avec des agents thérapeutiques en cours d'essai ;
• Ou même des inhibiteurs multi-RAS ou Pan-RAS en cours de développement.
La recherche de mutation BRAF V600E nous permet :
1. D'adapter l'intensité des thérapeutiques, en effet la pré- sence de la mutation BRAF V600E est un facteur de mauvais pronostic, cela motive l'utilisation d'une chimiothérapie agressive avec une trichimiothérapie associé à un anti-angiogénique.
2. Est prédictif de mauvaise réponse au traitement par an- ti-EGFR, sans les contre-indi- quer pour autant.
3. De la cibler par un inhibiteur de BRAF : l'encorafenib qui a l'AMM en 2° ligne de CCRm en association au cetuximab et est en cours de validation en L1 avec un essai de phase 3 qui montre une amélioration de l'OS avec l'association encorafenib-cetuximab-bi chimiothérapie.
Quel est l'intéret thérapeutique du statut MMR dans les adénocarcinomes colorectaux métastatiques ?
5 % des CCR métastatiques sont MSI ou dMMR, c'est-à-dire qu'ils ont une déficience du système MMR (MisMAtch Repair) chargé de réparer les mésappariements de l'ADN après la réplication. Le système MMR est constitué de 4 protéines d'intérêt que sont MLH1, PMS2, MSH2 et MSH6, qui agissent en hétérodimères. Lorsque l'on perd l'expression de l'une de ces protéines, cela entraîne une diminution de la capacité du système MMR à réparer les erreurs du nombre des répétitions des microsatellites ainsi que les erreurs d'incorporation de nucléotides (substitutions).
La déficience du système MMR peut être d'origine génétique avec une mutation constitutive c'est le Sd de Lynch ; ou somatique le plus fréquemment, avec l'apparition de mutations, ou de modifications épigénétiques avec une hyperméthylation des promoteurs des gènes ou MSH2.
Rechercher le statut MMR permet :
1. Le pré-screening du Sd de Lynch sur les tumeurs (20 % des CCR dMMR/MSI sont des Sd de Lynch) : avec une indi- cation de screening chez tous les patients avec un CCR quels que soient l'âge, le stade ou le contexte familiale.
2. Est un facteur prédictif de réponse à l'immunothérapie par inhibiteurs de checkpoints immunitaires (ICI) avec une AMM pour le pembrolizumab (antiPD1) chez les CCR métastatiques dMMR en premiere ligne de traitement. L'association Nivolumab (anti PD1)-Ipilimumab (antiCTLA4) a également démontré une supériorité en survie sans progression en comparaison à un traitement standard (par chimiothérapie + thérapie ciblée).
Technique d'obtention du statut RAS/BRAF et MMR ?
Pour obtenir le statut RAS/BRAF, l'ADN est extrait de l'échantillon tumoral (biopsie, prelevement per-opératoire) pour ensuite être séquencé en biologie moléculaire avec 2 techniques possibles :
1. Des techniques ciblées, qui permettent de rechercher des mutations cible par cible, par Pyroséquencage qui permet le séquençage de petites portions d'ADN autour d'exons d'intérêt (hot spot mutationnel) ou par hybridation spécifique.
2. Des techniques de séquençage NGS, de plus en plus utilisées, qui permettent le séquencage simultané de dizaines voire centaines de genes (panels de gènes). Le principe est de lire 100 à 1000 fois la même séquence qui permet la détection des mutations mais aussi des CNV (variabilité du nombre de copies d'un gène), des réarrangements de gènes fusions.
Dans le cadre du Plan France Médecine Génomique 2025 (plateformes SeqOIA et AURAGEN), il est aujourd'hui possible de réaliser un séquençage du génome complet pour les patients avec un cancer colorectal métastatique prétraité (au moins deux lignes de traitements).
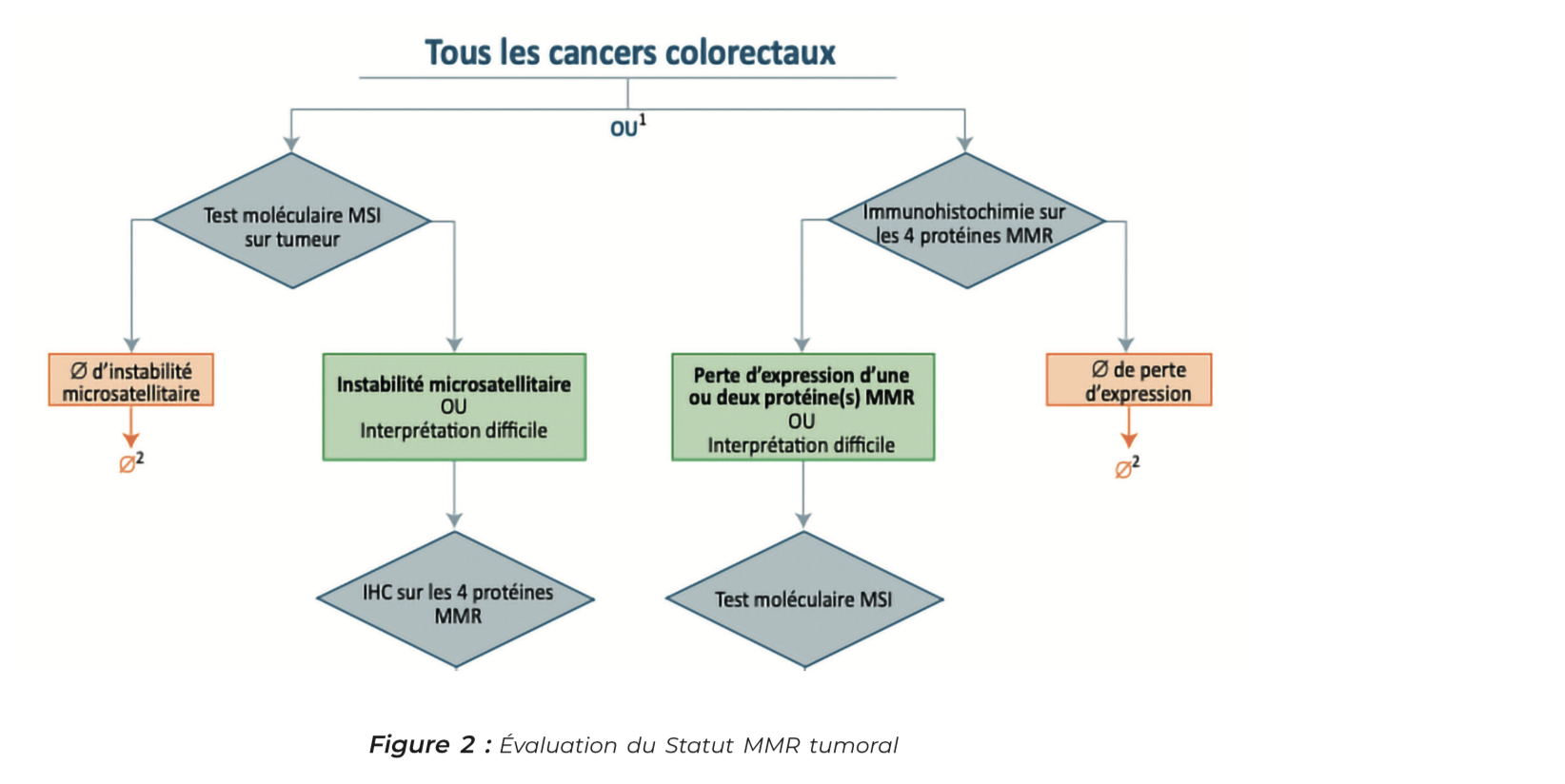
Tandis que pour déterminer le statut MMR :
1. On peut rechercher en immunohistochimie la perte d'expression d'une des 4 protéines du système MMR (MLH1, PMS2, MSH2 et MSH6), le statut dMMR- IHC de la tumeur est acté en cas de perte d'expression de :
• MLH1 et PMS2 qui fonctionnent en hétérodimère ;
• MSH6 et MSH2 qui fonctionnent en hétérodimère ;
• Isolée de PMS2 ;
• Isolée de MSH6.
En cas du maintien d'expression des 4 protéines on dit que la tumeur est pMMR-IHC.
2. On peut également faire un test MSI en biologie moléculaire qui recherche l'instabilité des microsatellites sur le génome tumoral. Si au moins 3 marqueurs sur le panel de 5 marqueurs testés sont instables, cela permet de classer notre tumeur MSI. Dans le cas inverse, la tumeur est considérée MSS.
Il est important de noter qu'un statut dMMR obtenu avec l'une de ces deux techniques doit toujours être confirmé par la réalisation de l'autre technique.
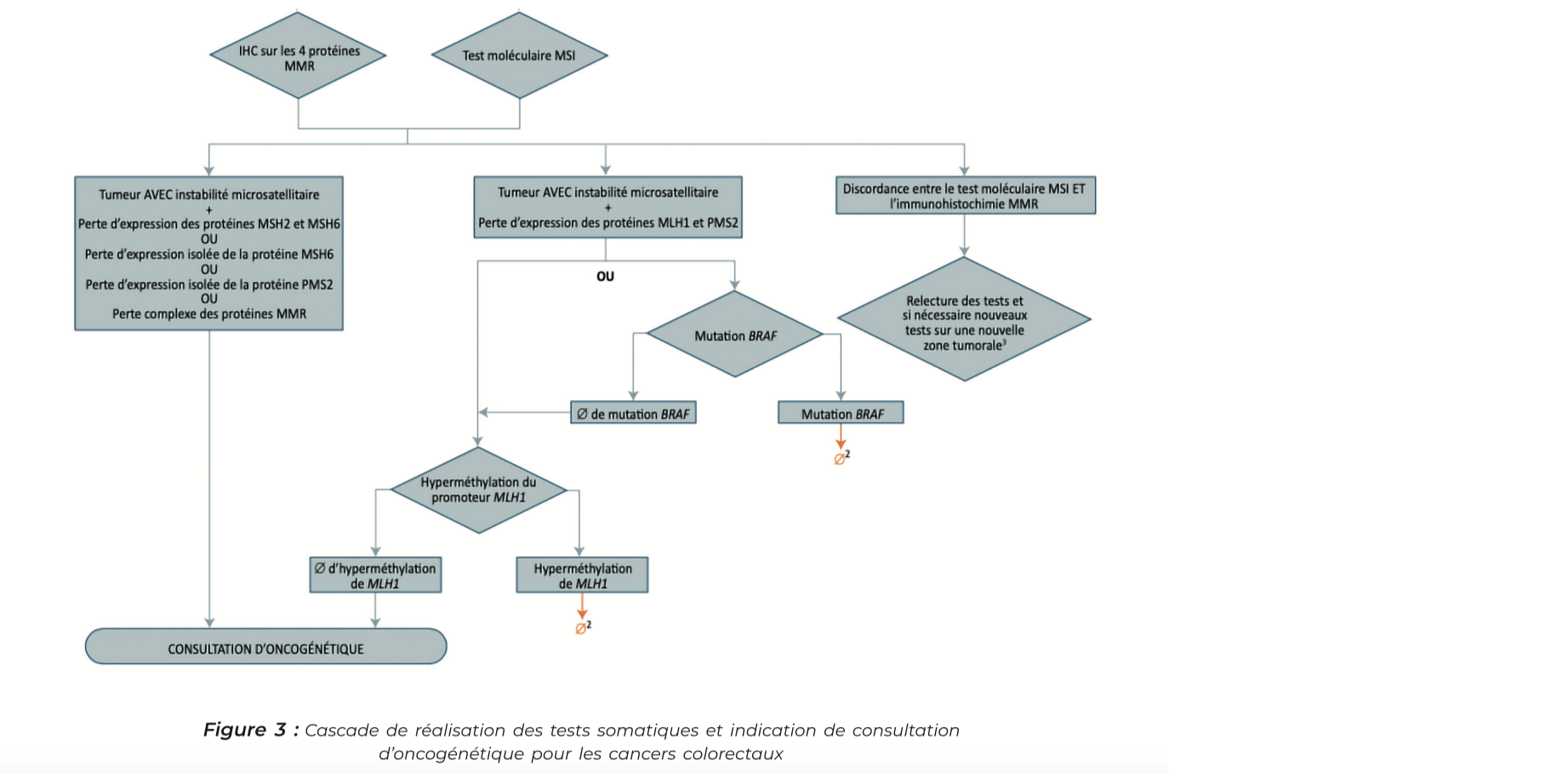
Comment distinguer Sd de Lynch et cancer sporadique en cas de tumeur dMMR ?
Deux situations possibles lors de l'évaluation du statut MMR sur la tumeur :
1. Le profil immunohistochimique nous oriente vers un syndrome de Lynch. C'est le cas lorsque l'on retrouve une perte d'expression de MSH2/MSH6 ou une perte d'expression isolée de MSH6 ou une perte d'expression isolée de PMS2, cela doit mener directement à une consultation d'oncogénétique pour confirmer l'origine consti- tutionnelle de ce déficit.
2. Le test moléculaire retrouve une instabilité des microsatellites et l'immunohistochimie retrouve une perte d'expression de MLH1 et PMS2. Dans ce cas on ne s'oriente pas forcément vers un Syndrome de Lynch, les tumeurs MSI sporadiques ont souvent une perte d'expression de MLH1 et PMS2, on complètera par la recherche d'une mutation
BRAF ou une hyperméthylation du promoteur de MLH1 qui nous oriente vers un cancer sporadique.
Dans le cas inverse c'est-à-dire en l'absence d'hyperméthylation de MLH1 et l'absence de mutation BRAF, une consultation d'oncogénétique est recommandée.
Quel est l'intéret thérapeutique du statut MMR dans les adénocarcinomes colorectaux métastatiques ?
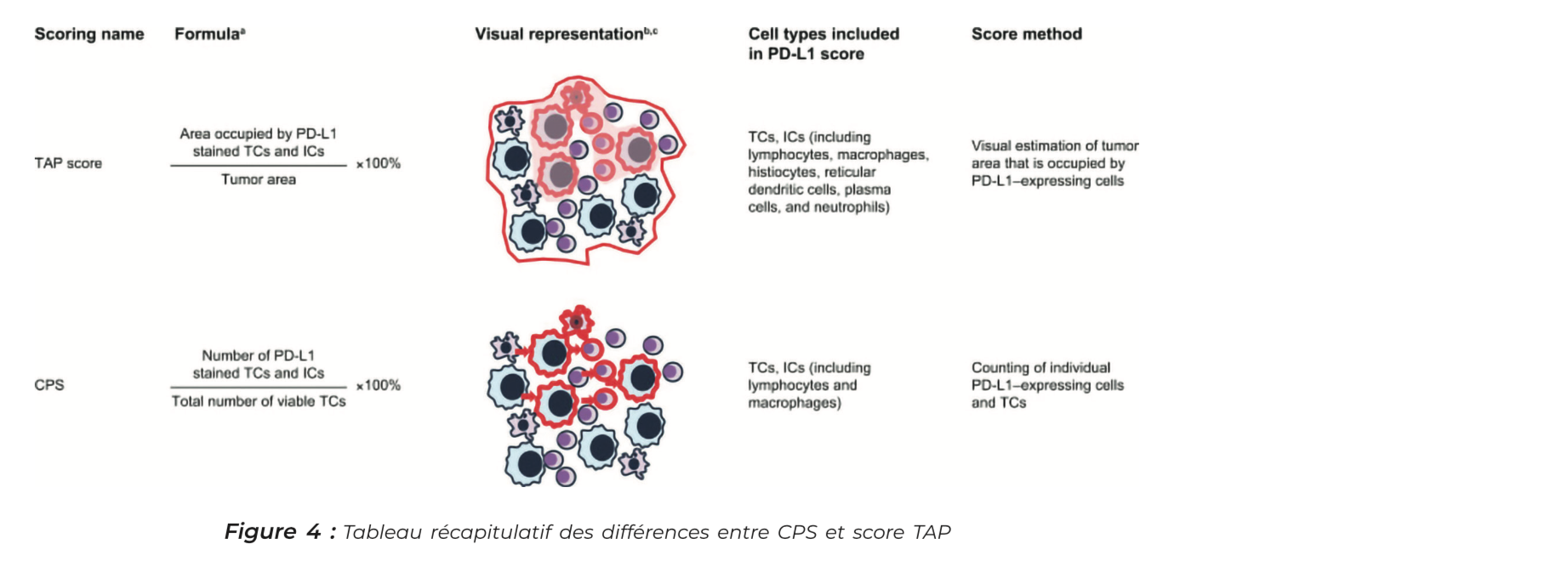
Les scores CPS (score positif combiné), TPS (score de proportion tumorale) et TAP (Tumor Area Positivity) permettent d'interpréter l'expression de PDL1 au niveau de la tumeur en immunohistochimie.
• Le CPS correspond au décompte du nombre de cellules PDL1 positives (cellules tumorales, lymphocytes, macrophages) divisé par le nombre total de cellules tumorales, il évalue l'expression de PD-L1 dans les cellules tumorales et les cellules immunitaires (lymphocytes et macrophages).
• Le TPS correspond au décompte du nombre de cellules TUMORALES PDL1 positives divisé par le nombre total de cellules tumorales, il ne prend en compte que l'expression de PD-L1 par les cellules tumorales.
• Le TAP est un nouveau score, dérivé du CPS, visuel (pas de décompte du nombre de cellules) ce qui le rend beaucoup plus rapide à executer par les anapath 5mn en moyenne (VS 30mn pour le CPS). On le calcule en évaluant visuellement la surface occupée par les cellules PDL1 positives (cellules tumorales, lymphocytes, macrophages) divisé par la surface totale occupée par la tumeur.
Quels sont les biomarqueurs à évaluer dans les cancers de l'estomac métastatiques et leur implication thérapeutique ?
1. Une amplification ou surex- pression de HER2 (15 % des cancers de l'estomac) : qui permet d'ajouter un traitement anti HER2 par trastuzumab en première ligne métastatique.
On recherche le marquage HER2 en immunohistochimie, les tumeurs sont considérées HER positives en cas :
• De marquage intense à 3 croix en IHC ;
• Ou de marquage intermédiaire à 2 croix complété par une technique d'hybridation in situ positive (c'est-à- dire retrouvant supérieur ou égale à 6 copies d'HER2 ou un ratio HER2/ CEP17 supérieur ou égale à à 2).
Attention dans les tumeurs œso-gastriques il y a une hétérogénéité spatiale de l'expression d'HER2 avec des zones de surexpression et des zones ne surexprimant pas HER2 au sein d'une même masse tumorale, d'où l'intérêt de biopsies multiples.
2. Statut MMR (7-10 % sont dMMR/MSI), permet le dépistage du Syndrome de lynch (moins fréquent que dans les CCRm) et permet l'utilisation d'immunothérapie chez les patients dMMR.
3. Le statut PDL1 evalué par le scoreCPS(50% ont un CPS supérieur ou égale à 5 et 90 % ont un CPS supérieur ou égale à 1).
Le niveau d'expression de PDL1 et donc le score CPS est corrélé à l'efficacité de l'immunothérapie, ce n'est pas la question de savoir si la tumeur est PDL1 positive ou négative mais surtout de savoir la valeur absolue du CPS, reflet du niveau d'expression de PDL1 qui compte.
Aujourd'hui il y a une grande divergence des valeurs de CPS seuil utilisés dans les études pour poser l'indication d'un traitement par immunothérapie.
La présence d'un CPS supérieur ou égale à 1 permet l'ajout du pembrolizumab en L1 méta en association avec la chimiothérapie dans les cancers de l'estomac métastatique. Le Nivolumab est aussi validé en association à la chimiothérapie en premiere ligne de traitement dans les cancers de l'estomac métastatique, HER2 négatifs dont le CPS est supérieur ou égale à 5.
4.La surexpression de la clau- dine 18.2 (30-45 % des cancers gastriques).
La claudine 18.2 est une proteine des complexes au niveau des jonctions serrées, exprimée en situation normale par les cellules épithéliales de la muqueuse gastrique. Dans certains cancers de l'estomac elle est exposée à la surface des cellules tumorales par délocalisation au cours de la carcinogenèse, cette surexpression au niveau des cellules tumorales permet d'en faire une cible thérapeutique. Le zolbetuximab est un anticorps monoclonal ciblant la claudine 18.2 qui permet d'activer l'ADCC et qui est validé en 1° ligne métastatique dans les cancers de l'estomac surexprimant la claudine 18.2 en IHC (score de 2+ ou 3+ dansplusde 75% des cellules tumorales).
5. Surexpression de FGFR2b (30 % des cancers de l'estomac) : FGFR2 est un récepteur à activité tyrosine kinase qui fixe le facteur de croissance des fibroblastes, Ils participent à la différenciation, la migration, la prolifération cellulaire et donc en cas de surexpression ou de mutation activatrice à la cancérogénèse. Un anticorps anti FGFR2b le bemarituzumab est en cours d'évaluation, en association avec la chimiothérapie, dans les cancers de l'estomac métastatiques ayant une surexpresion de FGFR2B.

Quels sont les principaux biomarqueurs à évaluer dans les cholangiocar- cinomes et leur implication thérapeutique ?
De nombreuses altérations moléculaires sont présentes dans les cholangiocarcinomes, on différencie les cholangiocarcinomes intrahépatiques (10-20 %) et extrahépatiques (80-90 %). Ces deux types de cholangiocarcinomes ont des altérations moléculaires communes (mutation TP53, KRAS, ARID1A, SMAD4, GNAS, BRCA1/2, PIK3CA) et spécifiques. 40 % des cholangiocarcinomes intra-hépatiques ont une altération moléculaire ciblable en thérapeutique (IDH1, FGFR2, BRAF, HER2, MSI, KRASG12C, NTRK), contre 25 % pour les cholangiocarcinomes extra hépatiques.
Il y a une indication à réaliser un portrait moléculaire chez l'ensemble des cholangiocarci nomes avancés dès la première ligne : on recherche systématiquement les mutations IDH1, KRAS, BRAF, les fusions FGFR2 et NTRK, les amplifications HER2 et le statut MSI.
Focus sur IDH1 : IDH1 est un métabolite impliqué dans la respiration cellulaire, lorsqu'il est muté il entraîne la production et l'accumulation en excès d'un métabolite oncogène (oncométabolite) qui agit au niveau de la méthylation des histones et de l'ADN et impacte la différenciation cellulaire.
Focus sur les fusions de FGFR2 :
C'est la fusion du gène codant pour FGFR2 associé à un autre gène (appelés partenaires de réarrangement) qui va entraîner la dimérisation constitutive de FGFR2 à la surface des cellules et donc entraîner l'activation con- stitutive des cascades de prolif- ération qui en découlent.

Alix CELARIER
Interne d'oncologie médicale AERIO

