Ces dernières années, le traitement par cellules CAR-T (Chimeric Antigenic Receptor - T) a révolutionné l'approche thérapeutique dans plusieurs domaines de l'hématologie. À mesure que l'expérience d'utilisation des CAR-T Cells évolue, de nouvelles complications liées au traitement apparaissent. Parmi elles, certaines concernent la reconstitution hématopoïétique, mais aussi des anomalies de l'hémostase. Celles-ci sont encore mal comprises mais semblent en lien avec les effets indésirables systémiques, notamment inflammatoires, déjà décrits sous CAR-T Cells.
Anomalies pro-thrombotiques
CRS et ICANS
Syndrome de relargage cytokinique (Cytokine Release Syndrome) / syndrome de neurotoxicité associé aux immunothérapies (Immune effector cell-associated syndrome)
Le CRS et l'ICANS sont des effets indésirables aujourd'hui bien connus des thérapies cellulaires et du traitement par CAR-T Cells. Ils s'accompagnent d'un syndrome inflammatoire majeur, engendrant, comme souvent au cours du syndrome inflammatoire important, une activation endothéliale et une hypercoagulabilité. Dans une étude portant sur 148 patients, Hamza Hashmi et al. ont rapporté une association entre des grades élevés de CRS et d'ICANS et la survenue d'un évènement thrombo-embolique veineux chez 11 % des patients : 4 thromboses veineuses profondes du membre supérieur, 4 thromboses veineuses profondes d'une extrémité inférieure, 4 embolies pulmonaires et de façon plus rare, 1 thrombose veineuse mésentérique, 1 cérébrale et 1 rénale (1 patient pour chaque site).
Origine multifactorielle
La survenue d'un CRS ou d'un ICANS n'est pas le seul facteur de risque de thrombose chez les patients traités par CAR-T. En effet, les patients qui ont présenté des thromboses veineuses profondes des membres supérieurs avaient des cathéters, dont la présence est connue pour être pourvoyeuse de thrombose. De même, il est probable que la chimiothérapie pré-injection participe également au risque thrombotique veineux, rendant l'imputabilité seule de la thérapie CAR-T délicate (Figure 1)1.
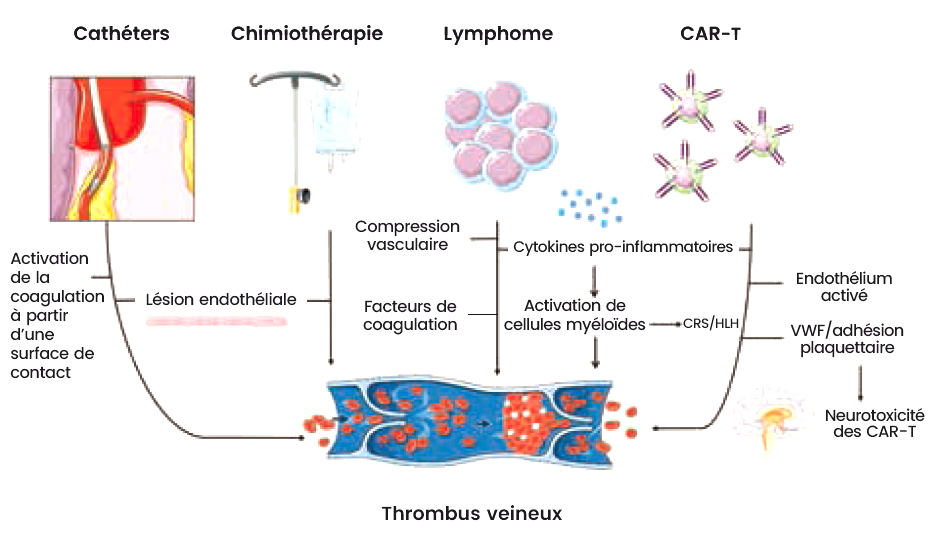
Figure 1 : Évènement thrombo-emboligue veineux associé au traitement par CAR-T cell anti-CD19,
adaptée de Hamza Hashmi et al., Blood Adv, 2020
Anomalies pro-hémorragiques
Thrombopénie dans le cadre de l'hématotoxicité liée aux CAR-T (ICAHT) en anglais, Immune effector cell– associated hematotoxicity)
La toxicité hématologique est l'événement indésirable le plus courant après une thérapie par CAR-T Cells. Les patients peuvent développer une aplasie médullaire sévère souvent réfractaire aux facteurs de croissance. Les cytopénies peuvent être profondes et durables favorisant les complications infectieuses mais aussi le risque hémorragique chez des patients présentant une thrombopénie majeure. La récupération hématopoïétique suit souvent une trajectoire biphasique, avec une récupération intermittente suivie d'autres diminutions. La physiopathologie sous-jacente reste à élucider, bien que des données récentes soulignent l'importance à la fois de la réserve hématopoïétique de base et de l'état inflammatoire du patient6. Le risque d'ICAHT est aujourd'hui anticipé en clinique grâce au score CAR-HEMATOTOX6.
CRS et ICANS
La survenue d'un CRS ou d'un ICANS semble associée à une augmentation du risque hémorragique post CAR-T Cells, probablement en lien avec une CIVD (Coagulation Intravasculaire Disséminée).
Kevin A et al. ont d'abord montré une corrélation entre la présence d'un CRS de haut grade et la survenue d'une coagulopathie de consommation à type de CIVD (Figure 2) mais l'impact clinique de la coagulopathie était faible dans cette étude puisque seuls 2 % des patients ont présenté des saignements3. La publication de Andrew Johnsrud et al. montre également une association entre les grades élevés d'ICANS et la survenue d'une CIVD, mais cette fois l'incidence des évènements hémorragiques est de 9,4 % avec des sites de saignements variés : organes génito-urinaires, tissus mous, intracrâniens, gastro-intestinaux et pulmonaires4.

IEC-HS
(Hémagophagocytoses Histio-Lymphocytaires liées aux CAR-T, en anglais, Immune Effector Cell-Associated Hemophagocytic Lymphohistiocytosis-Like Syndrome)
L'IEC-HS est un effet indésirable encore peu connu et pouvant survenir après thérapie par CAR-T Cells, il fait partie des Hémophagocytoses Histio-Lymphocytaires (HLH) secondaires. Sa physiopathologie est proche de celle d'une HLH primaire (d'origine génétique).
Dans le cas d'une HLH primaire, les lymphocytes T cytotoxiques ont une fonction cytotoxique insuffisante en raison de défauts de libération de granules cytotoxiques ou de perforines. Ces lymphocytes T activés ne peuvent pas terminer leur synapse immunologique et, en cas de régulation négative insuffisante, favorisent l'activation des macrophages et la libération de cytokines, ce qui les active davantage. Cette activation des lymphocytes T et des macrophages entraîne la libération de cytokines pro-inflammatoire et de ferritine, engendrant à terme des dommages tissulaires.
Dans l'IEC-HS, les lymphocytes CAR-T sont activés par la reconnaissance de l'antigène tumoral, ce qui conduit à la libération de granules cytotoxiques et à la lyse tumorale. L'activation soutenue via cette reconnaissance de l'antigène tumoral entraîne l'activation et la prolifération des cellules T, la libération de cytokines, l'activation et la libération de facteurs solubles par les macrophages, comme on le voit dans l'HLH primaire.
La survenue d'un IEC-HS s'accompagne de cytopénies avec notamment une thrombopénie, d'une hypofibrinogénémie ou d'autres anomalies comme une diminution du TP et une augmentation du ratio de TCA qui participent à son score diagnostic proposé par l'American Society for Transplantation and Cellular Therapy5.
Il a été montré par Sandrine Valade et al., une incidence de 64 % de troubles de la coagulation chez 47 patients atteints d'HLH secondaire sévères à type d'activité fibrinolytique élevée (Figure 3). Parmi ces patients, 23 % ont déclaré un évènement hémorragique clinique6.
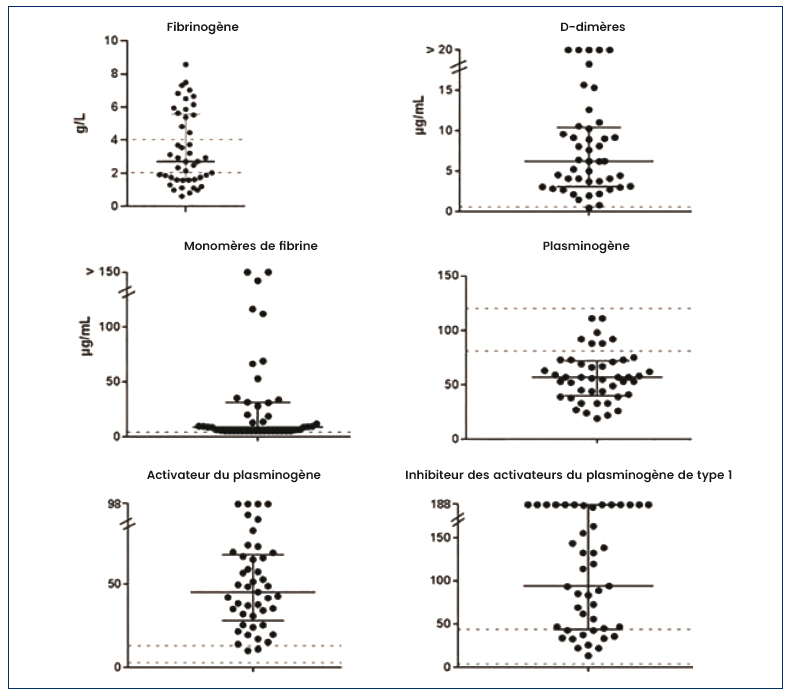
Figure 3 : Anomalies de la coagulation chez les patients atteints d'hémophagocytose lympho-histiocytaire sévère Sandrine Valade et al., Plos one, 2021
Prise en charge
La prise en charge des troubles de l'hémostase chez les patients traités par CAR-T Cells n'est aujourd'hui pas consensuelle.
Pour prévenir les complications hémorragiques, il semble important de prévenir des hypofibrinogénémies sévères par l'utilisation de cryoprécipités ou de concentrés de fibrinogène chez les patients présentant un risque de saignement important1, 7.
L'efficacité clinique dépendra de la surveillance du taux de fibrinogène et de la précocité de l'administration qui doit intervenir avant un éventuel évènement hémorragique. Les autres paramètres du bilan de coagulation (TP, ratio TCA) et la numération plaquettaire devront également être étroitement surveillés. Des transfusions de plaquettes devront être administrées pour prévenir un risque supplémentaire de saignement dans un contexte de thrombocytopénie et d'une coagulopathie sévère7.
La gestion des évènements thromboemboliques veineux est mal codifiée et l'utilisation d'une anticoagulation est envisagée au cas par cas1.
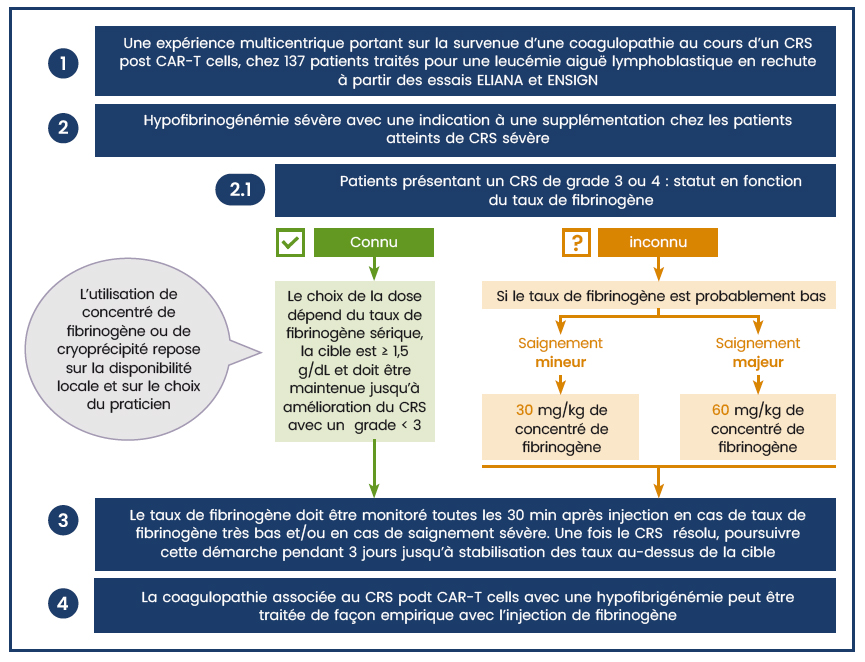
Figure 4 : Recommandations pratiques pour le suivi et la gestion d'une coagulopathie survenue sous tisagenlecleucel, Jochen Buechner et al., Blood Advances, 2021
Conclusion
Les anomalies du bilan d'hémostase chez les patients recevant une thérapie par CAR-T Cells sont donc d'étiologies multiples et ont un impact clinique variable selon les études. Des données prospectives incluant le suivi clinique et le dosage répété de paramètres biologiques seront donc nécessaires afin de mieux comprendre la physiopathologie sous-jacente de ces anomalies et afin de proposer aux patients une prise en charge mieux adaptée.

Thomas ROUSSEAU
Interne de Biologie médicale CHU de Rennes
Relecture
Pr Chloé JAMES
Références
1. Venous thromboembolism associated with CD19-directed CART-cell therapy in large B-cell lymphoma, Hamza Hashmi et al., Blood Adv, 2020
2. CAR-HEMATOTOX: a model for CAR T-cell–related hematologic toxicity in relapsed/refractory large B-cell lymphoma, Kai Rejeski et al., Blood, 2021
3. Kinetics and biomarkers of severe cytokine release syndrome after CD19 chimeric antigen receptor–modified T-cell therapy, Kevin A et al., Blood, 2017
4. Andrew Johnsrud et al., Incidence and risk factors associated with bleeding and thrombosis following chimeric antigen receptor T-cell therapy, Blood Adv, 2021
5. Immune EffectorCell-Associated Hemophagocytic Lymphohistiocytosis-Like Syndrome, Melissa R.Hines et al., Transplantation and Cellular Therapy, 2023
6. Coagulation disorders in patients with severe hemophagocytic lymphohistiocytosis, Sandrine Valade et al., Plos one, 2021
7. Practical guidelines for monitoring and management of coagulopathy following tisagenlecleucel CAR-T Cell therapy, Jochen Buechner et al., Blood Advances, 2021

