Radical Prostatectomy Versus Stereotactic Radiotherapy for Clinically Localised Prostate Cancer: Results of the PACE-A Randomised Trial.
Van As et al. Eur Urol, 2024
Les patients atteints d'un cancer de la prostate (CaP) localisé peuvent être traités de manière indifférente par prostatectomie totale (PT), ou par radiothérapie (RT), avec une chance élevée (et a priori similaire) de guérison [1]. Pour le patient, les effets indésirables engendrés par le traitement local ont donc un rôle essentiel dans le processus décisionnel. Jusqu'à très récemment, aucune étude de fort niveau de preuve n'avait comparé PT et radiothérapie avec pour objectif d'étudier la qualité de vie des patients.
Van As et al. ont rapporté en septembre 2024 les résultats de l'étude PACE-A, essai randomisé ayant comparé la qualité de vie des patients traités par PT (toute voie d'abord confondue) ou par radiothérapie stéréotaxique (SBRT, 36,25 Gy en 5 fractions) pour un CaP localisé. Les patients étaient éligibles s'ils présentaient un CaP localisé à risque faible ou intermédiaire selon la classification du National Comprehensive Cancer Network (NCCN : T1c– T2c, N0 [IRM], ISUP supérieure ou égale à 2 et PSA inférieure à 20 ng/mL) et un performans status inférieure ou égale à 2. Les critères d'exclusion comprenaient un antécédent d'irradiation pelvienne, un antécédent de néoplasie (autre que prostatique) datant de moins de 2 ans et la présence de prothèses de hanche bilatérales. La randomisation était stratifiée sur le centre et la risque NCCN. Les données de qualité de vie ou Patient-Reported Outcomes (PROs) ont été recueillies à l'entrée dans l'essai, puis régulièrement jusqu'à 2 ans après traitement à l'aide de questionnaires validés comprenant l'Expanded Prostate Cancer Index Composite Short Form (EPIC-26 – qualité de vie sur différents domaines), l'International Prostate Symptom Score (IPSS – fonction urinaire), le Vaizey faecal incontinence score (fonction digestive), et l'International Index of Erectile Function 5 (IIEF-5 – fonction érectile). Le critère de jugement principal était double : l'utilisation de protections urinaires à 2 ans (aucune versus au moins une – question 27 du questionnaire EPIC-26) et la valeur du score EPIC-26 sur la fonction digestive. Les critères de jugement secondaires comportaient les données issues des questionnaires suscités, et la toxicité (évaluée selon la Common Terminology Criteria for Adverse Events) des traitements.
Résultats (fi gure 1)
Entre 2012 et 2022, 123 hommes (60 dans le groupe PT, 63 dans le groupe SBRT) ont été randomisés dans 8 centres au Royaume-Uni. L'âge médian était de 65,5 ans et 94 % des patients étaient à risque intermédiaire. La médiane de suivi était de 60,7 mois (espace interquartile [IQR] 43,9–75,3). Quatre-vingt-six pourcents des participants ont été suivis au moins 2 ans, et les données sur la qualité de vie des patients à 2 ans étaient disponibles dans 68 % des cas (34/50) pour le groupe PT et 82 % des cas (49/60) pour le groupe SBRT. Concernant les modalités de traitement, 84 % des patients opérés l'ont été par voie robotique (16 % par voie laparoscopique pure), et 75 % des patients irradiés ont reçu du CyberKnife (25 % de l'arcthérapie).
À 2 ans, 16 des 32 patients opérés (50 %) et 3 des 46 irradiés (6,5%) ont rapporté l'utilisation de protections urinaires, correspondant à une différence de 43 % (intervalle de confiance à 95 % [IC95 %] 25 % - 62 %, p inférieure à 0,001). Le score d'incontinence urinaire à 2 ans (EPIC-26) était à la défaveur de la chirurgie (77,3 [IQR 58,5–100] pour la PT contre 100 [79,3–100] pour la SBRT, p = 0,003). En revanche, les patients étaient davantage gênés par des symptômes du bas appareil urinaire (SBAU) autres que l'incontinence dans le groupe SBRT (score EPIC à 93,8, IQR 87,5–100) par rapport à la PT (100, IQR 93,8–100, p = 0,01). Des résultats superposables étaient retrouvés au questionnaire IPSS. Concernant la fonction sexuelle, les patients opérés présentaient plus de dysfonction érectile à 2 ans que les patients irradiés, et ce, sur le questionnaire EPIC (p inférieure à 0,001) comme sur le questionnaire IIEF-5 (p = 0,002). Enfin, la PT faisait mieux que la RT sur le risque d'incontinence fécale à 2 ans avec une différence moyenne de 8,9 points au score EPIC (IC95% 4,2 – 13,7, p inférieure à 0,001).
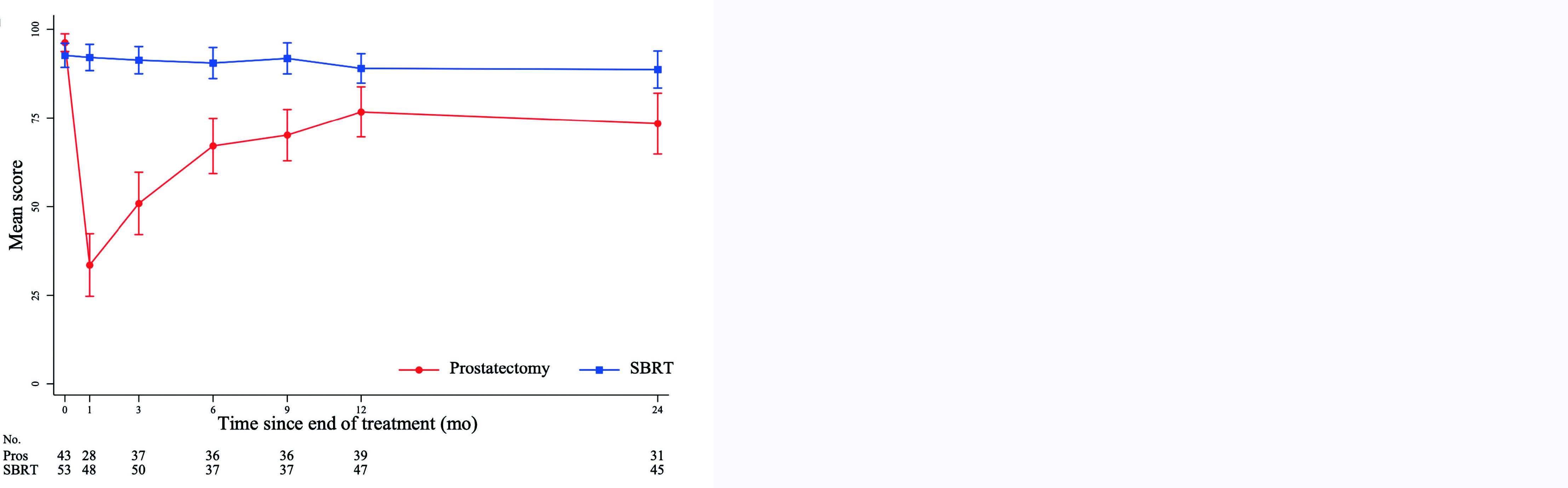
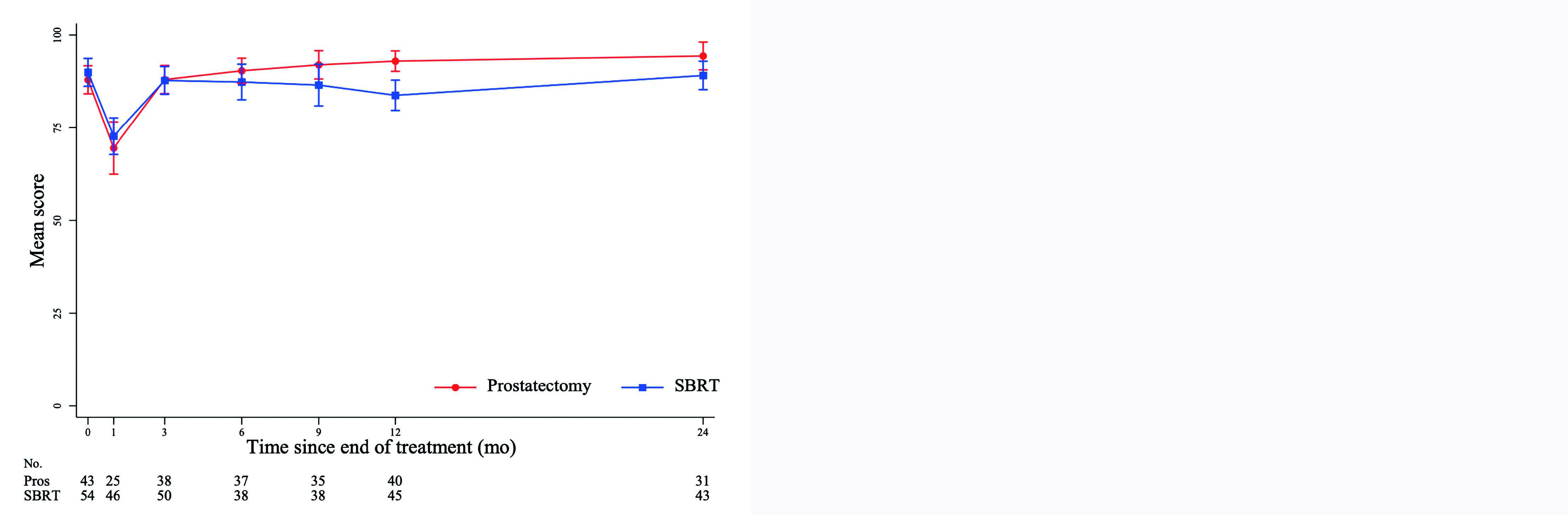
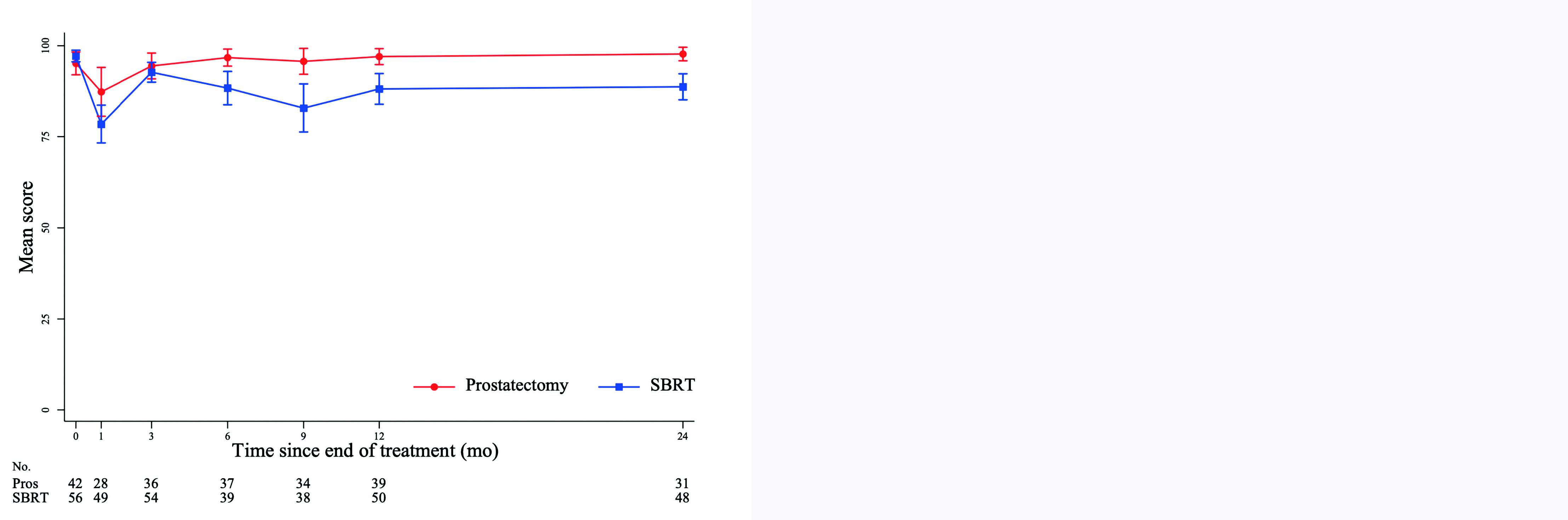
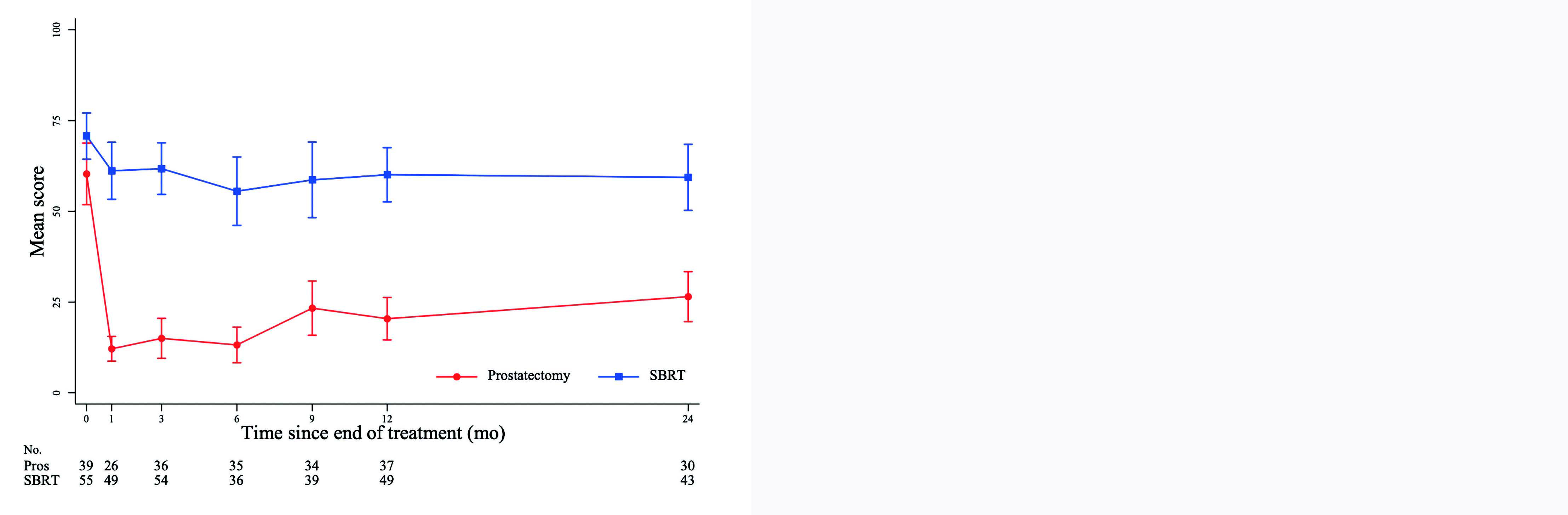
Figure 1 : Évolution de la moyenne du score EPIC-26 au cours du temps, en fonction du bras de traitement et du domaine étudié : (A) incontinence urinaire, (B) SBAU de la phase mictionnelle, (C) symptômes digestifs, et (D) fonction sexuelle. Le score EPIC va de 0 à 100, plus le score est élevé, plus la qualité de vie est préservée. EPIC-26 = Expanded Prostate Cancer Index Composite (26 questions); SBRT = stereotactic body radiotherapy.
Commentaire
Cet essai randomisé semble montrer la supériorité de la SBRT sur la PT en matière de toxicité urinaire et sexuelle chez les patients atteints d'un CaP localisé à risque faible ou intermédiaire. Ces résultats, bien que probants, doivent être interprétés avec précaution et ce, pour plusieurs raisons.
En premier lieu, le nombre de sujets nécessaire à inclure (NSI) calculé a priori n'a pas été atteint. En pratique, la puissance d'un essai clinique est son aptitude (i.e. sa probabilité) d'obtenir un résultat statistiquement significatif si le traitement est réellement efficace. Cette puissance dépend de la taille de l'échantillon choisi pour établir une inférence statistique sur l'hypothèse testée. Autrement dit, si le NSI n'est pas atteint, la question de recherche n'est pas valide, ce qui rend les résultats ininterprétables. Dans l'essai PACE-A, le NSI était de 284, or seulement 123 patients ont été finalement inclus (moins de la moitié escomptée !). Ainsi, stricto sensu, aucune conclusion ne devrait être tirée de l'essai PACE-A.
Par ailleurs, les données collectées sur le critère de jugement principal (i.e. le taux d'incontinence urinaire et fécale à 2 ans) n'étaient disponibles que chez 68 % des patients dans le groupe PT et 82 % des patients dans le groupe SBRT. Cette perte d'information a contribué non seulement à diminuer la puissance de l'étude, mais aussi à introduire un biais de sélection différentiel entre les deux groupes liés aux perdus de vue.
Troisièmement, les résultats du groupe prostatectomie semblent discordant avec les données issues de la littérature. Rappelons que les études pivotales (SPCG-4, PIVOT, ProtecT) rapportaient un taux d'incontinence urinaire à 2 ans après PT entre 17 % et 34 %, et ce, à l'époque de la chirurgie ouverte non conservatrice [2–4]. Dans une étude récente sur la cohorte de la Martini-Klinic, le taux de patients continents était évalué à 92,4 % à 1 an et à 93,4 % à 2 ans après PT robot-assistée [5]. De plus, dans l'étude PACE-A, le taux d'incontinence urinaire à 2 ans estimé a priori était de 15 %, bien loin des 50 % finalement décrits… La différence retrouvée entre SBRT et PT sur le critère de jugement principal semble donc plus proche du risque de première espèce (risque alpha – risque de conclure à tort à une différence) que d'une différence « réellement » significative.
En parallèle, même si les auteurs concluent à une différence sur l'incontinence urinaire et la dysfonction érectile à la faveur de la SBRT, il ne faut pas occulter les résultats (exploratoires certes) sur les SBAU (urgenturie, pollakiurie, nycturie, dysurie, brûlures mictionnelles…) et l'incontinence fécale, tous deux à la faveur de la PT. Il aurait été intéressant de disposer de questionnaires de qualité de vie généraux, prenant en considération chacun des domaines d'évaluation des autres questionnaires, afin de comparer la qualité de vie des patients dans leur globalité.
D'autres écueils pourraient être soulevés (choix de la temporalité du critère de jugement, durée d'inclusion, réalisation d'un amendement, possibilités thérapeutiques des effets indésirables de la prostatectomie versus ceux de la radiothérapie, risque de cancers en territoire irradié, validité oncologique des schémas de SBRT dans le CaP localisé, et surtout, intérêt d'un traitement local dans les cancers à risque faible ou intermédiaire favorable [!!!] …), mais nous devons reconnaître le travail remarquable réalisé par les auteurs. Il s'agit là du premier essai clinique (prospectif et randomisé) ayant comparé deux modalités thérapeutiques actuellement validées dans le CaP localisé avec pour objectif d'évaluer la qualité de vie des patients. Même si l'acceptation commune de l'importance de l'évaluation de la qualité de vie dans les études sur le CaP localisé reste difficile à obtenir (« quantity over quality »), van AS et al. ont su poser la première dalle d'une route longue et sinueuse, et semblent nous guider d'un « pace » assuré.
Références
1. Ploussard G, Fiard G, Barret E, et al. French AFU Cancer Committee Guidelines - Update 2022-2024: prostate cancer - Diagnosis and management of localised disease. Progrès en Urologie. 2022;32(15):1275-1372. doi:10.1016/j.purol.2022.07.148.
2. Johansson E, Steineck G, Holmberg L, et al. Long-term quality-of-life outcomes after radical prostatectomy or watchful waiting: the Scandinavian Prostate Cancer Group-4 randomised trial. The Lancet Oncology. 2011;12(9):891-899. doi:10.1016/ S1470-2045(11)70162-0.
3. Wilt TJ, Jones KM, Barry MJ, et al. Follow-up of Prostatectomy versus Observation for Early Prostate Cancer. N Engl J Med. 2017;377(2):132-142. doi:10.1056/NEJMoa1615869.
4. Donovan JL, Hamdy FC, Lane JA, et al. Patient-Reported Outcomes after Monitoring, Surgery, or Radiotherapy for Prostate Cancer. N Engl J Med. 2016;375(15):1425-1437. doi:10.1056/NEJMoa1606221.
5. Ambrosini F, Pose RM, Tilki D, et al. Robot-assisted versus open radical prostatectomy: Outcomes of highly experienced surgeons for both approaches. Eur Urol. 2023;83((Ambrosini F.; Terrone C.; Haese A.) IRCCS Ospedale Policlinico San Martino, Dept. of Urology, Genoa, Italy):S694. doi:10.1016/S0302-2838(23)00533-X.

Rédigé par Arthur PEYROTTES




