Il existe plus de 200 maladies neuromusculaires (MNM) touchant l'enfant comme l'adulte. Elles sont des maladies rares, le plus souvent d'origine génétique ou auto-immune. Elles affectent moins d'une personne sur 2000 en France mais elles sont à l'origine d'une perte d'autonomie et représentent donc un enjeu majeur en matière de santé.
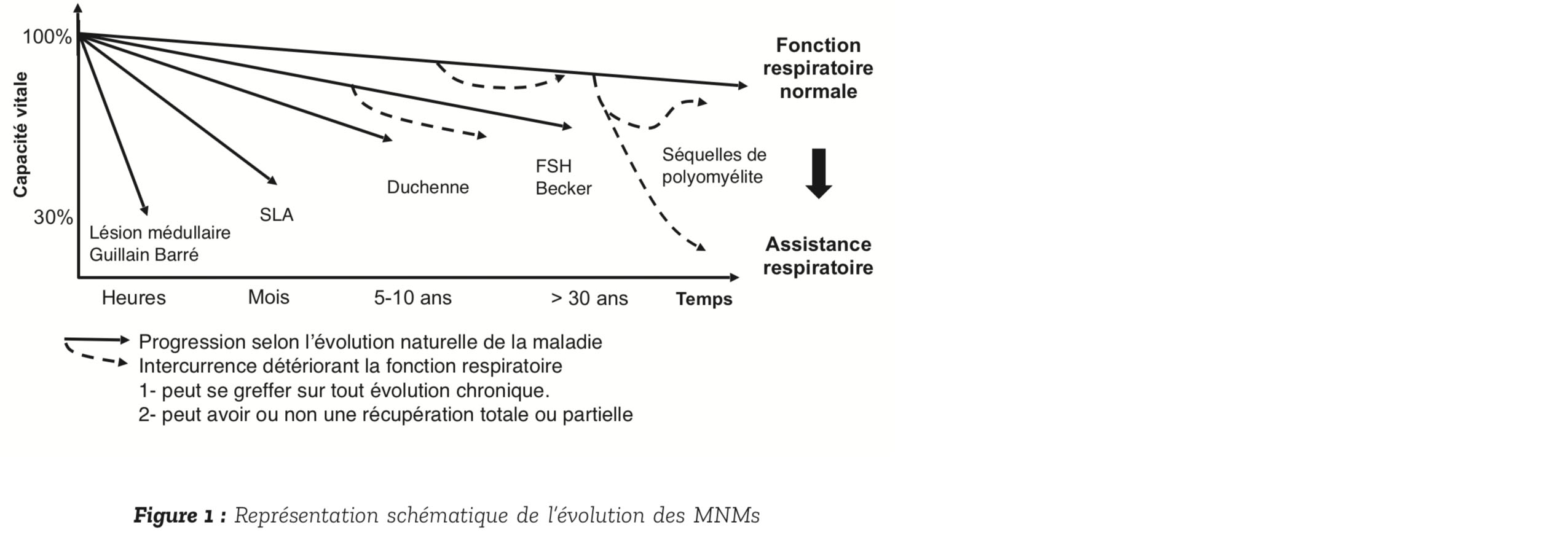
Elles constituent un groupe hétéro- gène de maladies caractérisées par des atteintes de l'unité motrice à différents niveaux (le nerf, la jonc- tion neuromusculaire ou le muscle) se manifestant par une perte de force par défaut de commande du muscle ou par destruction du mus- cle qui s'atrophie. Elles se distinguent selon leur origine, l'âge de survenue, les symptômes et les complications associées. Elles ont souvent en commun leur retentissement respiratoire. Celle-ci peut se manifester de façon aiguë sous la forme d'une détresse respiratoire, à l'occasion d'un événement intercurrent déclenché par un épisode infectieux, une embolie pulmonaire, la prise d'un traitement dépresseur respiratoire ou encore une intervention chirurgicale. Surtout, les MNM entraînent, dans un délai très variable de quelques heures à plusieurs dizaines d'années, une insuffisance respiratoire chronique progressive (Figure 1). Toute la complexité de la prise en charge respiratoire est le caractère insidieux de l'atteinte respiratoire qui risque d'être sous-estimée alors qu'elle reste la principale cause de morbi-mortalité des patients neuromusculaires. On verra quelles modalités sont utiles pour dépister précocement et prendre en charge efficacement l'atteinte respiratoire chez les patients neuromusculaires.
Dépistage d'une atteinte respiratoire chez les patients neuro-musculaires
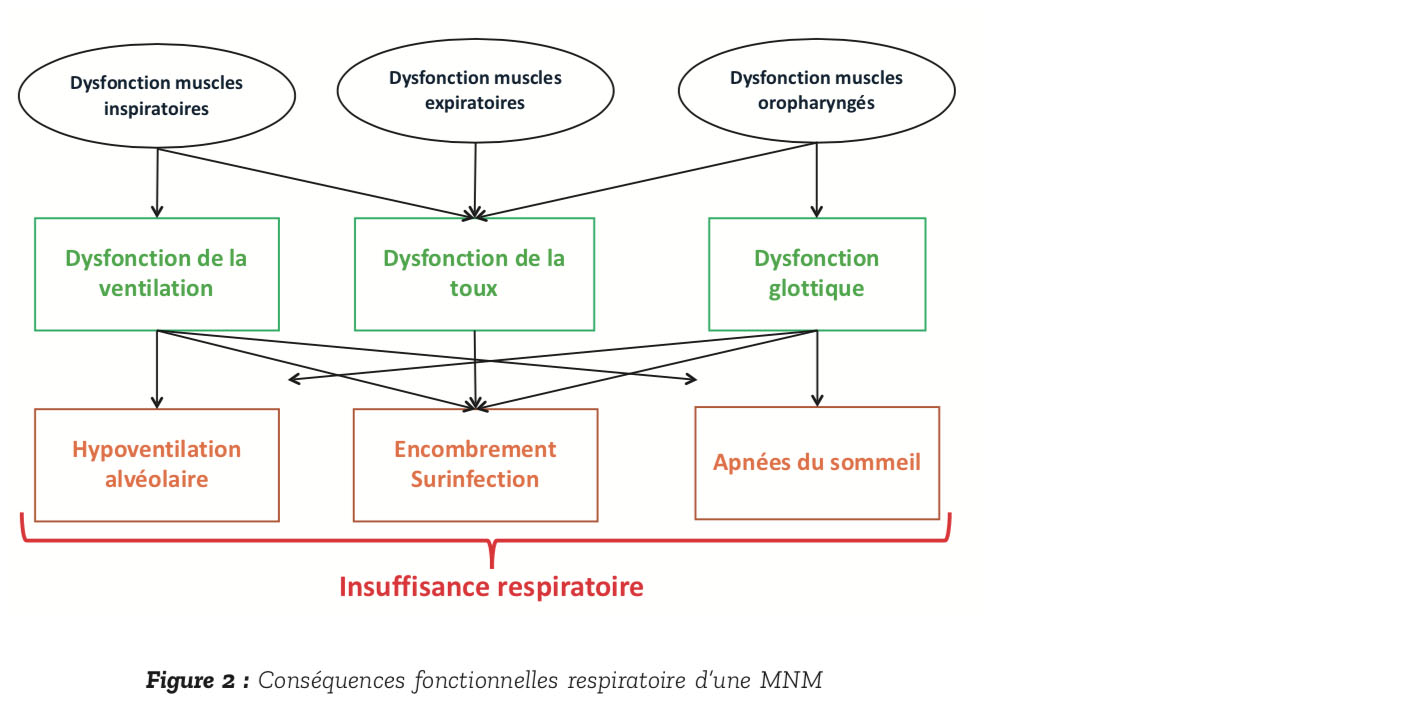
L'atteinte respiratoire résulte d'une diminution progressive des propriétés contractiles des muscles inspiratoires mais aussi expiratoires et des muscles oropharyngés (Figure 2, d'après (1)).
Faiblesse diaphragmatique
L'aggravation progressive de la fai- blesse diaphragmatique conduit à un syndrome restrictif sévère à l'origine d'une hypoventilation alvéolaire nocturne, plus particulièrement en som- meil paradoxal (2), puis diurne. Son diagnostic nécessite, de façon régulière et rigoureuse, une évaluation clinique, une exploration fonctionnelle et un dépistage des anomalies respiratoires nocturnes.
Évaluation clinique
L'évaluation clinique recherche systématiquement les symptômes et les signes cliniques en rapport avec la défaillance ventilatoire.
La dyspnée et l'orthopnée témoignent d'une dysfonction diaphragmatique sévère et apparaissent tardivement, d'autant plus que la limitation des capacités locomotrices par le handicap supprime les plaintes liées à l'effort physique. Différents outils permettent de quantifier spécifiquement l'orthopnée. Par exemple, l'item 11 de l'échelle ALFRS-R pour la sclérose la- térale amyotrophique (un score à 3 au moins justifie un avis pneumolo- gique (3)) ou l'échelle de Borg modifiée en position allongée (4).
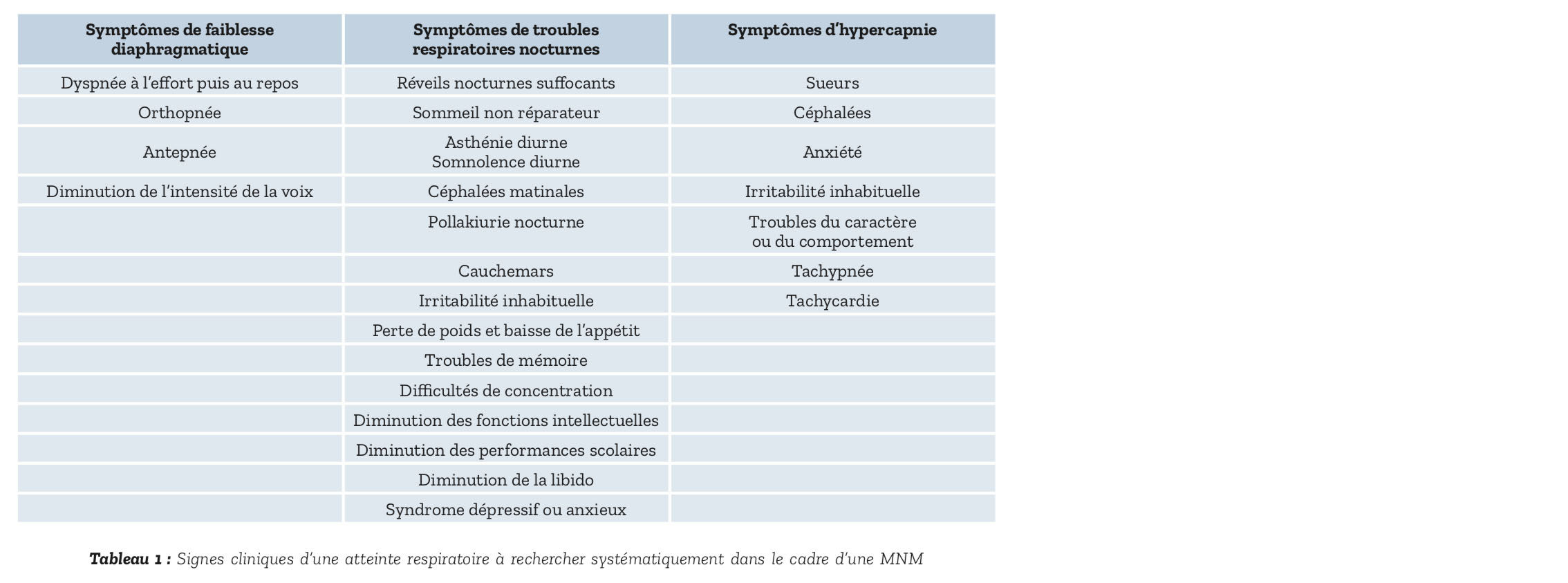
La présence d'autres symptômes d'une atteinte respiratoire récapitulés dans le Tableau 1 doit être recherchée.
L'examen physique réalisé si possible en position strictement allongée recherche une utilisation des muscles respiratoires accessoires ou une respiration abdominale paradoxale. Leur présence témoigne d'une faiblesse diaphragmatique sévère.
Explorations fonctionnelles respiratoires
L'exploration de la fonction ventilatoire, dont la réalisation est parfois difficile chez les patients handicapés, repose sur la spirométrie avec mesure de la capacité vitale (CV) en position assise et couchée. Cela reste un outil très largement utilisé même si la CV ne diminue significativement que lorsque la force diaphragmatique est réduite d'au moins 50 % (5). La mise en évidence d'un changement postural de la CV, avec une réduction d'aumoins15à20%enpositioncou- chée (6), suggère plus précocement une dysfonction diaphragmatique (spécificité 90 %, sensibilité 79 %) (7).
Une évaluation spécifique de la force des muscles inspiratoires doit être effectuée en complément, elle repose sur la pression inspiratoire maximale (Pimax) et la mesure de pression sniff nasale (SNIP). La SNIP est le paramètre non invasif le plus pertinent pour évaluer la force globale des muscles inspiratoires. Compte tenu des discordances fréquentes entre les deux mesures, il est cependant utile d'effectuer les deux mesures et de retenir dans l'interprétation la meilleure des deux pressions. Des valeurs supérieures à -70 cmH2O chez l'homme et -60 cmH2O chez la femme sont rarement associées à une faiblesse significative des mus- cles inspiratoires. Toutefois, ces tests théoriquement simples ont plusieurs limites : 1/ la contribution du dia- phragme à l'effort inspiratoire est variable, 2/ des valeurs basses ne sont pas spécifiques, pouvant être dues à un manque de motivation ou de coopération, 3/ l'importance des écarts types des valeurs théoriques rend leur interprétation difficile no- tamment aux âges extrêmes, 4/ il y a un risque de sous-estimation chez le patient BPCO, du fait de l'élévation de la constante de temps broncho-pulmonaire, 5/ les manœuvres sont par- fois impossibles du fait de l'atteinte neuromusculaire (incapacité à éviter les fuites buccales, incapacité à réaliser des mouvements respiratoires de nature balistique en cas de syndrome cérébelleux ou extrapyramidal) (8).
La mesure des gaz du sang artériel ou capillaire artérialisé à la recherche d'une hypoventilation alvéolaire (PaCO2 supérieur ou égale à 45 mmHg) ou d'une hypoxémie est indispensable.
Dépistage d'anomalies respiratoires nocturnes
La fréquence du syndrome d'apnées obstructives du sommeil semble augmentée dans certaines MNM (maladie de Charcot Marie Tooth (9), sclérose latérale amyotrophique (10)). En raison des profondes modifications physiologiques de la respiration liées au sommeil, la faiblesse diaphragmatique débutante se traduit par une hypoventilation alvéolaire la nuit, plus particulièrement au cours du sommeil paradoxal. Des apnées centrales peuvent être observées, notamment dans la myotonie de Steinert où la commande ventilatoire est altérée. Il faut savoir rechercher ces troubles respiratoires liés au sommeil (11).
Une oxymétrie nocturne de pouls est indispensable. La présence de pics de désaturation fait suspecter un syndrome d'apnées obstructives du sommeil tandis qu'une désaturation en plateau évoque une hypoven- tilation alvéolaire (12). Elle doit être confrontée à une évaluation clinique de la qualité du sommeil la nuit de l'enregistrement. Réalisée facilement au domicile grâce aux prestataires de santé, elle permet ainsi une évaluation de débrouillage, en cas de symptômes.
La capnographie nocturne pourrait permettre un dépistage plus précoce de l'hypoventilation nocturne chez les patients neuromusculaires. C'est le seul examen qui permet de distinguer l'origine de l'hypoxémie nocturne en différenciant hypoventilation et inégalités ventilation-perfusion.Toutefois, cet examen reste de réalisation difficile au domicile, en raison du coût du matériel, de sa disponibilité et des fréquents échecs techniques. Son interprétation est délicate, de nombreux seuils pour définir l'hypoventilation alvéolaire nocturne étant publiés (13). Par ailleurs, l'impact pronostique d'une suppléance ventilatoire précoce reste faible au prix d'une tolérance difficile à l'appareillage nocturne chez les patients asymptomatiques (14-16). En l'état actuel des connaissances, cet examen ne peut être recommandé en première intention d'autant que son interprétation est sujette à controverse. La capnographie sera donc réalisée en seconde intention en cas de discordance entre les symptômes, les explorations fonctionnelles et l'oxymétrie nocturne.
La polygraphie ventilatoire doit être réservée aux patients suspects de syndrome d'apnées obstructives du sommeil. La polysomnographie, idéalement comprenant un mar- queur de l'effort inspiratoire comme l'électromyogramme des muscles du cou ou des intercostaux externes, sera réalisée dans les cas plus complexes, en cas de discordance ou lorsqu'on suspecte une hypoventilation nocturne isolée avec un retentisse- ment sur l'architecture du sommeil.
Faiblesse de la toux
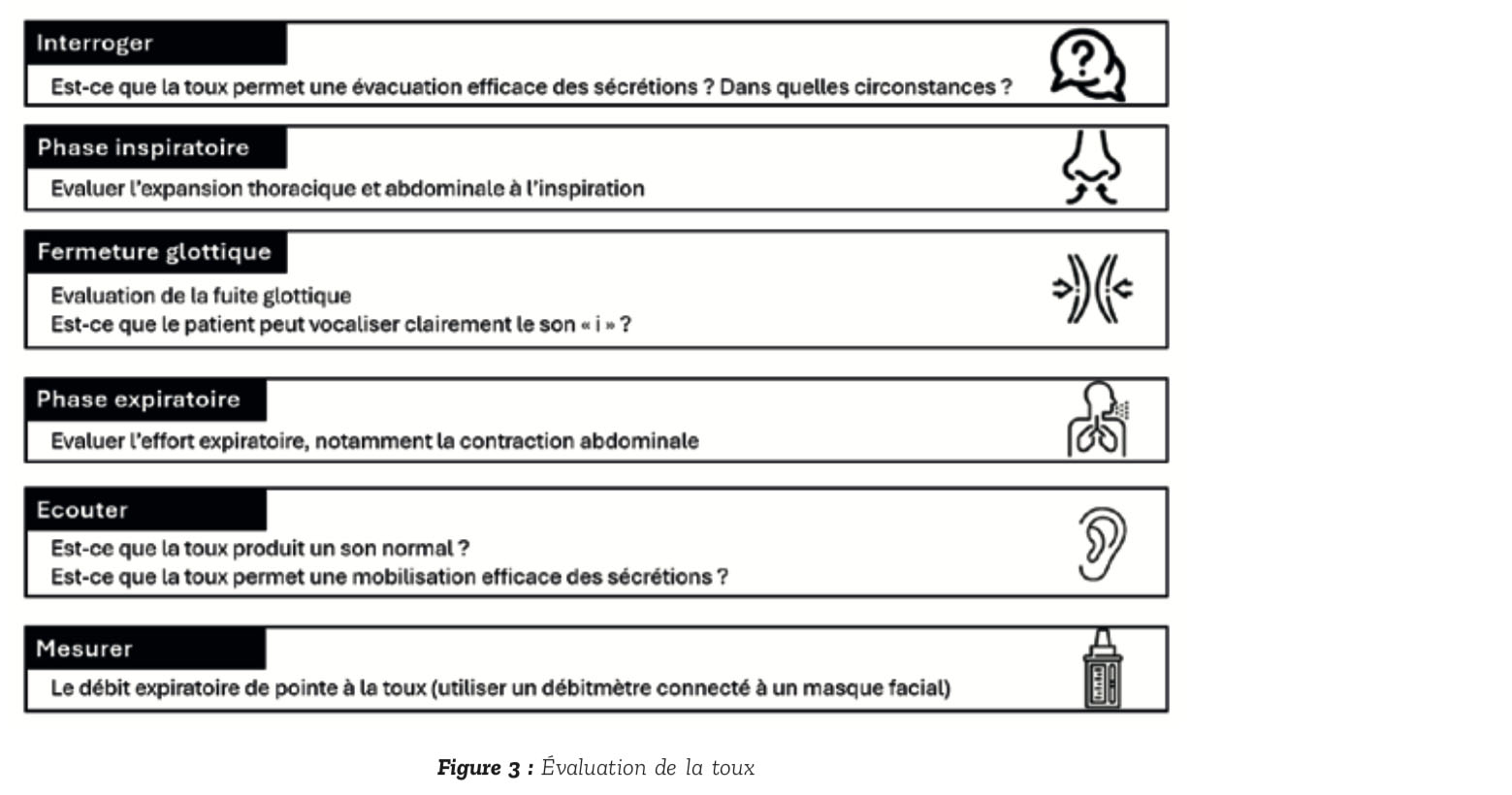
L'encombrement est favorisé par une atteinte de la toux liée à une fai- blesse des muscles inspiratoires et expiratoires associée à une dysfonction glottique. D'éventuels troubles de la déglutition peuvent aggraver l'encombrement. L'impact pronos- tique d'une faiblesse de la toux étant largement établi, son efficacité doit être régulièrement évaluée, en utilisant différentes composantes illustrées par la Figure 3, d'après (17).
La mesure du DEP à la toux permet d'évaluer simplement l'efficacité de la toux. Il doit être réalisé à l'aide d'un masque naso-buccal à chaque évaluation clinique. Chez les sujets âgés de plus de 12 ans, une toux normale est associée à un DEP supérieur à 360 l/min (18). Un DEP à la toux en dessous de 270 l/min permettrait de prédire le risque d'une toux spontanée inefficace en cas d'infection respiratoire aiguë (19).
On apprécie aussi l'encombrement bronchique, avec ou sans stéthoscope.
Principes généraux de prise en charge de l'atteinte respiratoire des patients neuromusculaires
Assistance ventilatoire par ventilation non invasive
Au cours des MNM, la ventilation non invasive (VNI) améliore la survie et la qualité de vie, malgré la progression du handicap physique en diminuant les symptômes de l'hypoventilation (20, 21). Sa prescription en France est facilitée par la qualité des réseaux associatifs et privés permettant le maintien à domicile de ces patients et la prise en charge par les caisses d'Assurance Maladie. Les critères d'initiation d'une venti- lation non invasive sont différents d'une MNM à l'autre (22). On peut globalement retenir que la présence 1/ d'une hypoventilation alvéolaire diurne ou nocturne quelles que soient ces modalités diagnostiques (gazométrie artérielle, oxymétrie ou capnographie transcutanée nocturne) et 2/ de symptômes sévères, notamment l'orthopnée, ou de signes cliniques d'insuffisance diaphragmatique, notamment la respiration abdominale paradoxale et la contraction des muscles inspiratoires accessoires, sont des indications formelles. Les altérations fonctionnelles (baisse de la capacité vitale, chute en position couchée, diminution des pressions inspiratoires maximales) font également partie des critères d'initiation de la VNI, avec des seuils d'une sévérité très différente en fonction de la MNM (par exemple, critères précoces pour les patients souffrant de SLA ou, au contraire, tardif pour les patients souffrant de myopathie de Duchenne).
Matériel
Etant donné le caractère vital de la suppléance ventilatoire, le handicap sévère des patients, l'évolution de la maladie et l'existence de besoins spé- cifiques (notamment dans le cadre d'une dépendance à la ventilation 24h/24, l'utilisation de respirateurs de niveau 2 ou 3 selon la classification de la Haute Autorité de Santé peut être privilégiée. Un circuit monobranche et un masque industriel doté de fuites intentionnelles sont utilisés. Un humidificateur chauffant complète le circuit).
Un masque nasal doit être utilisé en première intention car ils permettent une meilleure humidification et préservent la communication comme la possibilité de s'alimenter sous ventilation. Le masque nasal est également plus sécurisant en cas de handicap des membres supérieurs en cas d'épisodes de vomissement. Le masque nasal peut être problématique chez les patients bulbaires car la fermeture buccale incomplète, particulièrement pendant le sommeil, peut favoriser les fuites et compromettre l'efficacité de la ventilation. Dans ce cas, une mentonnière est utilisée puis, en cas d'échec, un masque naso-buccal est mis en place. Les fermetures à aimants, plus faciles à manipuler, peuvent être proposées en respectant les contre-indications (pacemaker, corps étrangers métalliques de l'extrémité céphalique en particulier). Le modèle finalement choisi est le meilleur compromis entre le confort du patient et l'efficacité de la ventilation. Très rapidement, on doit mettre en place une seconde interface, cette alternative permet de varier les points d'appui et diminuer le risque d'escarre nasal ou de s'adapter aux besoins spécifiques du patient pendant la ventilation diurne. Il peut s'agir d'une pipette buccale.
Paramètres de la ventilation non invasive
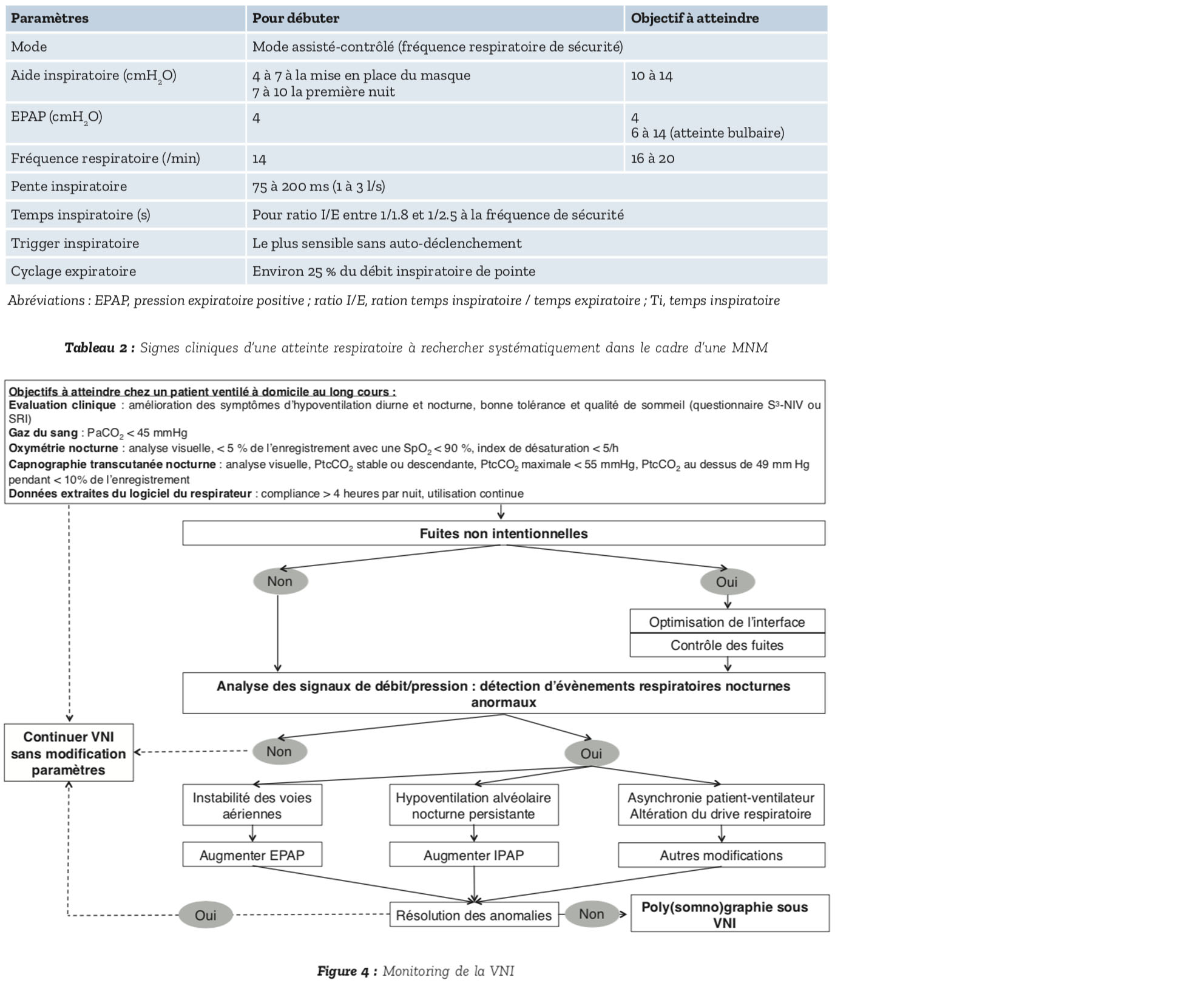
Bien qu'il n'y ait pas de preuve formelle qu'il soit plus efficace sur les symptômes, la capnie ou la survie que le mode volumétrique (23), historiquement utilisé pour la ventilation des patients neuromusculaires, il est recommandé d'initier la ventilation en mode barométrique car il assure mieux la compensation des fuites comme la synchronie patient-ventilateur. Il permet également un meilleur confort et une adaptation plus rapide du patient à la ventilation. Un mode assisté contrôlé avec une fréquence minimale de sécurité doit être utilisé. Les para- mètres initiaux recommandés par le groupe de travail GAVO2 de la Société de Pneumologie de Langue Française figurent dans le Tableau 2. Ils sont accessibles dans leur intégralité sur internet (https:/splf.fr/documents-et-liens-gavo2/).
Lieu de mise en place de la ventilation non invasive
Des travaux récents ont étudié la possibilité d'initier la VNI au domicile chez les patients neuromusculaires, notamment atteints de SLA. D'autres systèmes comme une hospitalisation de jour d'une seule journée ou un système de télémédecine au domicile aboutissent à la même observance et à la même efficacité de la ventilation qu'une hospitalisation classique (24-26). Cependant, ces résultats reposent sur un télésuivi au domicile très rapproché. Or, l'infrastructure de la télémédecine et les ressources médico-techniques sont actuellement insuffisantes en France. La mise en place de la VNI s'effectue donc selon l'organisation du centre, les conditions socio-économiques du malade et sa situation géographique, sans qu'une préférence n'émerge entre l'hospitalisation complète, l'hospitalisation de jour ou l'hospitalisation de nuit.
Modalités de surveillance de la ventilation non invasive
L'objectif de la VNI est de corriger l'hypoventilationalvéolairediurneet nocturne et les symptômes associés. Les modifications respiratoires physiologiques liées au sommeil et l'utilisation de la VNI peuvent induire des évènements respiratoires nocturnes anormaux. Les plus fréquents sont les fuites, l'instabilité des voies aériennes supérieures associée ou non à une diminution de la commande ventilatoire puis les asynchronies patient-ventilateur.
Des données robustes récentes mettent en évidence l'influence de la mauvaise qualité de la ventilation non invasive sur la survie des patients neuromusculaires. Une surveillance régulière des patients après la mise en place de la VNI est donc recommandée, un mois après la mise en place puis tous les 3 à 12 mois. Le rythme peut être plus rapproché si la VNI est mal adaptée ou mal supportée. Le rythme peut être plus éloigné pour les patients bien contrôlés sous VNIavecundéclinlentdelafonction respiratoire.
De nombreux outils sont disponibles, du plus simple au plus complexe pour la surveillance de la VNI. Nous proposons de suivre l'algorithme en Figure 4. La surveillance de la VNI doit comporter au minimum une évaluation clinique qui pourra être systématisée grâce à l'utilisation du questionnaire S3-NIV27 ou du questionnaire SRI (28), une oxymétrie nocturne, une gazométrie et un examen des données issues du logiciel intégré au ventilateur.
Les anomalies les plus fréquentes sont la présence de fuites et une perméabilité insuffisante des voies aériennes supérieures (29, 30).
D'autres causes d'échec sont identifiées : aérophagie, claustrophobie sous le masque, rhinite, lésions cutanées dues au masque. Elles n'ont rien de spécifique et les solutions à apporter ne diffèrent pas des autres maladies.
Enfin, l'encombrement est une cause d'échec de la VNI particulièrement fréquente chez les patients neuromusculaires.
La VNI n'empêche pas l'évolution de la maladie. Le patient et son entourage doivent être informés de la dépendance progressive à l'assistance respiratoire. Le patient doit être informé de la possibilité d'arrêt d'assistance respiratoire sous sédation dans le cadre du refus de l'obstination déraisonnable.
Désencombrement
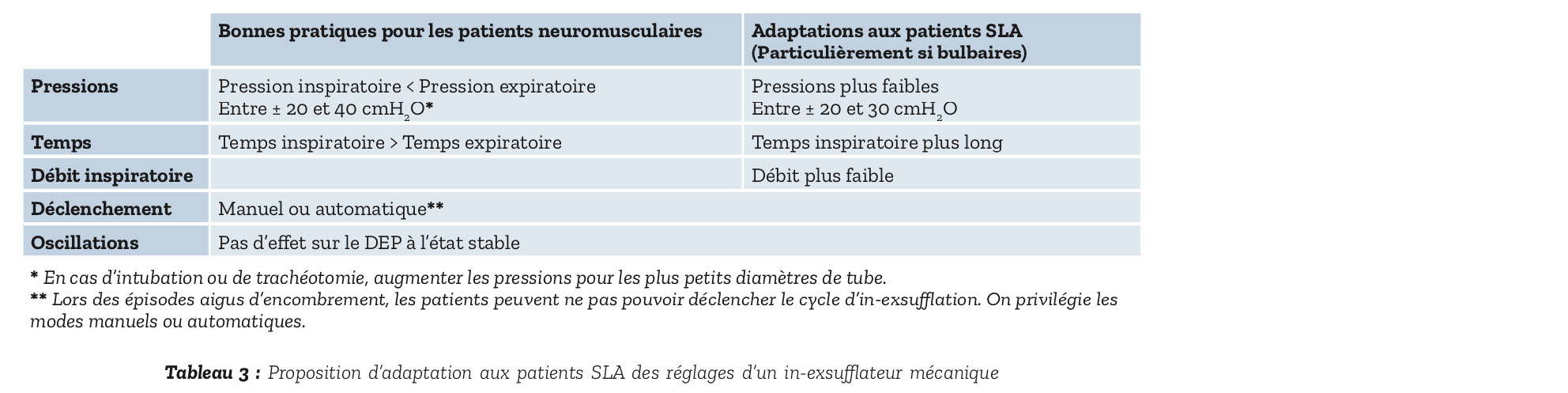
Avec un DEP à la toux en dessous de 270 l/min, une aide mécanique à la toux doit être mise en place car les techniques manuelles kinésithérapiques classiques peuvent engendrer une fatigue et se révéler inefficaces. Après une première phase de drainage des sécrétions périphériques, différentes techniques instrumentales existent qui compensent soit la phase inspiratoire soit la phase expiratoire d'élimination des sécrétions des voies aériennes proximales. Elles nécessitent toutes une grande expertise du personnel soignant ainsi qu'une formation des patients et des aidants. Une mise en place avant les périodes aiguës d'encombrement est donc conseillée. Elles pourront ainsi être utilisées à visée curative lorsque le débit expiratoire de pointe chute en dessous de 160 l/min. Chez les patients neuromusculaires les plus faibles, l'utilisation d'inexsufflateurs mécaniques doit être privilégiée (31). Le Tableau 3 propose des modalités pratiques pour l'initiation d'un in-exsufflateur mécanique.
Place de la ventilation invasive
En cas d'insuffisance respiratoire aiguë, l'intubation ne doit pas être systématique. Elle sera réalisée ou non selon les souhaits du patient, exprimé par ses directives anticipées ou par sa personne de confiance le cas échéant.
La trachéotomie est proposée dans un contexte d'insuffisance respiratoire aiguë en relais de l'intubation ou dans un contexte d'insuffisance respiratoire chronique lorsque la ventilation non invasive est insuffisamment efficace ou mal supportée alors que les patients en sont devenus dépendants 24h/24, notamment lorsqu'une dysfonction des muscles oropharyngés entraîne des troubles de la déglutition et un mauvais contrôle de l'expulsion des sécrétions (32). Elle sera réalisée ou non selon l'acceptation ou le refus du patient (importance des directives anticipées) en fonction des préconisations médicales, de ses souhaits, de son histoire personnelle et familiale et du contexte clinique. En effet, la trachéotomie pose de nombreux problèmes éthiques et logistiques, et représente une charge émotionnelle importante pour le patient et son entourage. Les contraintes de cette technique sont considérables (aides techniques, aménagement du logement, recours à une tierce personne) et viennent augmenter la dépendance d'un sujet déjà très handicapé. Par ailleurs, la ventilation sur trachéotomie au long cours chez les patients atteints de MNM présente des particularités liées essentiellement à la nécessité de permettre la phonation et la déglutition : utilisation de canules sans ballonnet, la ventilation à fuite nécessitant des volumes courants plus importants; ajout d'une pression expiratoire positive pour maintenir une pression sous-glottique positive pendant l'expiration et prolongation du temps inspiratoire.
Place de l'oxygénothérapie
La présence d'une désaturation chez un patient neuromusculaire doit faire évoquer en première intention une hypoventilation alvéolaire dont le traitement adéquat est la ventilation non invasive et non l'oxygénothérapie.
Il peut être nécessaire d'adjoindre à la ventilation non invasive une oxygénothérapie en cas de décompensation respiratoire aiguë.
Aux mêmes titres que les mor- phiniques ou les benzodiazépines, l'oxygénothérapie peut être proposée en fin de vie pour soulager la dyspnée, en complément ou en alternative à la ventilation non invasive, lorsqu'un arrêt de celle-ci est envisagé (33).
Place du stimulateur phrénique
Pour les patients tétraplégiques dépendant d'une ventilation mécanique 24h/24 en raison de lésions médullaires cervicales au-dessus de C4, la stimulation simultanée continue des deux hémi-diaphragmes, assurée par des électrodes implantées par voie chirurgicale autour des deux nerfs phréniques, est une méthode de ventilation efficace (34).
La stimulation phrénique n'a pas de place dans la prise en charge respiratoire des autres MNM (35, 36).
Traitements d'appoint
Il faut être attentif aux aspects nu- tritionnels et la prise en charge des troubles de la déglutition.
Différents protocoles de réentraînement des muscles inspiratoires et expiratoires ont été proposés dans différentes MNM avec des résultats discutables (SLA, myopathie de Duchenne) (37). Chez les patients tétraplégiques, cette rééducation permet d'avoir une autonomie ventilatoire de quelques minutes à quelques heures permettant les transferts ou la toilette, et assurant une sécurité en cas de panne de ventilateur.
En conclusion, les MNM ont des répercussions respiratoires selon des mécanismes variés qui sont des causes majeures de morbi-mortalité. Au sein d'une équipe pluridisciplinaire, le pneumologue a un rôle central dans la prise en charge pour le bilan initial, l'information des patients et de leurs familles, l'anticipation des évènements respiratoires, la mise en place et la surveillance des traitements dont l'assistance ventilatoire mécanique. Par ailleurs, la thérapie génique a fondamentalement modifié l'évolution de certaines MNM, particulièrement l'amyotrophie spinale, et le pneumologue doit prendre part à l'évaluation de ces traitements révolutionnaires.
Focus myopathie de Duchenne
• Anomalie du gène DMD, codant pour la dystrophine, situé sur le chromosome X.
• 100 à 150 garçons nouveau-nés atteints de la myopathie de Duchenne chaque année.
• Début des symptômes musculaires dans l'enfance avec un retard d'acquisition de la marche.
• Nécessité de fauteuil roulant vers l'âge de 10-12 ans.
• Espérance de vie entre 20-40 ans, d'une complication cardiaque ou respiratoire.
• Traitement : corticothérapie, thérapie génique.
Points clés pour le pneumologue
• Atteinte respiratoire tardive, avec nécessité d'assistance ventilatoire vers l'âge de 20 ans.
• Mettre en place les outils nécessaires en cas de dépendance à la VNI 24h/24 : ventilation à la pièce buccale et discussion trachéotomie.
• Risque de facteur confondant : cardiomyopathie dilatée, troubles du rythme.
• Symptômes possibles chez les femmes transmettrices.
Focus myotonie de Steinert
• Anomalie du gène DMPK, codant pour la myotonine, situé sur le chromosome 19.
• Augmentation du nombre de triplet CTG (de 50 à plus de 3000 répétitions).
• Plus le nombre de répétitions est élevé plus la maladie est sévère (le nombre de répétitions a tendance à augmenter au fil des générations, l'amplification varie selon le sexe du parent transmetteur et le nombre de répétitions dont il est porteur).
• Prévalence de 1 patient sur 20 000 à 25 000.
• La forme habituelle débute vers 30 ans associant une atrophie et une myotonie musculaire.
• Faciès particulier : visage allongé, ptosis, oreilles basses implantées, calvitie et cataracte précoces.
• Atteinte cardiaque : essentiellement troubles de conduction.
• Pas de traitement spécifique.
• Pronostic très variable selon la sévérité de la maladie.
Points clés pour le pneumologue
• Atteinte diaphragmatique tardive (environ 50 ans).
• Apnées centrales par une atteinte de la commande ventilatoire.
• Somnolence « narcolepsy-like » peu améliorée par l'appareillage respiratoire nocturne. → Réputés difficiles à ventiler avec fréquente difficulté d'observance.
Focus sclérose latérale amyotrophique
• Maladie neurodégénérative dont l'étiologie n'est pas connue.
• Plus de 30 gènes candidats identifiés dans les formes familiales.
• Environ 1500 nouveaux cas par an en France.
• Touche surtout l'adulte entre 40 et 70 ans, sex ratio : hommes (1,7:1). → Traitement : riluzole, édaravone, thérapie génique.
Points clés pour le pneumologue
• Atteinte diaphragmatique dans les 12 à 24 mois après la confirmation diagnostique.
• 5 % des SLA débutent par l'atteinte diaphragmatique (faiblesse diaphragmatique isolée, les signes neurologiques apparaissant dans les mois qui suivent).
• Amélioration de la survie et de la qualité de vie sous VNI.
• Complexité de la prise en charge des patients bulbaires.
• Importance d'une surveillance trimestrielle de la fonction respiratoire au sein d'une équipe pluridisciplinaire.
Références
1. Benditt JO, Boitano LJ. Pulmonary issues in patients with chronic neuromuscular disease. Am J Respir Crit Care Med. 2013;187(10):1046-1055.
2. Arnulf I, Similowski T, Salachas F, et al. Sleep disorders and diaphragmatic function in patients with amyotrophic lateral sclerosis. Am J Respir Crit Care Med. 2000;161(3 Pt 1):849-856.
3. Georges M, Perez T, Rabec C, et al. Proposals from a French expert panel for respiratory care in ALS patients. Respir Med Res. 2022;81:100901.
4. Just N, Bautin N, Danel-Brunaud V, Debroucker V, Matran R, Perez T. The Borg dyspnoea score: a relevant clinical marker of inspiratory muscle weakness in amyotrophic lateral sclerosis. Eur Respir J. 2010;35(2):353-360.
5. Tilanus TBM, Groothuis JT, TenBroek-Pastoor JMC, et al. The predictive value of respiratory function tests for non- invasive ventilation in amyotrophic lateral sclerosis. Respir Res. 2017;18(1):144.
6. Brault M, Gabrysz-Forget F, Dube BP. Predictive value of positional change in vital capacity to identify diaphragm dysfunction. Respir Physiol Neurobiol. 2021;289:103668.
7. Fromageot C, Lofaso F, Annane D, et al. Supine fall in lung volumes in the assessment of diaphragmatic weakness in neuromuscular disorders. Arch Phys Med Rehabil. 2001;82(1):123-128.
8. Laveneziana P, Albuquerque A, Aliverti A, et al. ERS statement on respiratory muscle testing at rest and during exercise. Eur Respir J. 2019;53(6).
9. Dziewas R, Waldmann N, Böntert M, et al. Increased prevalence of obstructive sleep apnoea in patients with Charcot-Marie- Tooth disease: a case control study. J Neurol Neurosurg Psychiatry. 2008;79(7):829-831.
10. Quaranta VN, Carratù P, Damiani MF, et al. The Prognostic Role of Obstructive Sleep Apnea at the Onset of Amyotrophic Lateral Sclerosis. Neurodegener Dis. 2017;17(1):14-21.
11. Saulnier L, Prigent H, Hartley S, et al. Sleep disordered breathing assessment in patient with slowly progressive neuromuscular disease. Sleep Med. 2024;114:229-236.
12. Pépin JL, Chouri-Pontarollo N, Orliaguet O, Lévy P. [Alveolar hypoventilation during sleep and domiciliary assisted ventilation]. Rev Mal Respir. 2005;22(1 Pt 1):113-125.
13. Janssens JP, Cantero C, Pasquina P, Georges M, Rabec C. Monitoring Long Term Noninvasive Ventilation: Benefits, Caveats and Perspectives. Front Med (Lausanne). 2022;9:874523.
14. Jacobs TL, Brown DL, Baek J, Migda EM, Funckes T, Gruis KL. Trial of early noninvasive ventilation for ALS: A pilot placebo-controlled study. Neurology. 2016;87(18):1878-1883.
15. Bertella E, Banfi P, Paneroni M, et al. Early initiation of night-time NIV in an outpatient setting: a randomized non- inferiority study in ALS patients. Eur J Phys Rehabil Med. 2017;53(6):892-899.
16. Raphael JC, Chevret S, Chastang C, Bouvet F. Randomised trial of preventive nasal ventilation in Duchenne muscular dystrophy. French Multicentre Cooperative Group on Home Mechanical Ventilation Assistance in Duchenne de Boulogne Muscular Dystrophy. Lancet. 1994;343(8913):1600-1604.
17. Chatwin M, Wakeman RH. Mechanical Insufflation- Exsufflation: Considerations for Improving Clinical Practice. J Clin Med. 2023;12(7).
18. Chatwin M, Toussaint M, Gonçalves MR, et al. Airway clearance techniques in neuromuscular disorders: A state of the art review. Respir Med. 2018;136:98-110.
19. Sancho J, Servera E, Díaz J, Marín J. Predictors of ineffective cough during a chest infection in patients with stable amyotrophic lateral sclerosis. Am J Respir Crit Care Med. 2007;175(12):1266-1271.
20. Bourke SC, Tomlinson M, Williams TL, Bullock RE, Shaw PJ, Gibson GJ. Effects of non-invasive ventilation on survival and quality of life in patients with amyotrophic lateral sclerosis: a randomised controlled trial. Lancet Neurol. 2006;5(2):140-147.
21. Eagle M, Baudouin SV, Chandler C, Giddings DR, Bullock R, Bushby K. Survival in Duchenne muscular dystrophy: improvements in life expectancy since 1967 and the impact of home nocturnal ventilation. Neuromuscul Disord. 2002;12(10):926-929.
22. Clinical indications for noninvasive positive pressure ventilation in chronic respiratory failure due to restrictive lung disease, COPD, and nocturnal hypoventilation--a consensus conference report. Chest. 1999;116(2):521-534.
23. Sancho J, Servera E, Morelot-Panzini C, Salachas F, Similowski T, Gonzalez-Bermejo J. Non-invasive ventilation effectiveness and the effect of ventilatory mode on survival in ALS patients. Amyotroph Lateral Scler Frontotemporal Degener. 2014;15(1-2):55-61.
24. van den Biggelaar RJM, Hazenberg A, Cobben NAM, Gaytant MA, Vermeulen KM, Wijkstra PJ. A Randomized Trial of Initiation of Chronic Noninvasive Mechanical Ventilation at Home vs In-Hospital in Patients With Neuromuscular Disease and Thoracic Cage Disorder: The Dutch Homerun Trial. Chest. 2020;158(6):2493-2501.
25. Réginault T, Bouteleux B, Wibart P, et al. At-home noninvasive ventilation initiation with telemonitoring in amyotrophic lateral sclerosis patients: a retrospective study. ERJ Open Res. 2023;9(1).
26. Sheers NL, Hannan LM, Rautela L, et al. NIV@Home: a pilot randomized controlled trial of in-home noninvasive ventilation initiation compared to a single-day admission model. Amyotroph Lateral Scler Frontotemporal Degener. 2025;26(3-4):239-248.
27. Dupuis-Lozeron E, Gex G, Pasquina P, et al. Development and validation of a simple tool for the assessment of home noninvasive ventilation: the S(3)-NIV questionnaire. Eur Respir J. 2018;52(5).
28. Kleiven AL, Markussen H, Skjønsberg OH, Janssens JP, Aarrestad S. Effect of Respiratory Events on Health- Related Quality of Life in Patients Treated with Long-Term Noninvasive Ventilation. Respiration. 2022;101(12):1099-1109.
29. Gonzalez-Bermejo J, Morelot-Panzini C, Arnol N, et al. Prognostic value of efficiently correcting nocturnal desaturations after one month of non-invasive ventilation in amyotrophic lateral sclerosis: a retrospective monocentre observational cohort study. Amyotroph Lateral Scler Frontotemporal Degener. 2013;14(5-6):373-379.
30. Georges M, Attali V, Golmard JL, et al. Reduced survival in patients with ALS with upper airway obstructive events on non-invasive ventilation. J Neurol Neurosurg Psychiatry. 2016;87(10):1045-1050.
31. Chatwin M, Simonds AK. Long-Term Mechanical Insufflation- Exsufflation Cough Assistance in Neuromuscular Disease: Patterns of Use and Lessons for Application. Respir Care. 2020;65(2):135-143.
32. Santé HAd. Place et gestion de la trachéotomie dans la prise en charge de la dépendance ventilatoire des patients atteints de maladies neuromusculaires lentement évolutives. Novembre 2020.
33. Morelot-Panzini C, Bruneteau G, Gonzalez-Bermejo J. NIV in amyotrophic lateral sclerosis: The ‘when' and ‘how' of the matter. Respirology. 2019;24(6):521-530.
34. Elefteriades JA, Quin JA, Hogan JF, et al. Long-term follow- up of pacing of the conditioned diaphragm in quadriplegia. Pacing Clin Electrophysiol. 2002;25(6):897-906.
35. McDermott CJ, Bradburn MJ, Maguire C, et al. DiPALS: Diaphragm Pacing in patients with Amyotrophic Lateral Sclerosis - a randomised controlled trial. Health Technol Assess. 2016;20(45):1-186.
36. Gonzalez-Bermejo J, Morelot-Panzini C, Tanguy ML, et al. Early diaphragm pacing in patients with amyotrophic lateral sclerosis (RespiStimALS): a randomised controlled triple-blind trial. Lancet Neurol. 2016;15(12):1217-1227.
37. Silva IS, Pedrosa R, Azevedo IG, et al. Respiratory muscle training in children and adults with neuromuscular disease. Cochrane Database Syst Rev. 2019;9(9):Cd011711.
Pr Marjolaine GEORGES
PU-PH au CHU de Dijon

