Introduction et épidémiologie
Les sarcomes sont des tumeurs rares classées parmi les tumeurs mésenchymateuses, caractérisées par leur origine dans le tissu conjonctif, le muscle lisse ou d'autres structures de soutien. Au niveau utérin, elles représentent 3-7 % des tumeurs, avec comme sous-type le plus courant le léiomyosarcome (LMS ; 60-70 % des sarcomes), qui provient des cellules du muscle lisse de l'utérus.
Le myomètre est également la première localisation des léiomyosarcomes (35-40 % d'entre eux).
L'Organisation Mondiale de la Santé (OMS), dans sa classifi cation de 2020, a subdivisé les tumeurs mésenchymateuses utérines en trois grands groupes : les sarcomes du stroma utérin - riches en cellules stromales de type fi broblastique - les léiomyosarcomes utérins (LMS) - qui sont eux-mêmes classifi és en trois sous-types histologiques en fonction de la morphologie de leurs cellules : fusiforme, épithélioïde et myxoïde -, et les tumeurs mésenchymateuses plus rares, comme les PECome (Perivascular Epithelioid Cell Tumor),qui sont des tumeurs à cellules épithélioïdes avec un fort potentiel vasculaire.
Le léiomyosarcome survient principalement en pré et péri-ménopause, avec un âge médian de diagnostic de 50 ans, et son incidence augmente avec l'âge.
D'autres facteurs de risque ont été décrits, parmi lesquels une irradiation pelvienne antérieure, la prise de Tamoxifène, et certains variants constitutionnels, tels que le rétinoblastome congénital (variant RB1) et le syndrome de Li-Fraumeni (variant TP53).
Pronostic
Le léiomyosarcome utérin est la tumeur utérine avec le plus mauvais pronostic, qui reste très sombre bien qu'il soit le plus fréquemment diagnostiqué à un stade localisé (supérieure à 50 % des cas).
Il rechute dans la majorité des cas (53-71 % à 5 ans), en général sous forme métastatique, principalement pulmonaire (40 %) et pelvienne (13 %).
Les facteurs pronostiques décrits sont le stade FIGO principalement, l'index mitotique et le morcellement tumoral au moment de la première chirurgie. Les patientes préménopausées ont également un meilleur pronostic.
La survie à 5 ans, selon le stade, est respectivement de 76 % (FIGO I), 60 % (FIGO II), 45 % (FIGO III), 29 % (FIGO IV).
Au stade métastatique, la survie sans progression est de 5-8 mois et la survie globale de 10-12 mois (1)(2).

Classification FIGO 2023
Diagnostic
Le léiomyosarcome utérin est généralement asymptomatique, et lorsque des symptômes apparaissent, ils sont aspécifiques : métrorragies (56 %), douleurs abdominales ou pelviennes (22 %), masse pelvienne palpable (54 %).
Le diagnostic de cette tumeur est très diffi cile et se fait généralement par accident, au décours d'une chirurgie de fi brome qui consiste en une chirurgie partielle. Or, en cas de découverte fortuite de léiomyosarcome, le pronostic est souvent impacté par la dissémination tumorale.
Ainsi, en cas de suspicion de léiomyosarcome ou lors de la planifi cation d'une chirurgie partielle pour toute tumeur du myomètre, il est recommandé de réaliser une IRM pelvienne complète (jusqu'à la veine rénale gauche) avec des séquences T2 – hypersignal en cas de uLMS, perfusion et diff usion pour éliminer les diagnostics différentiels comme les fibromes kystiques ou œdémateux, et permettre de distinguer certaines lésions bénignes (Abdle Wahab et al., Radiology, 2020).
Bien que le diagnostic soit le plus souvent fait sur la pièce opératoire, une biopsie de l'endomètre peut parfois être utile, bien qu'elle soit moins sensible. Les biopsies à l'aiguille de la lésion ne sont généralement pas recommandées, et rarement pratiquées en cas de lésions métastatiques.
Il existe 3 sous-types histologiques des uLMS (cf. tableau ci-dessous).

La relecture des lames par un.e pathologiste expert.e appartenant au réseau RRePS est indispensable.
La classification FNLCLCC (des sarcomes) n'est pas applicable aux léiomyosarcomes viscéraux, qui sont par définition de haut grade.
Les tumeurs musculaires lisses avec potentiel de malignité incertaines ou de bas grade sont appelées STUMP, et ne sont donc pas considérées comme des léiomyosarcomes.
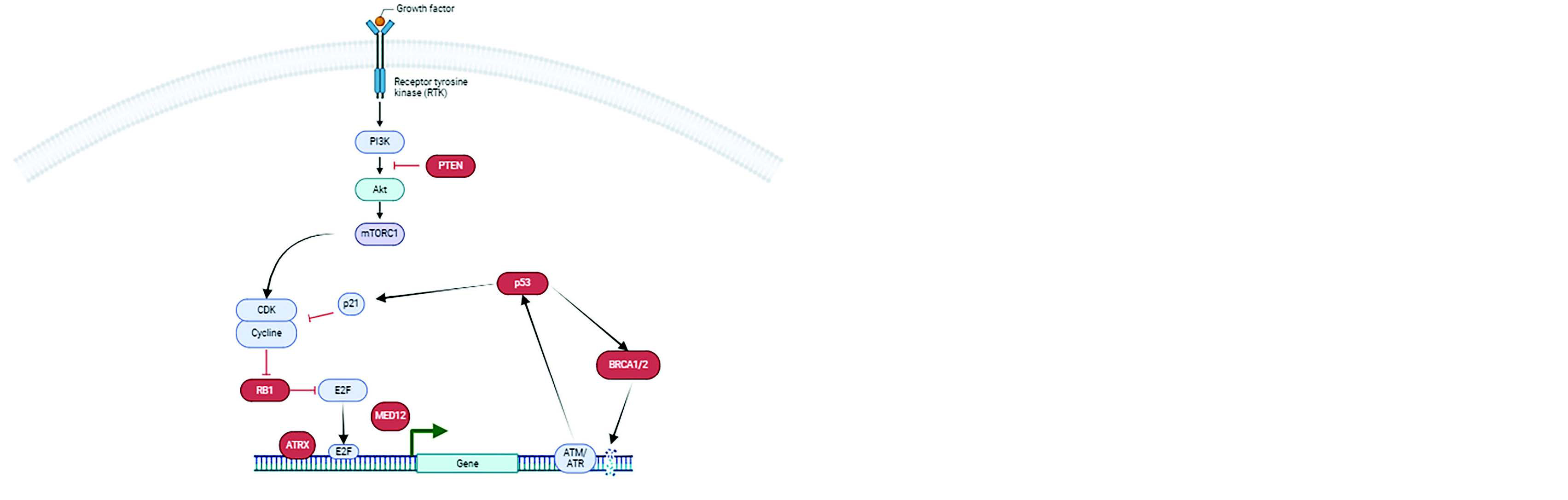
Les LMS font également partie des sarcomes à génétique complexe, dont le TMB est généralement faible. Les mutations que l'on retrouve le plus fréquemment sont TP53 ++ RB1 +++, PTEN ++ ATRX, MED12. Les LMS utérins ont aussi la particularité d'être HRD, jusqu'à 50 % selon les séries.
Traitements
Atteinte localisée (stades I et II)
En cas d'atteinte localisée, la chirurgie par laparotomie avec hystérectomie totale en bloc et annexectomie bilatérale est le gold standard. La conservation des ovaires est possible chez une femme préménopausée avec atteinte strictement utérine.
Si le léiomyosarcome a été découvert sur une pièce d'hystérectomie partielle, une reprise chirurgicale pour hystérectomie totale est recommandée.
Le curage ganglionnaire est recommandé en cas d'atteinte ganglionnaire peropératoire ou radiologique.
La radiothérapie n'est pas recommandée.
En cas de résection complète pour une tumeur FIGO I, une surveillance simple avec avis RCP sarcome est recommandé. Pour les stades II totalement réséquées, une surveillance est indiquée et, après avis indispensable en RCP sarcome, une chimiothérapie adjuvante, bien que controversée, est parfois faite : préférentiellement à base de doxorubicine seule, mais parfois associée à de la dacarbazine ou de l'ifosfamide.
Atteinte localement avancée (FIGO III et IVa)
Le traitement de référence des uLMS localement avancé repose sur la chirurgie première en cas de lésion complètement résécable, avec curage ganglionnaire en cas d'atteinte prouvée.
La chimiothérapie adjuvante n'est pas recommandée, basée sur une méta-analyse de 2020 (Di Scioscio, et al, 2020) ne retrouvant pas de bénéfice.
Elle peut être discutée en cas d'effraction tumorale : elle repose alors sur des schémas à base d'anthracyline (associé à l'ifosfamide ou la dacarbazine) ou Gemcitabine-docetaxel.
La radiothérapie externe n'a pas été étudiée dans le cadre d'essais cliniques, elle est parfois proposée en RCP pour des stades III. L'hormonothérapie en maintenance peut également être proposée chez des léiomyosarcomes ER/PR positif, bien qu'aucune étude à ce jour n'ait montré d'intérêt en termes de survie (3).
Surveillance
Un examen clinique est recommandé tous les 3 à 4 mois pendant 3 ans, puis tous les 6 à 12 mois ensuite.
Un TDM TAP sera réalisé une fois tous les 3 à 4 mois pendant 2 à 3 ans, puis 1 à 2 fois par an pendant 2 à 7 ans. L'imagerie de référence peut également être une association d'une IRM abdomino-pelvienne et d'un TDM thoracique. Il est enfin possible de réaliser une TEP TDM en cas de doute sur une atteinte métastatique.
Traitement de la rechute
En cas de rechute locale ou localement avancée, la reprise chirurgicale est le traitement de première intention. Si la maladie n'est pas résécable, une radiothérapie externe est à privilégier.
Une chimiothérapie adjuvante est à considérer en RCP sarcomes.
Le traitement de la rechute métastatique est le même que celui de la maladie d'emblée métastatique.
Selon les cas, une chimiothérapie palliative, par exemple par doxourbicine ou ifosfamide, peut être envisagée.
Atteinte métastatique à distance
Pour les patientes atteintes d'uLMS métastatique, la première ligne recommandée est basée sur l'association doxorubicine-trabectédine. L'étude de phase III LMS-04, a comparé cette combinaison à la monothérapie par doxorubicine en première ligne, jusque-là traitement de première intention. Les résultats de cette étude ont montré une PFS médiane de 12 mois dans le groupe traité par doxorubicine et trabectédine, comparé à 6 mois dans le groupe doxorubicine seule. De plus, l'OS médiane était de 33 mois avec la combinaison, contre 24 mois pour la monothérapie (4).
En cas de contre-indication à la doxorubicine, l'association gemcitabine-docétaxel est recommandée comme alternative. Des essais cliniques de phase II ont confi rmé l'effi cacité de cette combinaison en tant que traitement de deuxième ligne ou pour des patients ne pouvant recevoir d'anthracyclines, avec des taux de réponse variant entre 18 % et 53 % selon les cohortes et une PFS médiane avoisinant les 5 à 6 mois dans cette population (5).
Selon la réponse à la chimiothérapie, une chirurgie est possible, pouvant aller jusqu'à la pelvectomie totale selon les organes atteints.
Si la maladie est contrôlée, une chirurgie de la tumeur primitive est possible, par hystérectomie voire pelvectomie selon l'atteinte des organes de voisinage. La chirurgie des métastases peut s'envisager en cas de maladie oligométastatique.
La deuxième ligne de chimiothérapie repose sur une association gemcitabine et dacarbazine, trabectédine ou pazopanib ; ou sur du témozolomide ou dacarbazine seule.
Comme pour les atteintes localement avancées, l'hormonothérapie de maintenance peut également être proposée chez des léiomyosarcomes RH+. Une étude monobras phase II étudie le letrozole chez les uLMS avec des résultats encourageants.
Deux études de phase II à bras unique indiquent des résultats encourageants concernant l'utilisation des inhibiteurs de PARP chez les patientes atteintes de sarcome utérin présentant une déficience en recombinaison homologue (HRD) et prétraitées par chimiothérapie. La première étude, menée par Asano et al., a évalué l'effi cacité du niraparib en monothérapie et a observé des réponses partielles chez certaines patientes, bien que les données restent limitées (6). La seconde étude, dirigée par Ingham et al., a examiné l'association de l'olaparib avec la temozolomide, rapportant un taux de réponse global de 27 %, malgré des eff ets secondaires hématologiques nécessitant des ajustements posologiques (7). Cependant, les données actuelles demeurent insuffi santes pour permettre une utilisation clinique généralisée de ces thérapies dans le traitement du uLMS.
En cas d'atteinte multimétastatique et d'état général conservé, il est fortement recommandé d'orienter la patiente vers un essai clinique.
Conclusion
Le léiomyosarcome utérin est une tumeur rare, au diagnostic complexe et au pronostic souvent défavorable à court terme. Toutefois, les progrès récents en thérapeutique, notamment grâce à de nouvelles combinaisons de chimiothérapies, ont permis une amélioration de la prise en charge. Des pistes prometteuses, parmi lesquelles certaines thérapies ciblées, ouvrent cependant la voie à des stratégies de soin plus personnalisées. Dans ce contexte, il est essentiel d'inclure les patientes dans des essais cliniques au cours de leur prise en charge pour évaluer ces nouvelles approches et optimiser les traitements.

Par Lila PHILIPPS
Bibliographie
Article basé sur les reférentiel de prise en charge du GSF-GETO/NETSARC+ et du groupe TMRG.
1. Seagle BL, Sobecki-Rausch J, et al. Prognosis and treatment of uterine leiomyosarcoma: A National Cancer Database study. Gynecol Oncol 2017: 146 :254–262.
2. Kapp DS, Shin JY, Chan JK. Prognostic factors and survival in 1396 patients with uterine leiomyosarcomas: emphasis on impact of lymphadenectomy and oophorectomy. Cancer. 2008;112:820-30.
3. Reed, N. S., Mangioni, C., Malmström, H., Scarfone, G., Poveda, A., Pecorelli, S., ... & European Organisation for Research and Treatment of Cancer Gynaecological Cancer Group. (2008). Phase III randomised study to evaluate the role of adjuvant pelvic radiotherapy in the treatment of uterine sarcomas stages I and II: an European Organisation for Research and Treatment of Cancer Gynaecological Cancer Group Study (protocol 55874). European Journal of Cancer, 44(6), 808-818.
4. Pautier, P., Italiano, A., Piperno-Neumann, S., et al. Doxorubicin alone versus doxorubicin with trabectedin followed by trabectedin alone as fi rst-line therapy for metastatic or unresectable leiomyosarcoma (LMS-04): a randomised, multicentre, open-label phase 3 trial. The Lancet Oncology. 2022; 23(8): 1044-1054. doi:10.1016/S1470-2045(22)00380-1.
5. Hensley, M. L., Blessing, J. A., Mannel, R., & Rose, P. G. "Fixed-dose rate gemcitabine plus docetaxel as first-line therapy for metastatic uterine leiomyosarcoma: a Gynecologic Oncology Group phase II trial." Gynecologic Oncology, 2008, 109(3), 329334. doi:10.1016/j.ygyno.2008.03.010.
6. Asano et al., 2021; ClinicalTrials.gov Identifier : NCT04321018.
7. Ingham, M., Allred, J. B., Chen, L., et al. (2023). Phase II study of olaparib and temozolomide for advanced uterine leiomyosarcoma (NCI Protocol 10250). Journal of Clinical Oncology. Published online July 19, 2023. doi:10.1200/JCO.23.0040.

