Erythroid/Megakaryocytic differentiation confers BCL-XL dependency and venetoclax resistance in acute myeloid leukemia
Heikki Kuusanmäki, Olli Dufva, Markus Vähä-Koskela et al. Blood 2023.
Le vénétoclax, depuis les résultats de l'essai VIALE A1, a intégré les recommandations de traitement des patients atteints de leucémie aiguë myéloïde (LAM) non éligibles à une chimiothérapie intensive.
Les leucémies aiguës érythroblastiques (M6 selon la classification FAB) et mégacaryoblastiques (M7 selon la classification FAB) sont associées à un pronostic défavorable notamment en raison de résistances aux chimiothérapies et aux thérapies ciblées. Ces résistances s'expliquent en partie par des propriétés génétiques et cytogénétiques fréquemment défavorables (une association aux mutations de TP53 ou encore à des délétions des chromosomes 5 ou 7 ont été mises en évidence)2, 3.
Cette étude s'intéresse aux voies de différenciation et de survie des LAMs mégacaryoblastiques et érythroblastiques avec pour objectifs de mieux comprendre les mécanismes de résistance au vénétoclax et de développer de nouvelles approches thérapeutiques.
Méthodes de l'étude
Cette étude a porté sur la comparaison de lignées cellulaires ou de cellules de patients par des approches de génomique, de transcriptomique, d'expression protéique, d'analyse de « single-cell », de séquençage d'ARN et sur des expositions à haut débit d'agents pharmacologiques sur des lignées tumorales. Par ailleurs, un modèle tumoral murin a été développé pour évaluer in vivo la réponse obtenue in vitro aux agents pharmacolo-giques d'intérêt.
Cette étude a porté sur des prélèvements médullaires de 21 patients au diagnostic, en rechute ou au statut réfractaire au traitement de la LAM et par ailleurs sur 21 lignées issues de deux laboratoires (the Deutsche Sammlung von Mikroorganismen und Zellkulturen et l'American Type Culture Collection). Lors des tests d'exposition aux agents pharma-cologiques à haut débit, les molécules ont été testées à différentes concentrations avec une durée d'exposition des cellules de 72h.
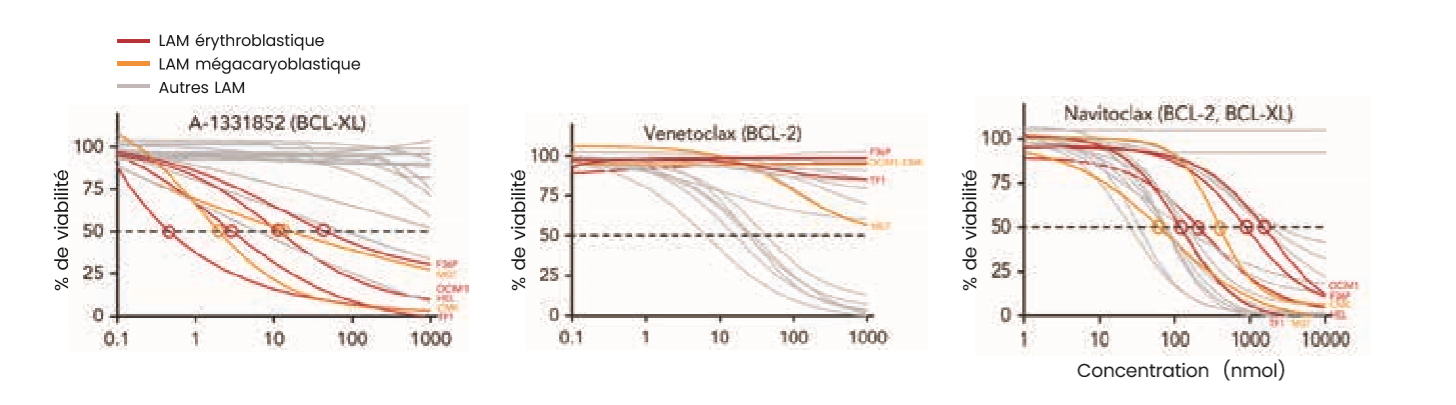
Figure 1 : Évaluation de la sensibilité des lignées tumorales à 3 agents pharmacologiques en fonction de leur concentration : A-1331852 (inhibiteur sélectif de BCL-XL), vénétoclax (inhibiteur sélectif de BCL2), navitoclax (inhibiteur de BCL2 et BCL-XL), adaptée de H. Kuusanmäki et al., Blood 2023.
Résultats de l'étude
Parmi les agents pharmacologiques d'intérêt, des molécules modulant l'apoptose en inhibant BCL-XL ont montré in vitro un effet sur les lignées érythroblastiques et méga-caryoblastiques. En comparaison, l'efficacité des inhibiteurs de BCL2 était moindre dans ces lignées cellulaires. Par ailleurs d'autres classes de molécules ont montré leur intérêt in vitro, la plicamycine (inhibiteur de la synthèse d'ARN en agissant sur FLI1 et SP1) et deux inhibiteurs de JAK avec le ruxolitinib et le baricitinib.
En comparant la réponse des lignées entre elles, les auteurs se sont aperçus que la sensibilité aux inhibiteurs de BCL2 et de MCL-1 était diminuée dans les lignées éry-throblastiques et mégacaryoblas-tiques en comparaison à d'autres lignées de LAM. Enfin le navitoclax4 à la fois inhibiteur de BCL2, BCL-XL et BCL-W a montré son efficacité dans les différentes lignées mais celle-ci semble moindre que celle des inhibiteurs sélectifs de BCL-XL dans les lignées érythroblastiques et méga-caryoblastiques.
Pour mieux comprendre ces résultats, les auteurs se sont intéressés à la comparaison de l'effet sur la survie cellulaire de l'extinction des gènes BCL2L1 qui code notamment pour BCL-XL et JAK2 par des approches de CRISPER-Cas9 ou encore d'ARN interférence. Il apparaît que les lignées érythroblastiques et mégacaryoblastiques sont dépendantes de BCL2L1 pour leur survie et au contraire le sont très peu de MCL1 ou de BCL2 en comparaison aux autres lignées de LAM.
Ensuite, le rôle des mutations de TP53 a été évalué dans la sensibilité des cellules des différentes lignées aux agents pharmacologiques par une approche d'extinction du gène et d'exposition aux molécules d'intérêt. Il apparaît que les cellules des différentes lignées perdant l'expression de TP53 présentent une diminution significative de leur sensibilité au vénétoclax sans perte de sensibilité aux inhibiteurs de BCL-XL (Figure 2).
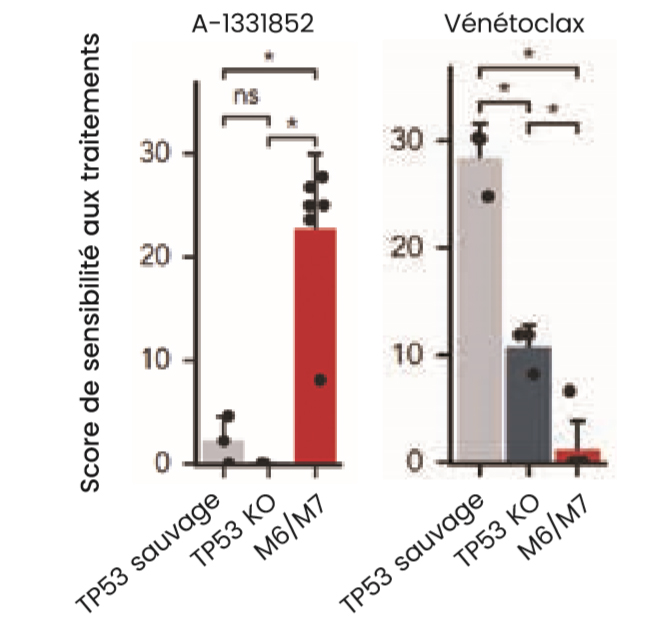
Figure 2 :Comparaison de la sensibilité au A-1331852 (inhibiteur sélectif de BCL-XL) et au vénétoclax (inhibiteur de BCL2) dans les lignées de LAM M6/M7 et autres lignées en l'absence d'expression de TP53. Un groupe contrôle des lignées non M6/M7 avec expression de TP53 est également présenté. Adaptée de H. Kuusanmäki et al., Blood 2023
Une autre approche a été de mesurer le niveau d'expression de MCL1, BCL2L1 dans les différentes lignées et il apparaît que BCL2L1 est surexprimé dans les lignes érythroblastiques et mégacaryoblastiques dans les cellules du TGCA. Par ailleurs,BCL 2 était plus représentée dans les lignées moins différenciées M0 et M1 selon la classification FAB ainsi que dans les lignées de cellules de type promyélocytaire. L'expression du gène MCL1 était plus représentée dans les lignées de LAM de type M4 et M5 et au contraire diminuée de même que celle de BCL2 dans les lignées érythroblastiques ou méga-caryoblastiques.
Les blastes de patients dont la LAM était de type M6 (5 patients) et M7 (3 patients) ont également fait l'objet de tests de sensibilité aux inhibiteurs de BCL-XL et de BCL2. Parmi ces patients, 4 étaient réfractaires à l'association d'un agent hypo-méthylant avec le vénétoclax. Les résultats montrent une plus grande sensibilité à l'inhibiteur de BCL-XL en comparaison au vénétoclax sauf chez les patients porteurs de mutations IDH2 ou SRSF2. De fait, ces mutations sont connues pour favoriser la dépendance à BCL2. Enfin, les cellules de patients présentant une mutation de TP53 étaient sensibles à l'inhibiteur de BCL-XL et moins au vénétoclax.
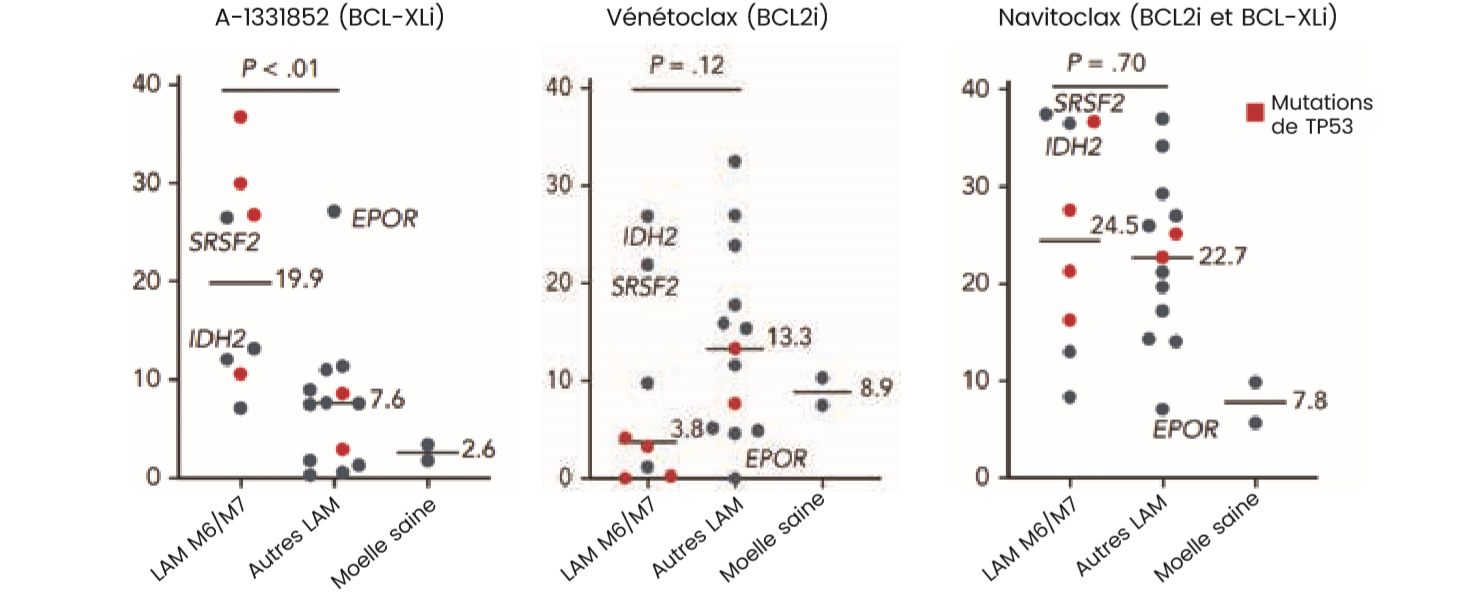
Figure 3 :Sensibilité des cellules issues de patients au A-1331852 (inhibiteur sélectif de BCL-XL), au Vénétoclax (inhibiteur sélectif de BCL2) et au navitoclax (inhibiteur de BCL-XL et BCL2) Adaptée de H. Kuusanmäki et al., Blood 2023
Dans le modèle murin de greffe leucémique érythroblastique avec un suivi de bioluminescence tumorale, a été introduit le A-1331852 en prise orale deux fois par jour. L'inhibiteur de BCL-XL a permis de réduire la masse tumorale de façon significative dans la majorité des cas. Cependant chez certaines souris les cellules tumorales ont persisté sous exposition au A-1331852 et ont proliféré dans les deux semaines suivant l'arrêt de l'exposition à l'inhibiteur.
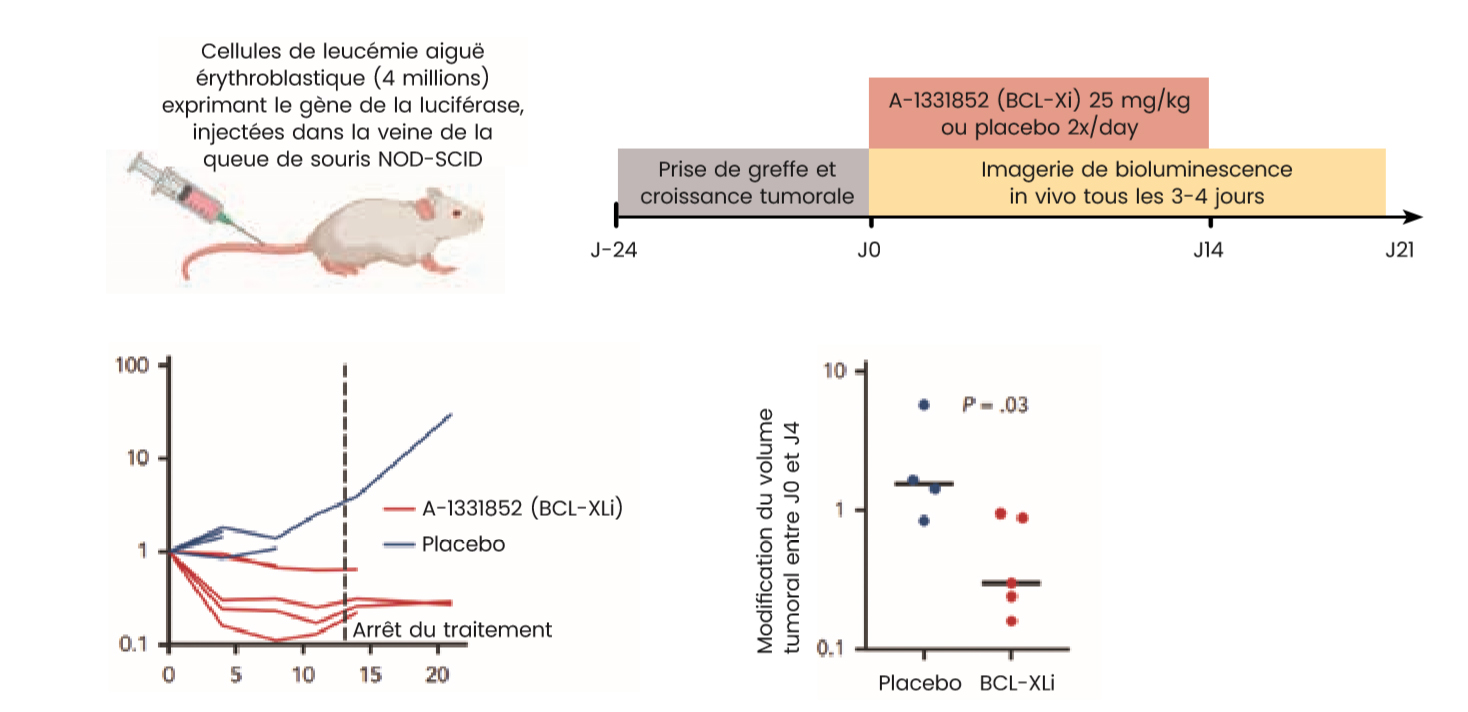
Figure 4 :Suivi du volume tumoral de leucémie aiguë érythroblastique dans le modèle de souris en exposition au A-1331852 (inhibiteur de BCL-XL) ou à un agent contrôle, adapté de H. Kuusanmäki et al., Blood 2023
Conclusions et perspectives
Cette étude met en évidence que les leucémies mégacaryoblas-tiques et érythroblastiques présentent une dépendance à BCL-XL plutôt qu'à BCL2 pour la survie et la différenciation cellulaire. Cette particularité explique en partie les échecs fréquemment observés du vénétoclax chez les patients porteurs de ces types de LAM et met en avant la nécessité de développer d'autres approches médicamenteuses.
L'inhibiteur de BCL-XL présenté dans cette étude a montré son efficacité à la fois sur des lignées cellulaires et sur des cellules de patients présentant une LAM de type M6 ou M7 in vitro et dans le modèle de greffe tumorale chez la souris. Cette découverte ouvre des perspectives thé-rapeutiques chez les patients dont la LAM est de type M6 ou M7 et/ou en rechute ou réfractaires au véné-toplax avec une faible dépendance à BCL2, ou encore à des stratégies d'association de molécules.
Par ailleurs, cette étude met en avant le modèle de translation des données in vitro vers le traitement du patient à une époque où la médecine devient de plus en plus personnalisée et ciblée. Les analyses en single-cell des prélèvements de patients, les études de sensibilité aux traitements et à leurs combinaisons pourraient devenir de nouveaux outils dans la prise de décisions thérapeutiques de façon complémentaire aux stratégies actuelles telles que la recherche des mutations actionnables ou encore la mesure de la maladie résiduelle.

Alexandre IAT
Interne en Hématologie
CHU de Nice
Références
1. 1.C.D DiNardo, B.A Jonas, V Pullarkat, et al. Azacitidine and Venetoclax in Previously Untreated Acute Myeloid Leukemia. N Engl J Med. 2020;383-217.
2. Takeda J, Yoshida K, Nakagawa MM, et al. Amplified EPOR/JAK2 genes define a unique subtype of acute erythroid leukemia. Blood Cancer Discov. 2022;3(5);410-427.
3. Iacobucci I, Wen J, Meggendorfer M, et al. Genomic subtyping and therapeutic targeting of acute erythroleukemia. Nat Genet. 2019;51(4):694-704.
4. Roberts AW, Seymour JF, Brown JR, et al.Substantial susceptibility of chronic lymphocytic leukemia to BCL2 inhibition: results of a phase I study of navitoclax in patients with relapsed or refractory disease. J Clin Oncol. 2012;30(5):488-496.

