La leucémie lymphoïde chronique (LLC) est le syndrome lymphoprolifératif B mature le plus fréquent en occident avec en France 59 % de patients de sexe masculin et un âge médian au diagnostic de 71 ans25. L'expression clinique et biologique, la réponse au traitement et son évolution sont hétérogènes. Il existe également une variabilité géographique de la prévalence et des caractéristiques cytogénétiques. Par exemple, en Asie du sud-est, la LLC est plus rare, elle atteint des patients plus jeunes et le pronostic est souvent plus sombre en raison d'un accès limité aux thérapeutiques innovantes 29. Cette revue a pour objectif de présenter les principales caractéristiques biologiques et génétiques de la LLC, les traitements actuels et les mécanismes d'échappement.
Partie II : Biologie de la LLC
La LLC appartient aux néoplasies à lymphocytes B matures et se caractérise par une prolifération de lymphocytes de petite taille, à chromatine dense, ayant parfois un aspect en « carapace de tortue ». Le frottis sanguin met en évidence un tapis de lymphocytes lysés provoqué par l'étalement sur la lame, en raison de la fragilisation du cytosquelette du clone lymphocytaire pathologique : les ombres de Gumprecht ou Smudge cells en anglais16.
Avant la phase leucémique responsable de la maladie, il existe un stade de lymphocytose B monoclonale (MBL) initiée à partir d'une cellule souche hématopoïétique7 , avec une sélection du clone au détriment des autres cellules lymphoïdes. Cette sélection a lieu lors de stimulations antigéniques particulières des lymphocytes B naïf dont le mécanisme est à ce jour mal défini. À partir de cette sélection émerge un clone de lymphocyte < 5 G/L donnant lieu à une MBL (monoclonale B-lymphocytosis) avant de passer au stade de LLC23.
Le diagnostic de LLC est suspecté sur l'hémogramme et l'examen du frottis sanguin. L'immunophénotypage des lymphocytes circulants par cytométrie en flux permet de le confirmer. La monotypie est mise en évidence par le rapport d'expression des chaînes kappa et lambda des lymphocytes B du patient et l'identification des différentes protéines de surface (Clusters of Differentiation; CD) tels que définis par le score du Royal Marsden Hospital (RMH) ou score de Matutes. La positivité des marqueurs “pan-B” matures (CD19, CD20, CD22) et la monotypie des chaînes de surface en général à faible expression caractérise la lymphocytose. Le CD5, marqueur pan-T, est très fréquemment retrouvé dans les LLC ainsi que dans les lymphomes du manteau. Si le rôle de ce récepteur n'est pas complètement élucidé, on sait qu'il est impliqué dans la transduction du signal de la voie du BCR (récepteurs des cellules B)26.
Les principaux marqueurs consensuels CD19, CD5, CD20, CD23, kappa et lambda doivent être recherchés devant une suspicion de LLC et CD43, CD79b, CD81, CD200, CD10, ainsi que ROR1 qui peuvent servir de marqueurs additionnels26. Le diagnostic de LLC est positif pour un score RMH de 4 ou 5 19.
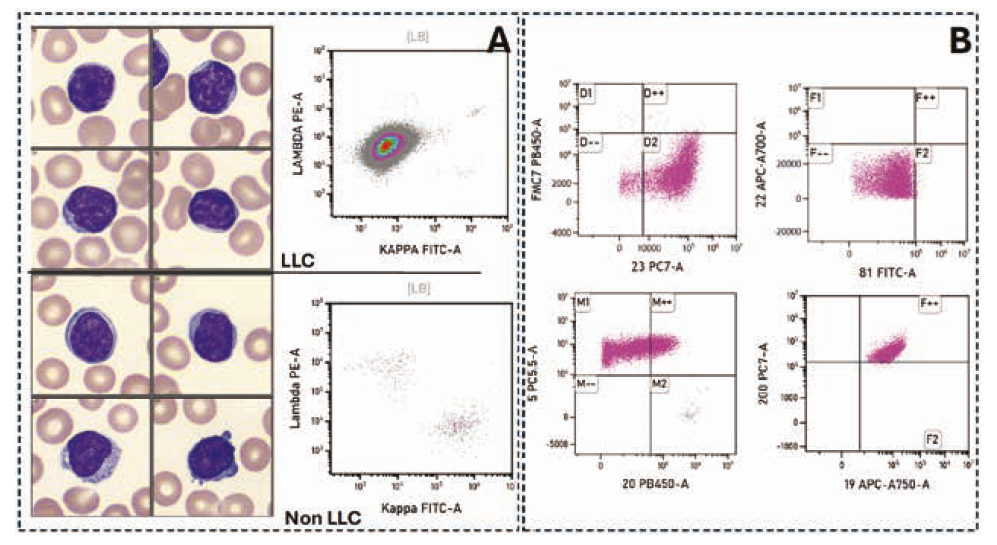
Panneau A : Profil comparatif entre un patient avec une LLC (en haut) et un sujet sain (ou non LLC) (en bas). Comparaison de la morphologie des lymphocytes au frottis sanguin, les lymphocytes de LLC d'allure monomorphe à petit lymphocytes à chromatine mottée en “carapace de tortue” et expression d'une monotypie de l'immunoglobuline de surface.
Panneau B : Profil d'expression phénotypique d'un patient connu avec une LLC typique avec un score RMH de 5. Le marqueur CD81 et CD200 peuvent aussi être utilisés pour le diagnostic.
La prolifération de ces petits lymphocytes dans le sang périphérique, la moelle osseuse et les organes lymphoïdes secondaires voire dans d'autres compartiments est modulée par la génétique de la cellule mais également par l'influence de son microenvironnement.
Les anomalies cytogénétiques habituellement retrouvées par hybridation de sonde fluorescente in situ (FISH) sont : une délétion 13q14 (50-60 %), une trisomie 12 (15-20 %), une délétion 11q23 (10-20 %) et une délétion 17p (5- 10 %). Ces anomalies ont une valeur pronostique importante et permettent parfois de définir une cible thérapeutique voire d'éventuels phénotypes de résistance moléculaire à certaines chimiothérapies15.
Il est également essentiel d'établir le statut mutationnel des gènes codant les régions variables des chaînes lourdes d'immunoglobulines (IgVH)4. La distinction entre les formes IgHV mutées et non mutées permet d'affiner le pronostic et l'évolution de la pathologie. En effet, les lymphocytes qui ont maturé dans le centre germinatif ganglionnaire, ont une meilleure réponse aux chimiothérapies contrairement aux formes IgVH non mutées dont l'évolution est plus agressive10. Enfin, la transformation de la maladie chronique en lymphome B agressif ou syndrome de Richter, est associée dans près de 9 cas sur 10 à une mutation de TP53, NOTCH1, MYC ou CDKN2A6 qu'il est important de rechercher lors du diagnostic. En pratique courante on ne recherche que TP53.
Les modifications épigénétiques sont également explorées pour préciser leur place dans la physiopathologie de la maladie. Au cours de l'évolution des lymphocytes B, le méthylome se modifie avec une déméthylation des promoteurs de nombreux facteurs de transcription critiques lors de la prolifération et la différenciation des cellules matures14, 17.
Cet état de méthylation serait distinct entre les patients exempts de la maladie et ceux atteints qui présenteraient une hypométhylation13. Plusieurs sous-types moléculaires de LLC ont été récemment décrits par l'étude de l'épigénome permettant une meilleure appréciation du pronostic11.
Le rôle du micro-environnement des organes lymphoïdes est essentiel par les différents échanges moléculaires qui s'y produisent (Figure 1). En effet, le mésenchyme et des macrophages nurse-like permettent d'activer la voie du BCR. Cette voie est habituellement activée après un contact avec un autre lymphocyte ou en réponse à la présentation d'antigène mais elle favorise également la prolifération tumorale pathologique4. Ces interactions intercellulaires sont médiées par des récepteurs solides mais aussi par des agents solubles (chimiokines,- cytokines) voire par une sécrétion vésiculaire8.
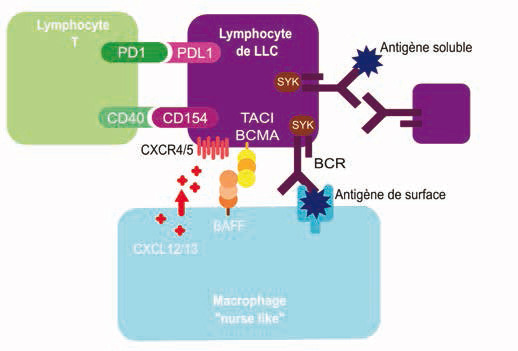
Figure 1 : Impact du microenvironnement tumoral sur la prolifération, la survie et l'immortalité des lymphocytes de LLC. Simplifié de [8] et [3]. TACI : (Transmembrane activator and CAML interactor, BCMA : B-cell maturation antigen, BCR : B-cell receptor, BAFF : B-cell activating factor, CXC : chemokine receptor).
Partie III : enjeux de la prise en charge dans la LLC
La prise en charge thérapeutique de la LLC a été révolutionnée au cours des dernières décennies par le développement des thérapies ciblées. Elle est aujourd'hui très bien codifiée tant en Europe25, Figure 2, qu'en Amérique du nord22.
L'initiation d'un traitement concerne les patients avec une maladie initiale de stade A ou B de Binet en évolution ou les patients d'emblée de stade C en raison de cytopénies ou d'une masse tumorale importante2 .
Les immunothérapies ont émergé à la fin des années 1990, avec les anti CD20 et principalement le rituximab. Le principal effet indésirable grave de cet anticorps monoclonal est le syndrome de relargage cytokinique30. Il est aujourd'hui supplanté par l'Obinutuzumab qui possède une action anti-CD20 supérieure dans la LLC et le lymphome folliculaire20.
L'avènement des thérapies ciblées a été marqué par l'introduction d'inhibiteurs dirigés contre des kinases intermédiaires de signalisation de la voie du BCR et en particulier la Bruton Tyrosine Kinase (BTK)24 (Figure 3). La molécule de première génération inhibant la BTK (BTKi) est l'ibrutinib qui est un inhibiteur irréversible par liaison covalente à la cystéine 481 de la BTK dans le site de liaison à l'ATP. L'essai RESONATE21 a permis de montrer la supériorité de l'ibrutinib face à une immunothérapie anti-CD20 chez les patients en rechute.
Cependant, la BTK n'est pas uniquement impliquée dans la voie de signalisation du BCR mais aussi dans des voies de récepteurs aux chimiokines, aux intégrines ou des TLR. Ces cibles secondaires sont responsables d'effets secondaires indésirables (par effet de classe ou inhibition d'autres kinases), en par ticulier cardiovasculaires avec des cas d'arythmie cardiaque, d'hypertension ou de syndromes hémorragiques5.
Des BTKi de nouvelle génération ayant une meilleure spécificité ont été développés tels que l'acalabrutinib et le zanubrutinib qui offrent un meilleur profil de tolérance, en particulier cardiovasculaire. L'efficacité de ces molécules a été validée en première ligne par les essais ELEVATE TN27 et SEQUOIA28. Une molécule réversible de troisième génération le Pirtobrutinib est en cours d'étude, principalement chez les patients en rechute ou réfractaires18.
Il a été également démontré que les lymphocytes B sur-expriment la protéine anti-apoptotique BCL2 (B Cell Lymphoma 2 initialement découverte dans le lymphome folliculaire). BCL2 séquestre certaines protéines pro-apoptotiques ce qui augmente la survie du clone tumoral. De nouvelles thérapies ciblées inhibant la sur-expression de BCL2, le Venetoclax, permettent de restaurer la sensibilité aux protéines pro-apoptotiques BAX et BAK. Ces protéines ont pour rôle de perméabiliser la membrane mitochondriale et de libérer le cytochrome c entraînant l'apoptose cellulaire. L'effet secondaire le plus grave, mais relativement rare, est un syndrome de lyse tumorale pour lequel une escalade de dose prudente est nécessaire avec surveillance biologique et hydratation. Les neutropénies induites sont plus fréquentes.
Avant l'initiation d'une première ligne de traitement, il est nécessaire de réaliser une analyse des facteurs prédictifs afin de choisir le meilleur traitement (Tableau 1).
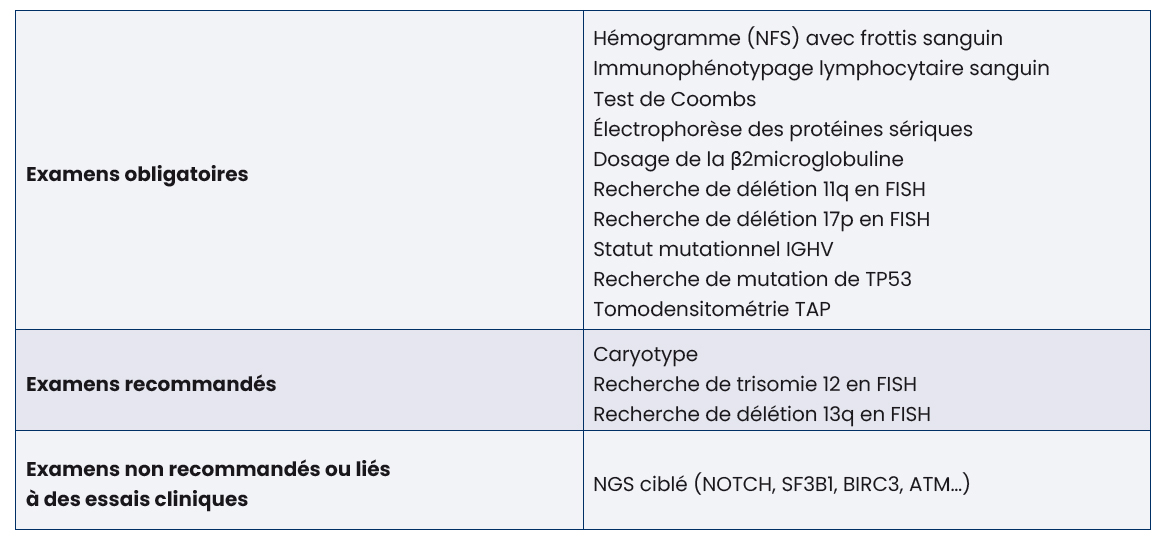
Le profil du patient : antécédents, co-médications, préférences entre un traitement fixe ou continu entre également en considération.
Ainsi, en cas d'anomalie de TP53 (délétion 17p par FISH qui concerne environ 10 % des patients en première ligne), les iBTK sont le traitement de référence en l'absence de contre-indication. En l'absence d'anomalie de TP53, le choix du traitement dépend du statut mutationnel IGHV. Chez les patients IGHV muté, un traitement par Obinutuzumab et Venetoclax pour une durée fixe de un an est privilégié, ayant permis l'obtention de réponses très prolongées chez ces patients avec un profil de tolérance très correct 1.
En cas de statut mutationnel IGHV non muté, des traitements de type BTKi en continu ou des combinaisons à durée fixe de type Ibrutinib + Venetoclax ou Obinutuzumab + Venetoclax peuvent être proposés, et doivent perte discutés avec le patient
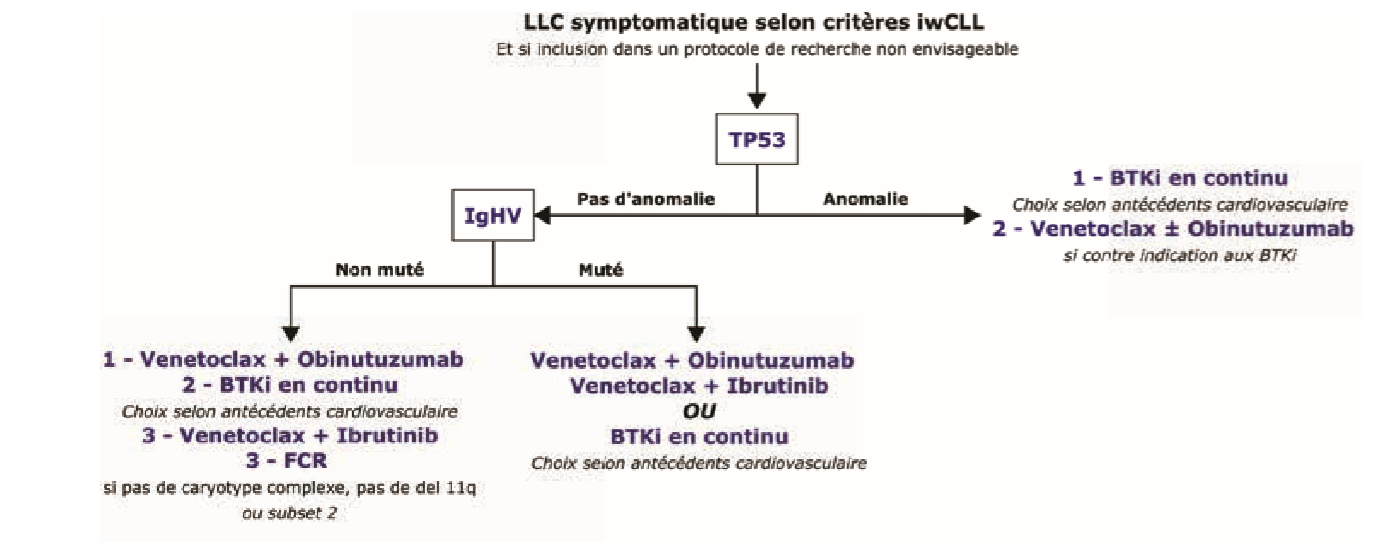
Figure 2 : Recommandations de première ligne pour la prise en charge de la LLC
Différents mécanismes de résistance de la maladie aux thérapeutiques ciblées ont émergé ces dernières années et deviennent un enjeu important lors de la prise en charge des formes réfractaires ou récidivantes.
Ces résistances impliquent 3 mécanismes principaux qui peuvent se conjuguer : une modification de la cible, un court-circuitage des voies d'activation et une action du microenvironnement tumoral (Figure 1). Les stratégies d'évitement de ces mutations sont basées sur une adaptation posologique, la rotation, le séquençage ou la combinaison des thérapeutiques, la pause thérapeutique ou l'utilisation de nouveaux traitements.
En effet, il a été montré des mutations des voies de signalisation du BCR chez des patients traités en continu par BTKi31.
La prise en charge dans le contexte de maladie réfractaire ou en rechute dépend des thérapeutiques précédemment utilisées. Il est important de différencier les patients « exposés » à une classe médicamenteuse, ayant arrêté le traitement à cause d'un effet indésirable ou de façon programmée, des patients « réfractaires » à une classe thérapeutique c'est-à-dire ayant progressé sous traitement. Les patients « double-réfractaires » aux BTKi et au Venetoclax ont un pronostic sombre et représentent actuellement, au même titre que le syndrome de Richter, le principal défi dans la prise en charge de la LLC.
Dans ces situations, un essai thérapeutique doit être privilégié afin d'accéder à de nouvelles classes thérapeutiques : inhibiteurs de BTK non covalents (pirtobrutinib), BTK-degraders, anticorps bi-spécifiques anti CD3x anti-CD20.
Idelalisib, inhibiteur de la PI3K delta dont le développement a été limité par une toxicité conséquente, n'a plus qu'une utilisation ponctuelle dans cette indication.
Les résultats des CAR-T cells anti-CD19 sont, à ce jour, décevants dans la LLC, et l'allogreffe doit être proposée aux patients.
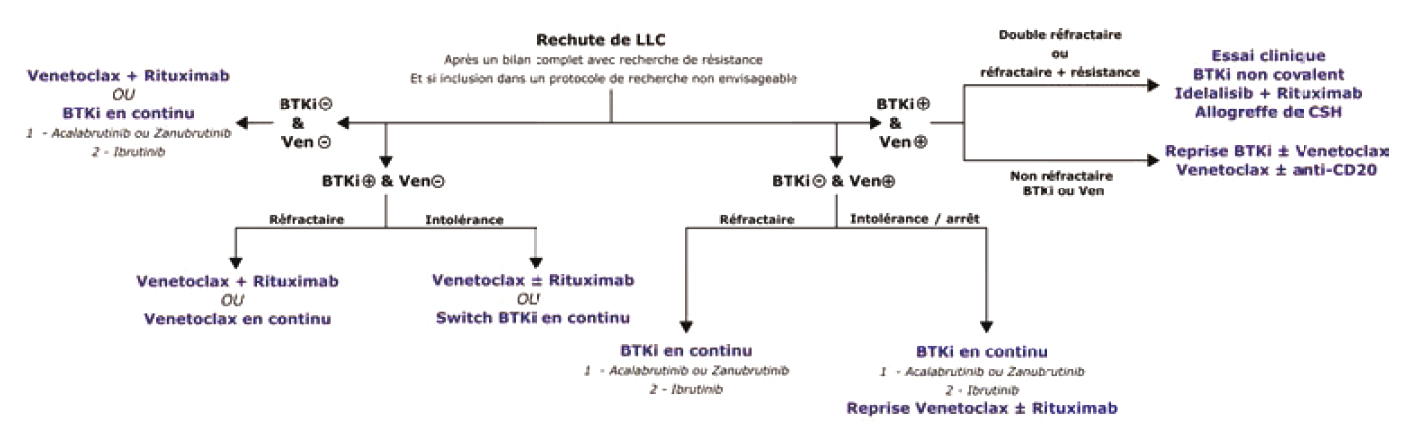
La figure 3 résume les stratégies thérapeutiques en rechute.
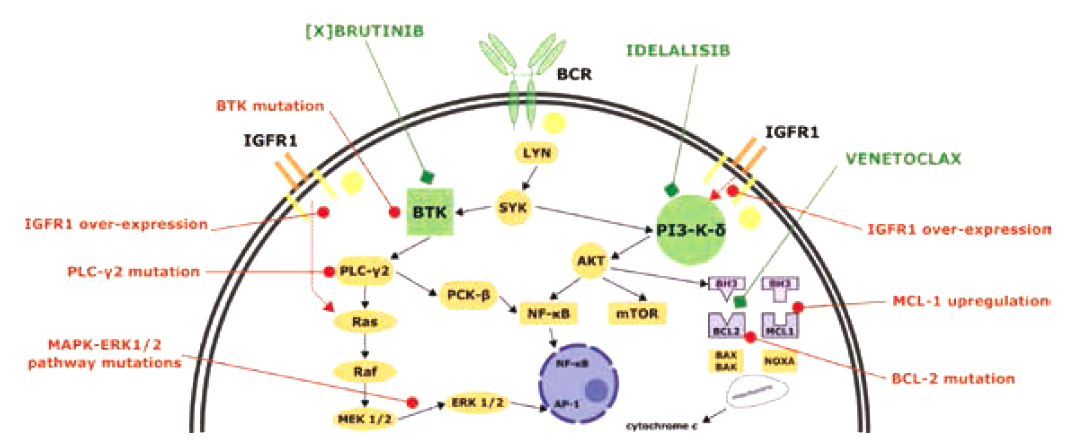
Figure 4. : Voies de signalisation cellulaire impliquées dans la LLC et dans la résistance thérapeutique. Fatima N et al., CDR, 20209.
Enfin, en absence de traitement par chimiothérapie, les patients atteints de LLC ont une prise en charge et un suivi ambulatoire qui doit être aussi complet et régulier que possible avec évaluation de leur qualité de vie pour permettre la prévention et le dépistage d'une résistance au traitement ou d'un échappement thérapeutique.
Le suivi régulier est indispensable et permet d'évaluer le risque d'évolution vers un syndrome de Richter à savoir la transformation de la LLC en lymphome B diffus à grandes cellules.
Par ailleurs, la LLC favorise la survenue d'infections notamment par l'apparition fréquente d'une hypogammaglobulinémie au cours de la maladie. La vaccination régulière est indissociable de la prise en charge et constitue un enjeu majeur de la prévention des événements infectieux.
L'hypogammaglobulinémie associée à la LLC constitue un facteur de risque majeur d'infections potentiellement graves. La vaccination régulière (pneumocoque, haemophilus, grippe, COVID) des patients est donc un enjeu important pour la prévention des événements infectieux.
Conclusion
La prise en charge thérapeutique de la LLC a été révolutionnée ces dernières années permettant de s'affranchir de la chimiothérapie et de ses effets secondaires. L'efficacité des thérapies ciblées et leur bonne tolérance clinique permettent une administration et un suivi simplifié. Cependant les résistances et les pertes d'efficacité des thérapies ciblées ainsi que la transformation en lymphome de haut grade demeurent un défi dans cette pathologie. Ces mécanismes sont directement liés à l'influence du microenvironnement tumoral et à des interactions cellulaires entraînant l'apparition de mutations génétiques et de modifications épigénétiques.

Arthur COSTE1, 2
Interne en Hématologie
CHU de Reims

Julien CLIQUOT3, 5
Interne de Biologie médicale
CHU de Reims
Relecture
Alexandre BUTELET2, 3, 4
Anne QUINQUENEL1, 2
1 Service d'onco-hématologie, Hôpital Robert Debré, CHU de Reims
2 Faculté de Médecine, Université de Reims Champagne Ardennes
3 Service d'hématologie biologique, Pôle de Biologie Territoriale, CHU de Reims
4 Centre de ressources et de compétences pour les maladies hémorragiques constitutionnelles, Filière MHEMO, CHU de Reims
5 Faculté de Pharmacie, Université de Reims Champagne Ardennes
Références
1. Al-Sawaf O, Zhang C, Tandon M, Sinha A, Fink AM, Robrecht S, et al. Venetoclax plus obinutuzumab versus chlorambucil plus
obinutuzumab for previously untreated chronic lymphocytic leukaemia (CLL14): follow-up results from a multicentre, openlabel,
randomised, phase 3 trial. The Lancet Oncology [Internet]. 2020 [cited 2024 Jul 27];21(9):1188–200.
Available from: https://linkinghub.elsevier.com/retrieve/pii/S1470204520304435
2. Binet JL, Auquier A, Dighiero G, Chastang C, Piguet H, Goasguen J, et al. A new prognostic classification of chronic lymphocytic
leukemia derived from a multivariate survival analysis. Cancer. 1981 Jul 1;48(1):198–206.
3. Burger JA. Nurture versus Nature: The Microenvironment in Chronic Lymphocytic Leukemia. Hematology [Internet]. 2011 Dec
10 [cited 2024 Jul 27];2011(1):96–103.
Available from: https://ashpublications.org/hematology/article/2011/1/96/96992/Nurture-versus-Nature-The-Microenvironment-in
4. Burger JA, Tedeschi A, Barr PM, Robak T, Owen C, Ghia P, et al. Ibrutinib as Initial Therapy for Patients with Chronic Lymphocytic
Leukemia. N Engl J Med [Internet]. 2015 Dec 17 [cited 2024 May 31];373(25):2425–37.
Available from: http://www.nejm.org/doi/10.1056/NEJMoa1509388
5. Chen ST, Azali L, Rosen L, Zhao Q, Wiczer T, Palettas M, et al. Hypertension and incident cardiovascular events after next generation
BTKi therapy initiation. J Hematol Oncol [Internet]. 2022 [cited 2024 Jun 11];15(1):92.
Available from: https://jhoonline.biomedcentral.com/articles/10.1186/s13045-022-01302-7
6. Chigrinova E, Rinaldi A, Kwee I, Rossi D, Rancoita PMV, Strefford JC, et al. Two main genetic pathways lead to the transformation
of chronic lymphocytic leukemia to Richter syndrome. Blood [Internet]. 2013 Oct 10 [cited 2024 Jul 27];122(15):2673–82.
Available from: https://ashpublications.org/blood/article/122/15/2673/31852/Two-main-genetic-pathways-lead-to-the
7. Dighiero G. Monoclonal B-Cell Lymphocytosis — Frequent Premalignant Condition. N Engl J Med [Internet]. 2008 Aug 7 [cited
2024 Jul 27];359(6):638–40. Available from: http://www.nejm.org/doi/abs/10.1056/NEJMe0804663
8. Dubois N, Crompot E, Meuleman N, Bron D, Lagneaux L, Stamatopoulos B. Importance of Crosstalk Between Chronic Lymphocytic
Leukemia Cells and the Stromal Microenvironment: Direct Contact, Soluble Factors, and Extracellular Vesicles. Front Oncol
[Internet]. 2020 Aug 19 [cited 2024 Jul 27];10:1422. Available from: https://www.frontiersin.org/article/10.3389/fonc.2020.01422/full
9. Fatima N, Crassini KR, Thurgood L, Shen Y, Christopherson RI, Kuss B, et al. Therapeutic approaches and drug-resistance in
chronic lymphocytic leukaemia. CDR [Internet]. 2020 [cited 2024 Jun 1].
Available from: https://www.oaepublish.com/articles/cdr.2019.111
10. Hamblin TJ, Davis Z, Gardiner A, Oscier DG, Stevenson FK. Unmutated Ig V(H) genes are associated with a more aggressive
form of chronic lymphocytic leukemia. Blood. 1999 Sep 15;94(6):1848–54.
11. Knisbacher BA, Lin Z, Hahn CK, Nadeu F, Duran-Ferrer M, Stevenson KE, et al. Molecular map of chronic lymphocytic leukemia
and its impact on outcome. Nat Genet [Internet]. 2022 [cited 2024 Jul 27];54(11):1664–74.
Available from: https://www.nature.com/articles/s41588-022-01140-w
12. Kretzmer H, Biran A, Purroy N, Lemvigh CK, Clement K, Gruber M, et al. Preneoplastic Alterations Define CLL DNA Methylome and
Persist through Disease Progression and Therapy. Blood Cancer Discovery [Internet]. 2021 Jan 1 [cited 2024 Jul 27];2(1):54–69.
Available from: https://aacrjournals.org/bloodcancerdiscov/article/2/1/54/35203/Preneoplastic-Alterations-Define-CLL-DNAMethylome
13. Kulis M, Heath S, Bibikova M, Queirós AC, Navarro A, Clot G, et al. Epigenomic analysis detects widespread gene-body DNA
hypomethylation in chronic lymphocytic leukemia. Nat Genet [Internet]. 2012 [cited 2024 Jul 27];44(11):1236–42.
Available from: https://www.nature.com/articles/ng.2443
14. Kulis M, Merkel A, Heath S, Queirós AC, Schuyler RP, Castellano G, et al. Whole-genome fingerprint of the DNA methylome
during human B cell differentiation. Nat Genet [Internet]. 2015 [cited 2024 July 27];47(7):746–56.
Available from: https://www.nature.com/articles/ng.3291
15. Landau DA, Tausch E, Taylor-Weiner AN, Stewart C, Reiter JG, Bahlo J, et al. Mutations driving CLL and their evolution in
progression and relapse. Nature [Internet]. 2015 [cited 2024 July 23];526(7574):525–30.
Available from: https://www.nature.com/articles/nature15395
16. Marionneaux SM, Keohane EM, Lamanna N, King TC, Mehta SR. Smudge Cells in Chronic Lymphocytic Leukemia: Pathophysiology,
Laboratory Considerations, and Clinical Significance. Laboratory Medicine [Internet]. 2021 Sep 1 [cited 2024 July 27];52(5):426 38.
Available from: https://academic.oup.com/labmed/article/52/5/426/6126033
17. Martin-Subero JI, Oakes CC. Charting the dynamic epigenome during B-cell development. Seminars in Cancer Biology
[Internet]. 2018 [cited 2024 July 27];51:139–48. Available from: https://linkinghub.elsevier.com/retrieve/pii/S1044579X17301773
18. Mato AR, Woyach JA, Brown JR, Ghia P, Patel K, Eyre TA, et al. Pirtobrutinib after a Covalent BTK Inhibitor in Chronic Lymphocytic
Leukemia. N Engl J Med [Internet]. 2023 Jul 6 [cited 2024 May 31];389(1):33–44.
Available from: http://www.nejm.org/doi/10.1056/NEJMoa2300696
19. Matutes E, Owusu-Ankomah K, Morilla R, Garcia Marco J, Houlihan A, Que TH, et al. The immunological profile of B-cell disorders
and proposal of a scoring system for the diagnosis of CLL. Leukemia. 1994 Oct;8(10):1640–5.
20. Mössner E, Brünker P, Moser S, Püntener U, Schmidt C, Herter S, et al. Increasing the efficacy of CD20 antibody therapy
through the engineering of a new type II anti-CD20 antibody with enhanced direct and immune effector cell–mediated B-cell
cytotoxicity. Blood [Internet]. 2010 Jun 3 [cited 2024 May 28];115(22):4393–402.
Available from: https://ashpublications.org/blood/article/115/22/4393/27384/Increasing-the-efficacy-of-CD20-antibody-therapy
21. Munir T, Brown JR, O'Brien S, Barrientos JC, Barr PM, Reddy NM, et al. Final analysis from RESONATE: Up to six years of follow-up
on ibrutinib in patients with previously treated chronic lymphocytic leukemia or small lymphocytic lymphoma. American J
Hematol [Internet]. 2019 [cited 2024 May 28];94(12):1353–63. Available from: https://onlinelibrary.wiley.com/doi/10.1002/ajh.25638
22. Nasnas P, Cerchione C, Musuraca G, Martinelli G, Ferrajoli A. How I Manage Chronic Lymphocytic Leukemia. Hematology
Reports [Internet]. 2023 Aug 1 [cited 2024 May 31];15(3):454–64. Available from: https://www.mdpi.com/2038-8330/15/3/47
23. Ng A, Chiorazzi N. Potential Relevance of B-cell Maturation Pathways in Defining the Cell(s) of Origin for Chronic Lymphocytic
Leukemia. Hematology/Oncology Clinics of North America [Internet]. 2021 [cited 2024 Jul 27];35(4):665–85. Available from:
https://linkinghub.elsevier.com/retrieve/pii/S0889858821000344
24. 24. Palma M, Mulder TA, Österborg A. BTK Inhibitors in Chronic Lymphocytic Leukemia: Biological Activity and Immune Effects.
Front Immunol [Internet]. 2021 Jul 1 [cited 2024 May 31];12:686768.
Available from: https://www.frontiersin.org/articles/10.3389/fimmu.2021.686768/full
25. Quinquenel A, Aurran-Schleinitz T, Clavert A, Cymbalista F, Dartigeas C, Davi F, et al. Diagnosis and Treatment of Chronic
Lymphocytic Leukemia: Recommendations of the French CLL Study Group (FILO). HemaSphere [Internet]. 2020 [cited 2024
May 25];4(5):e473. Available from: https://onlinelibrary.wiley.com/doi/10.1097/HS9.0000000000000473
26. Rawstron AC, Kreuzer K, Soosapilla A, Spacek M, Stehlikova O, Gambell P, et al. Reproducible diagnosis of chronic lymphocytic
leukemia by flow cytometry: An European Research Initiative on CLL (ERIC) & European Society for Clinical Cell Analysis
(ESCCA) Harmonisation project. Cytometry Part B Clinical [Internet]. 2018 [cited 2024 Jul 27];94(1):121–8. Available from:
https://onlinelibrary.wiley.com/doi/10.1002/cyto.b.21595
27. Sharman JP, Egyed M, Jurczak W, Skarbnik A, Pagel JM, Flinn IW, et al. Efficacy and safety in a 4-year follow-up of the ELEVATETN
study comparing acalabrutinib with or without obinutuzumab versus obinutuzumab plus chlorambucil in treatment-naïve
chronic lymphocytic leukemia. Leukemia [Internet]. 2022 [cited 2024 May 28];36(4):1171–5.
Available from: https://www.nature.com/articles/s41375-021-01485-x
28. Tam CS, Brown JR, Kahl BS, Ghia P, Giannopoulos K, Jurczak W, et al. Zanubrutinib versus bendamustine and rituximab in
untreated chronic lymphocytic leukaemia and small lymphocytic lymphoma (SEQUOIA): a randomised, controlled, phase 3
trial. The Lancet Oncology [Internet]. 2022 [cited 2024 Jul 27];23(8):1031–43.
Available from: https://linkinghub.elsevier.com/retrieve/pii/S1470204522002935
29. Tejaswi V, Lad DP, Jindal N, Prakash G, Malhotra P, Khadwal A, et al. Chronic Lymphocytic Leukemia: Real-World Data From
India. JCO Global Oncology [Internet]. 2020 [cited 2024 Jul 23];(6):866–72. Available from: https://ascopubs.org/doi/10.1200/
GO.20.00032
30. Winkler U, Jensen M, Manzke O, Schulz H, Diehl V, Engert A. Cytokine-release syndrome in patients with B-cell chronic lymphocytic
leukemia and high lymphocyte counts after treatment with an anti-CD20 monoclonal antibody (rituximab, IDEC-C2B8). Blood.
1999 Oct 1;94(7):2217–24.
31. Woyach JA, Ghia P, Byrd JC, Ahn IE, Moreno C, O'Brien SM, et al. B-cell Receptor Pathway Mutations Are Infrequent in Patients
with Chronic Lymphocytic Leukemia on Continuous Ibrutinib Therapy. Clinical Cancer Research [Internet]. 2023 Aug 15 [cited
2024 Jun 11];29(16):3065–73.
Available from: https://aacrjournals.org/clincancerres/article/29/16/3065/728234/B-cell-Receptor-Pathway-Mutations-Are-Infrequent

