Articles présentés
Abramson JS, Ku M, Hertzberg M, et al. Glofi tamab plus gemcitabine and oxaliplatin (GemOx) versus rituximab-GemOx for relapsed or refractory diffuse large B-cell lymphoma (STARGLO): a global phase 3, randomised, open-label trial. Lancet. 2024 Nov 16;404(10466):1940-1954.
Brody JD, Jørgensen J, Belada D et al. Epcoritamab plus GemOx in transplantineligible relapsed/refractory DLBCL: results from the EPCORE NHL-2 trial. Blood. 2025 Apr 10;145(15):1621-1631.
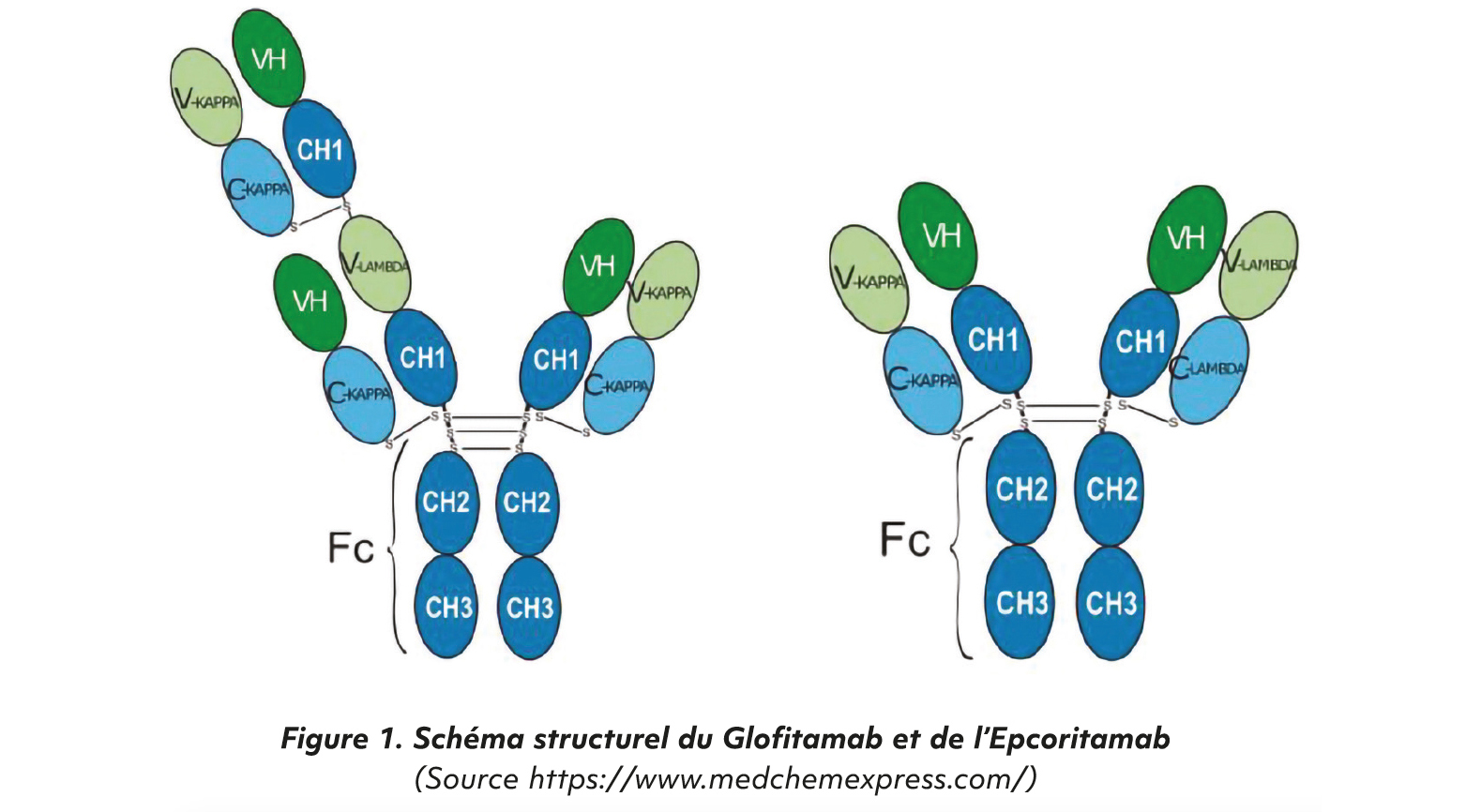
Les lymphomes B diffus à grandes cellules (LBDGC) sont la forme la plus fréquente de lymphome non hodgkinien de l'adulte. Dans 40 % des cas la maladie sera réfractaire ou rechutera rapidement après le traitement de première ligne basé sur l'immunochimiothérapie par Rituximab, Cyclophosphamide, Doxorubicine, Vincristine et corticoïdes (R-CHOP). Près de 60 % des patients ne répondront également pas à la chimiothérapie de sauvetage de seconde ligne et nécessiteront une intensification thérapeutique avec autogreffe de cellules souches. Le pronostic dans ces cas et chez des patients inéligibles à une intensification thérapeutique reste mauvais [1]. La thérapie cellulaire par CAR-T cells est devenue un standard de traitement en seconde ligne chez ces patients réfractaires ou en rechute. Cependant, la disponibilité de ce traitement innovant n'est pas identique partout dans le monde. Le Glofitamab et l'Epcoritamab sont des anticorps bispécifiques CD20x- CD3 engageant les lymphocytes T (BiTEs). Ils sont indiqués en traitement des LBDGC après au moins 2 lignes thérapeutiques.
Les résultats de l'étude internationale de phase III, STARGLO, randomisée et en ouvert, ont récemment été publiés dans le Lancet. Ils présentent l'assignation en 2:1 de l'utilisation du Glofitamab en comparaison au Rituximab associé à de la chimiothérapie par Gemcitabine et Oxaliplatine (GemOx) largement utilisée pour des patients avec un LBDGC en rechute ou réfractaire. Les patients avec des lymphomes indolents transformés, les lymphomes doubles ou triples mutés (MYC, BCL2 ou BCL6) ou de haut grade étaient exclus de l'étude. Les patients devaient être inéligibles à une intensification thérapeutique avec autogreffe.
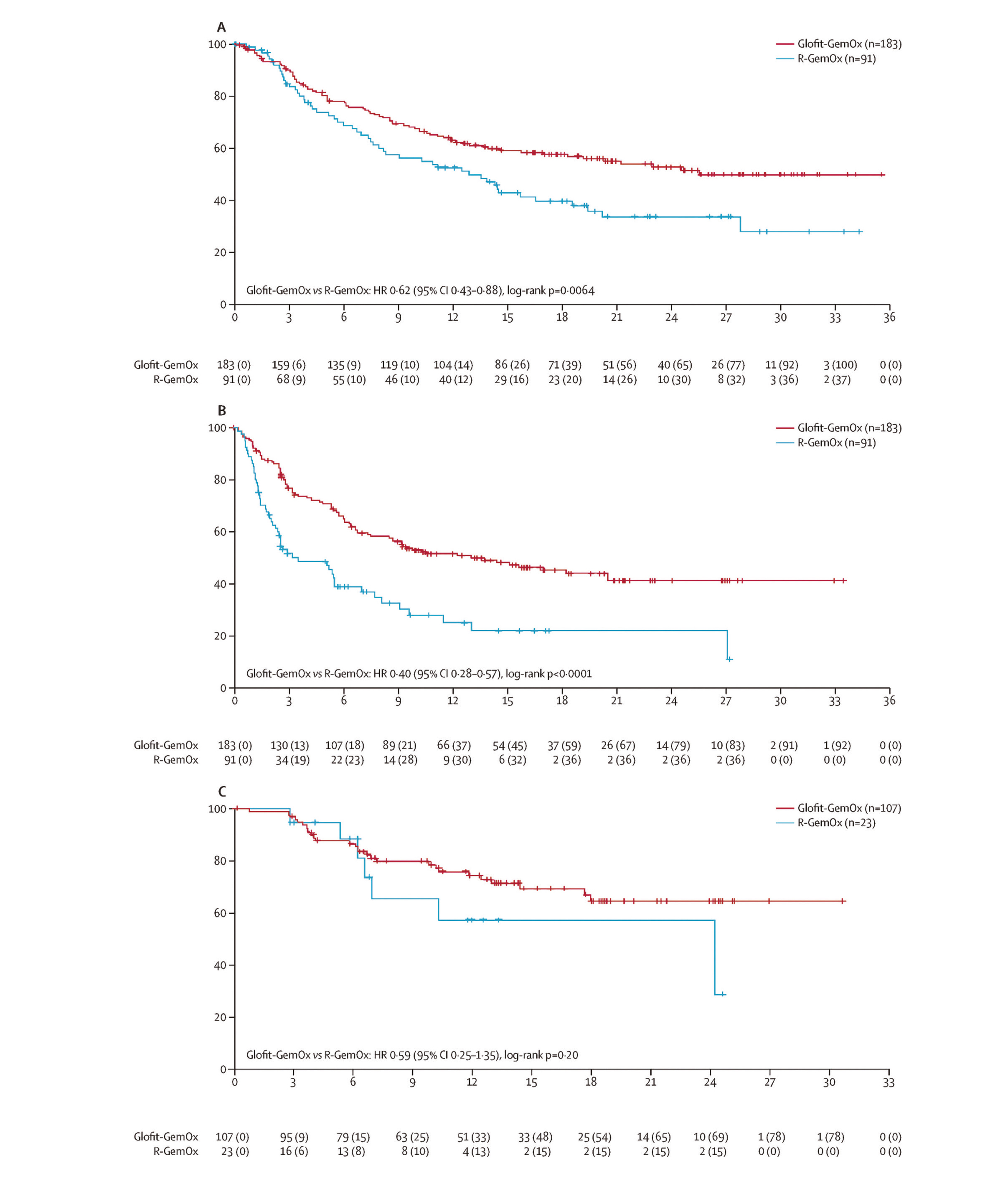
Figure 2. Courbes de survie globale, de survie sans progression et de durée de la réponse globale de l'étude STARGLO
Adapté de Abramson JS. et al. Lancet. 2024
L'étude a été réalisée en ouvert avec stratification sur le nombre de lignes antérieures (1 vs supérieur à 1). La chimiothérapie par GemOx contenait 1000 mg/m² de Gemcitabine et 100 mg/m² d'Oxaliplatine administrée à J2 du cycle 1 puis à J1 des 7 cycles suivants. Le Rituximab à 375 mg/m² était administré au J1 des 8 cycles et le Glofitamab a été administré pour 12 cycles.
Le critère de jugement principal de l'étude était la survie globale (SG). La survie sans progression (SSP), le taux de réponse complète (TRC) et la durée de réponse complète (DRC) ont été évalués comme critères secondaires. Un nombre minimal de 270 patients a été calculé pour fournir une puissance de 80 % pour détecter une différence de survie globale médiane de 7,3 mois soit une réduction du risque de 40 %.
Entre février 2021 et mars 2023, 274 patients ont été randomisés dans 62 hôpitaux de 13 pays dont 183 dans le bras Glo-GemOx et 91 dans le bras R-GemOx. Les caractéristiques des patients, notamment démographiques, étaient similaires entre les deux groupes. La majorité des patients étaient de stade III ou IV, non bulky et de phénotype non-CG. Ils avaient reçu le plus souvent une seule ligne de traitement préalable, un nombre minoritaire (inférieure à 10 %) de patients avaient reçu un traitement par CAR-T cells ou intensification thérapeutique avec autogreffe. La majorité des patients étaient réfractaires à toutes les lignes précédentes, notamment aux anticorps anti-CD20. Cent six patients du bras Glo-GemOx et 65 patients du bras R- GemOx ont arrêté le traitement dont 41 et 38 respectivement dans les deux groupes pour progression de la maladie.
Après un suivi médian de 11,3 mois la SG était de non atteinte ([13.8- NA]) dans le bras Glo-GemOx contre 9,0 [7,3-14,4] mois dans le groupe R-GemOx soit un HR à 0,59 ([0,4-0,89], p=0.011) en faveur du Glofitamab. La SSP était de 3,3 [2,5- 5,6] mois dans le bras R-GemOx contre 12,1 [6,8-18,3] mois dans le bras Glo-GemOx. Ces résultats ont été confirmés dans une mise à jour de l'étude après un suivi médian de 20,7 mois toujours très favorable au Glo-GemOx en SG : HR=0,62 [0,43- 0,88] et en SSP : HR=0,4 [0,28-0,57].
La totalité des patients du bras Glo-GemOx et 96 % des patients du bras R-GemOx ont eu au moins un effet secondaire dont 54 % et 17 % respectivement un effet secondaire grave avec 78 % et 41 % de grade supérieur à 3 et 27 % et 13 % qui ont entraîné une interruption thérapeutique. Le syndrome de relargage cytokinique (SRC) a eu lieu chez 44 % des patients du bras Glo-GemOx dont la majorité de grade I, avec 4 patients (2 %) présentant un CRS de grade III. Une toxicité neurologique a été observée chez 2 % des patients du bras Glo-GemOx concomitamment résolutif avec le SRC. Le SARS-CoV-2 était la cause principale d'infection chez 18 % des patients du bras Glo-GemOx ayant entraîné le décès chez 7 patients et 9 % dans le bras R-GemOx sans décès rapporté.
En somme, l'association Glo-GemOx présente une efficacité significative chez des patients réfractaires ou en rechute à une première ligne de traitement et inéligible à une intensification. Cependant, l'exclusion de patients avec double ou triple hit de l'étude limite un peu sa généralisation. Il serait intéressant de comparer directement les bispécifiques avec les CAR-T cells avec un suivi prolongé dans cette indication.
Une étude similaire avec un autre anticorps bispécifique a également été réalisée au cours de la même période témoignant d'un intérêt pour cette association. L'étude multicentrique de phase I/II EPCORE a inclus 103 patients entre janvier 2021 et décembre 2023. Les patients présentaient les mêmes critères d'inclusion que dans STARGLO et ont été traités par l'association Epcoritamab et GemOx. Ils devaient être inéligibles à l'intensification thérapeutique avec autogreffe, ou pouvaient être double ou triple hits, ou être des lymphomes folliculaires de grade III. Cependant, la médiane d'âge des patients inclus était de 72 ans dans EPCORE contre 68 ans dans l'essai STARGLO, avec 35 % de patients âgés de plus de 75 ans.
Les patients inclus dans EPCORE avaient une médiane de 2 lignes de traitement antérieurs contre 1 dans STARGLO. Le critère de jugement principal était la réponse globale évaluée selon les critères de Lugano.
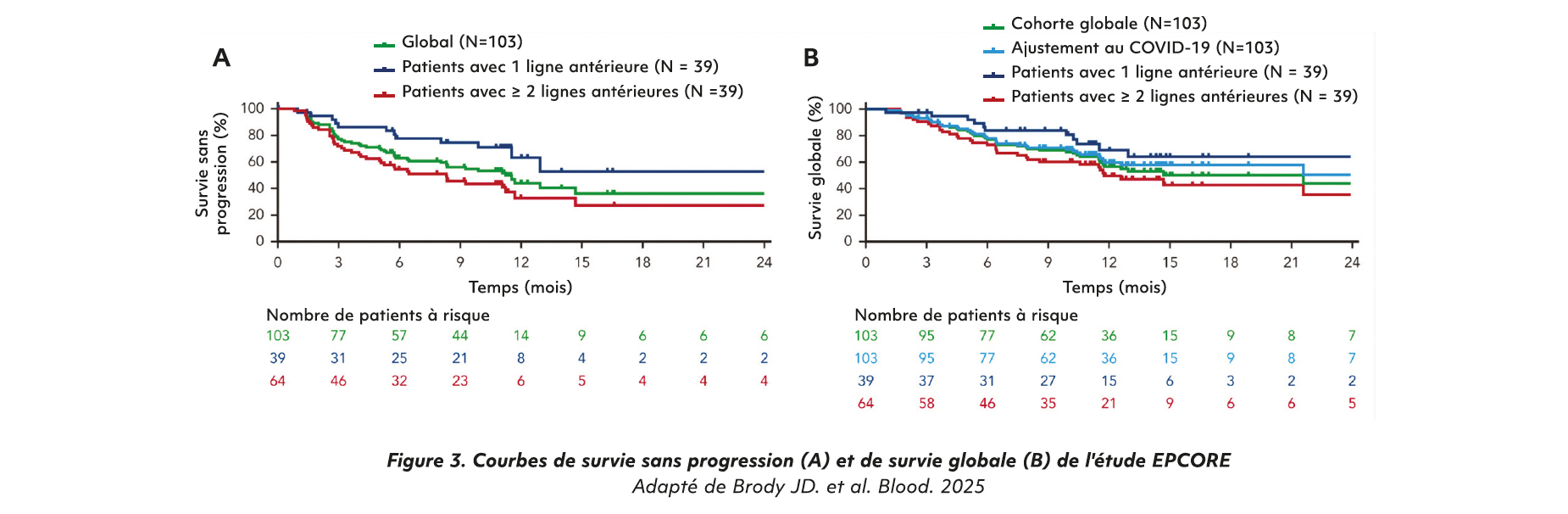
Après un suivi médian de 13,2 mois, 61 % des patients avaient obtenu une réponse complète avec une SSP dans ce groupe de 26,7 [11,7-NA] mois contre 11,2 [9-14,7] mois dans la population globale de l'étude. La médiane de survie globale était de 21,6 mois dans la population globale et non atteinte dans la population en réponse complète.
Les effets secondaires les plus fréquents étaient la toxicité hématologique, les infections et le SRC avec notamment 73 % de thrombopénies, 65 % de neutropénies et 59 % d'anémie dont la majorité des cytopénies de grade III ou plus, 72 % d'infections dont 30 % de grade III ou plus et 52 % de SRC dont 1 % de grade III ou plus. La toxicité neurologique des bispécifiques a été rapportée chez 3 patients, résolutive et entraînant un arrêt de traitement chez un patient avec une forme sévère de grade III. Un arrêt du traitement pour toxicité a eu lieu chez 36 patients dont 30 pour toxicité sévère. Les infections à SARS-CoV-2 ont concerné 30 patients (29 %) dont 11 avec des formes sévères.
En somme, les résultats d'EPCORE sont similaires à ceux de STARGLO mais ils s'intéressent à une population plus complexe avec des patients plus âgés, plus traités notamment par CAR-T cells (28 % contre 7 %) et avec des maladies de haut risque. On regrettera cependant l'absence d'un bras comparateur et une étude de phase III serait donc intéressante avec idéalement une comparaison à une thérapie similaire.
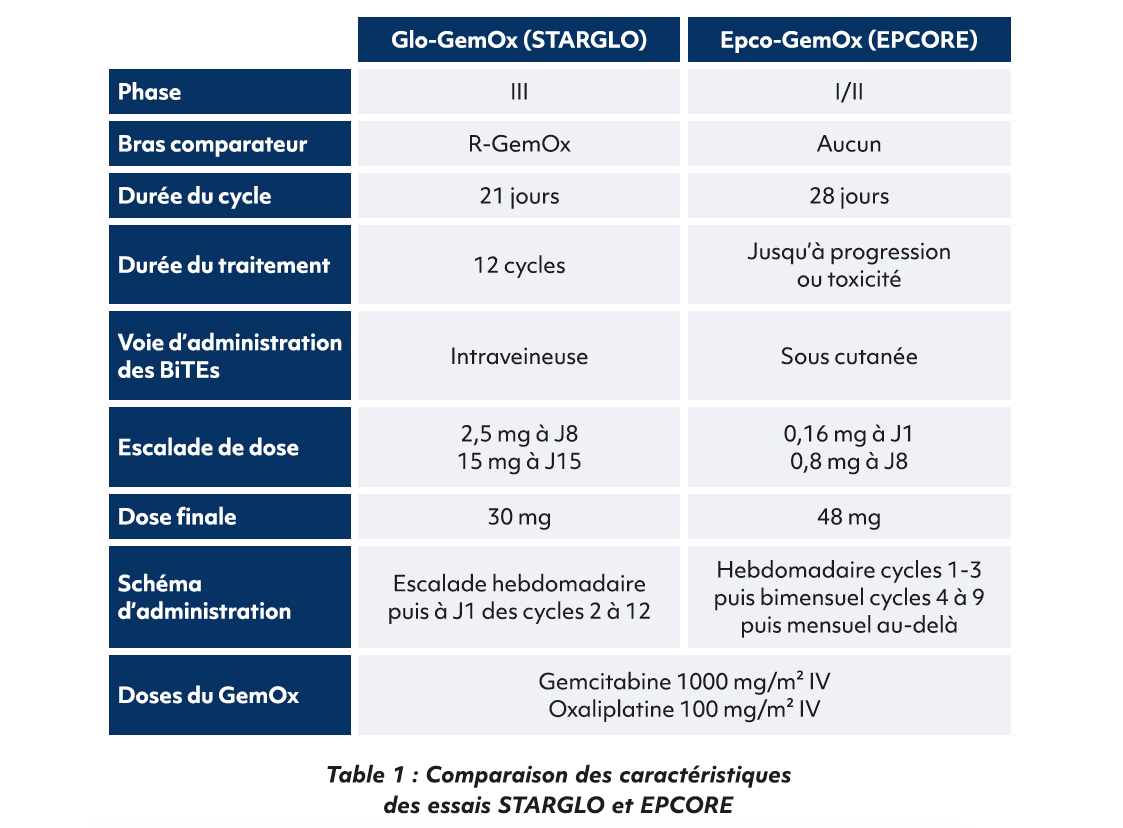
En conclusion, ces deux études sont les premières à évaluer l'utilisation conjointe des anticorps bispécifiques en association avec la chimiothérapie dans les LBDGC en rechute ou réfractaire (Table 1). Elles tendent à montrer un intérêt notable tant en efficacité avec des rémissions durables et un bon taux de réponse, qu'en toxicité qui reste acceptable chez des patients de haut risque, âgés et non éligibles à une intensification thérapeutique avec autogreffe. Cependant avec l'émergence des CAR-T cells et leur positionnement en seconde ligne, une comparaison directe pourrait avoir son sens pour bien positionner et séquencer les traitements dans l'arsenal thérapeutique.
Référence
1. Pennings, E.R.A., Durmaz, M., Visser, O. et al. Treatment and outcomes for patients with relapsed or refractory diffuse large B-cell lymphoma: a contemporary, nationwide, population-based study in the Netherlands. Blood Cancer J. 14, 3 (2024). https://doi.org/10.1038/s41408-023-00970-z

Arthur COSTE
Interne en Hématologie
AP-HP Pitié Salpêtrière
& CHU de Reims

