L'anatomopathologie est une spécialité médicale méconnue de la majorité des médecins, hématologues compris. Pourtant, elle constitue la pierre angulaire de notre prise en charge. Tout particulièrement dans les pathologies lymphomateuses, le choix du traitement repose directement sur l'identification précise du type ou sous-type de lymphome. Il n'est donc pas rare qu'un décalage se crée entre le clinicien, en attente d'un résultat, et le pathologiste, qui peine à conclure fermement à un diagnostic en raison de divers facteurs que nous allons explorer.
Un patient de 45 ans se présente en consultation chez son médecin traitant pour une altération de l'état général. Celui-ci lui prescrit un scanner, qui met en évidence un nodule pulmonaire, ainsi que des adénopathies et des lésions osseuses. Dans l'hypothèse d'une néoplasie pulmonaire, une microbiopsie est réalisée lors d'une fibroscopie bronchique. Celle-ci retrouve une prolifération lymphocytaire évocatrice de lymphome mais ne permet pas de poser formellement un diagnostic, en raison de sa très petite taille. Hématologue, vous recevez en consultation ce patient pour décider de la suite de la prise en charge. Afin de confirmer votre suspicion clinique, il est nécessaire d'obtenir une nouvelle preuve histologique. Au-delà de l'accessibilité, le choix de la cible doit passer par la réalisation d'un PET scanner, afin d'analyser un ganglion le plus hypermétabolique possible, pour ne pas manquer le lymphome le plus agressif (Figure 1).
De plus, la taille du prélèvement revêt une importance capitale : il est fréquent qu'un diagnostic soit incertain, voire impossible en raison d'un prélèvement de petite taille (Figure 2).
Une exérèse ganglionnaire sera toujours préférable à une biopsie, de façon encore plus marquée de nos jours, où le manque de matériel peut limiter la réalisation de techniques de pointe.
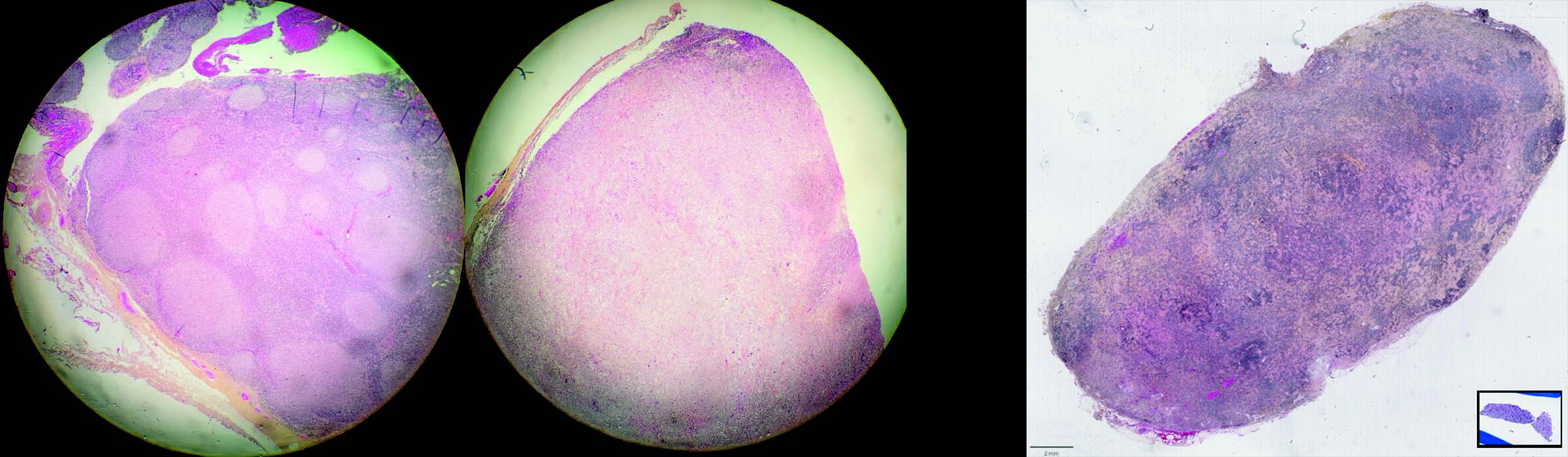
Figure 1 HES – Prélèvement du ganglion le plus hypermétabolique. Patient présentant une polyadénopathie. L'exérèse de deux ganglions cervicaux a montré un lymphome folliculaire dans l'un (gauche), et transformé en lymphome diffus dans l'autre (droite).
Figure 2 HPS – Taille prélèvement - Exérèse ganglionnaire (gauche) et microbiopsie ganglionnaire (encadré noir) à échelle équivalente
Le PET-TDM retrouve une SUV importante au niveau pulmonaire, et plus faible dans les cibles ganglionnaires (Figure 3). Votre patient bénéficie d'une exérèse d'un ganglion cervical. Ce prélèvement est envoyé au laboratoire d'anatomopathologie, où, si sa taille le permet, sera partiellement congelé et le reste fixé en formol. Bien qu'on puisse réaliser la quasi-totalité des techniques sur du tissu fixé (FISH, panel NGS), les tissus congelés sont préférés pour garantir une qualité optimale grâce à une moindre dégradation des acides nucléiques.
Après une fixation d'une durée minimale de 24h, ce ganglion sera examiné macroscopiquement, puis mis en cassette, afin d'être inclus en paraffine. En cas de prélèvement
osseux, comme la BOM, une étape supplémentaire de décalcification dans une solution acide (EDTA, acide chlorhydrique), d'une durée de 24 à 48 heures est nécessaire. L'inclusion en paraffine permettra sa conservation, et la réalisation de coupes fines pour apposition sur lames et étude microscopique, après coloration ou réalisation de techniques d'immunohistochimie.
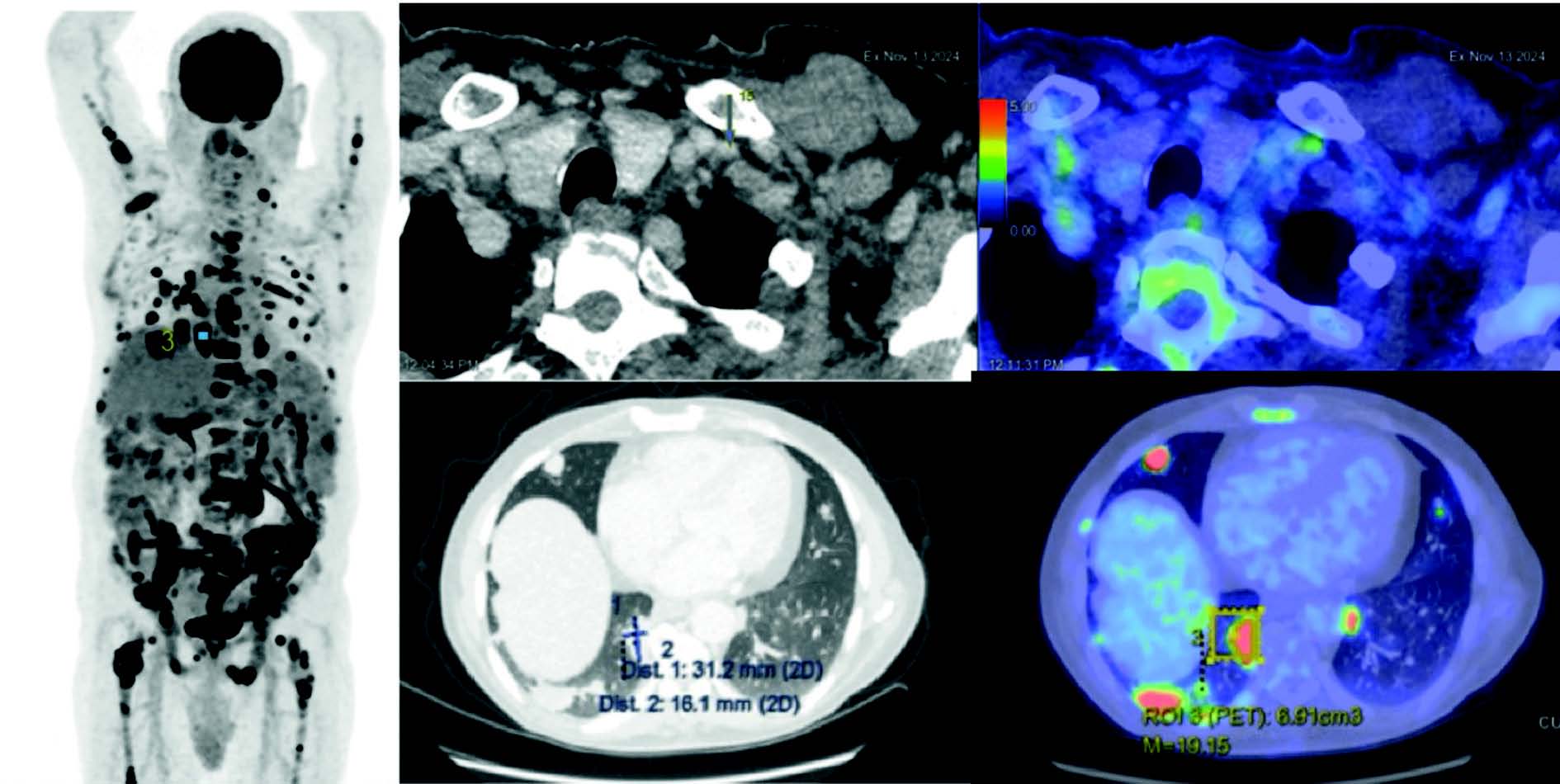
Figure 3 PET-TDM du patient de consultation
À présent, les lames de votre patient sont sous les yeux d'un pathologiste. Les éléments menant au diagnostic sont, parmi d'autres, l'architecture ganglionnaire (Figure 4), la taille et la morphologie des cellules (Figure 5), la composition du micro-environnement (Figure 6).
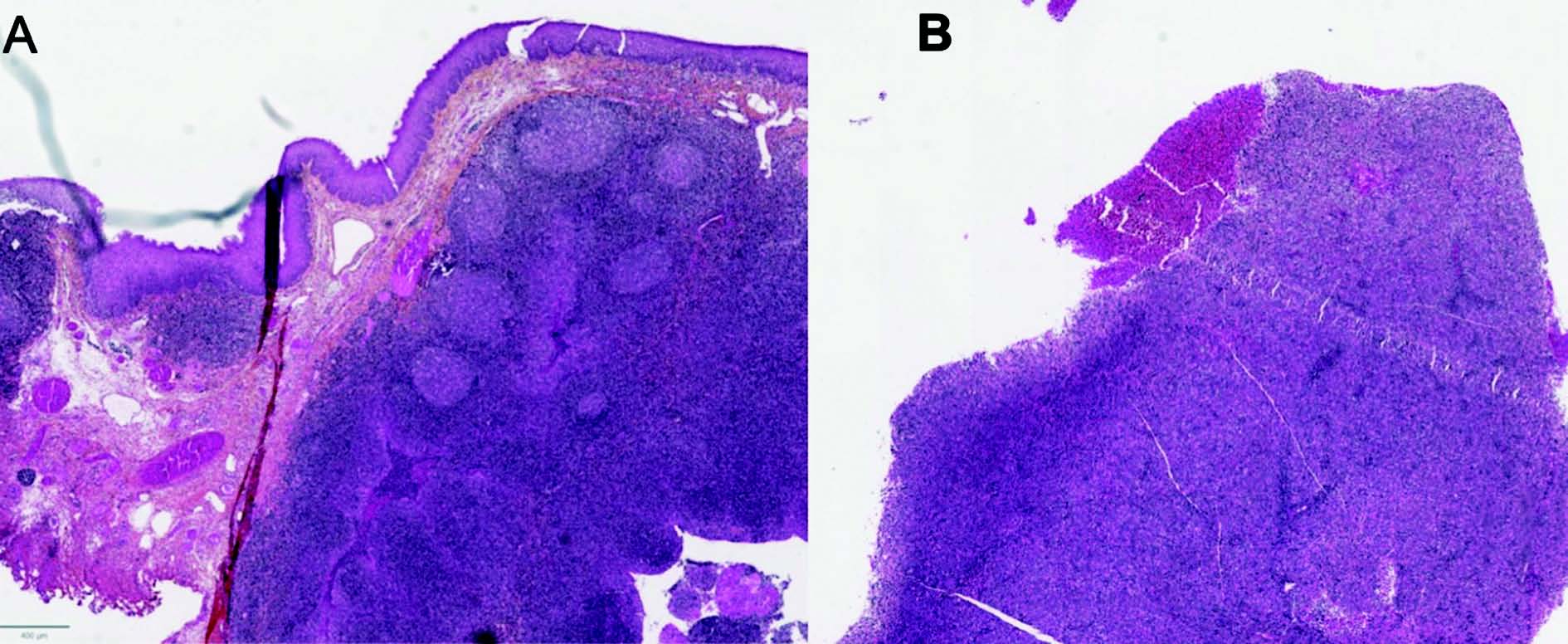
Figure 4 HPS - Architecture - A. Amygdalite réactionnelle non tumorale, d'architecture nodulaire ; B. Ganglion envahi par un lymphome diffus à grandes cellules B, d'architecture diffuse.
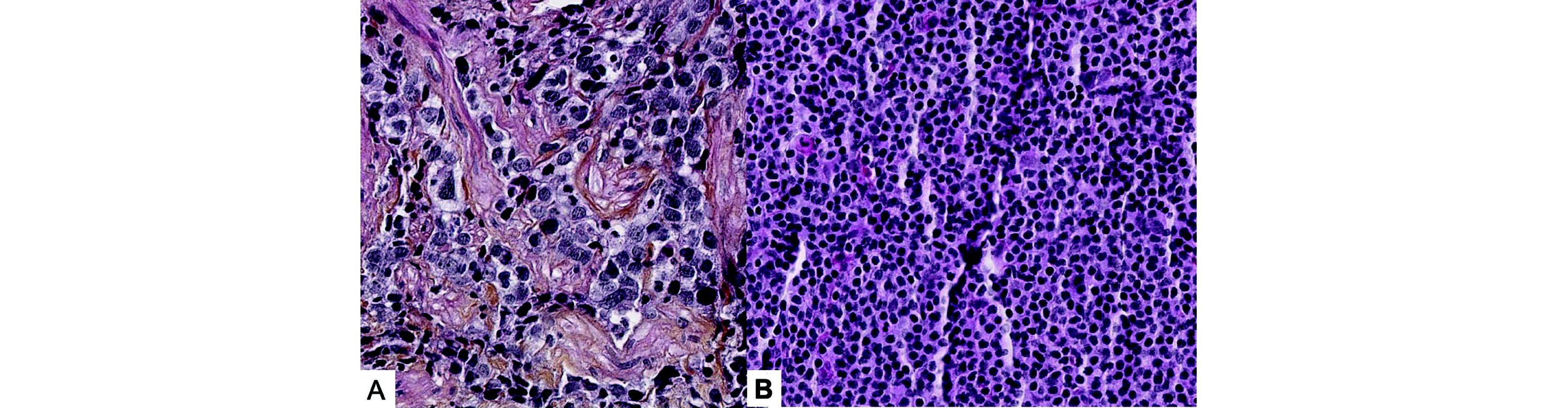
Figure 5 HPS - Taille des cellules - A. Lymphome diffus à grandes cellules B, cellules de grande taille ; B. Lymphome de la zone marginale, cellules de petite taille
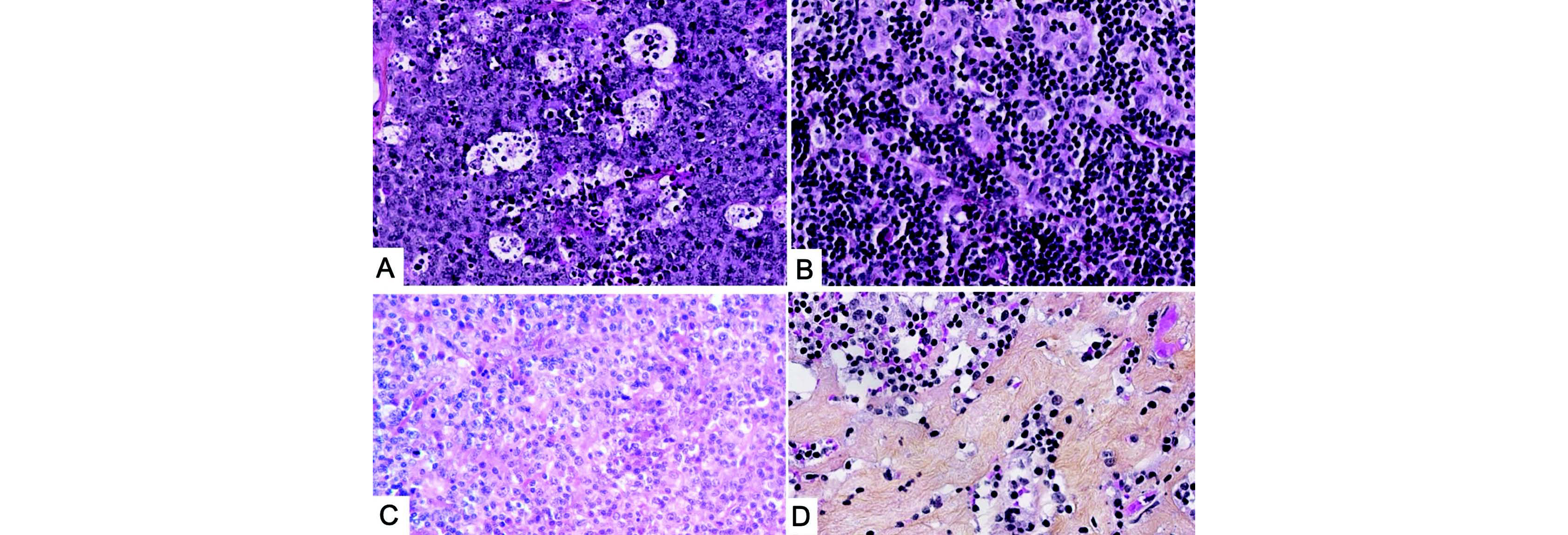
Figure 6 HPS - Microenvironnement - A. LDGCB avec nombreux macrophages (flèches épaisses) ; B. Lymphome de Hodgkin classique riche en lymphocytes, avec cellules de Reed Sternberg (étoile) et environnement lymphocytaire ; C. Lymphome T angio-immunoblastique avec nombreux éosinophiles (flèches fines) ; D. Lymphome de Hodgkin nodulaire à prédominance lymphocytaire avec fibrose importante
Votre patient présente une prolifération lymphomateuse d'architecture nodulaire, constituée d'une majorité de cellules de petite taille, avec certaines cellules de plus grande taille. Le pathologiste complète sa première orientation diagnostique par des techniques d'immunohistochimie. Celles-ci permettent d'étudier chaque population et fournissent diverses informations, telles que l'expression aberrante d'un marqueur (comme l'expression du CD5 par les lymphocytes B dans le lymphome lymphocytique), une perte antigénique (telle que perte d'expression du CD5 ou CD7 dans les lymphomes T périphériques NOS), ou une répartition anormale des cellules dans le tissu. L'immunohistochimie permet également de quantifier l'expression de certains antigènes pour établir le pronostic du lymphome : l'expression de Bcl2, de C-Myc et de p53 pour les lymphomes diffus à grandes cellules B, ou l'index de prolifération estimé par le Ki67 dans les lymphomes du manteau. Cependant, l'évaluation de ces marqueurs peut s'avérer complexe et comporte une part de subjectivité.
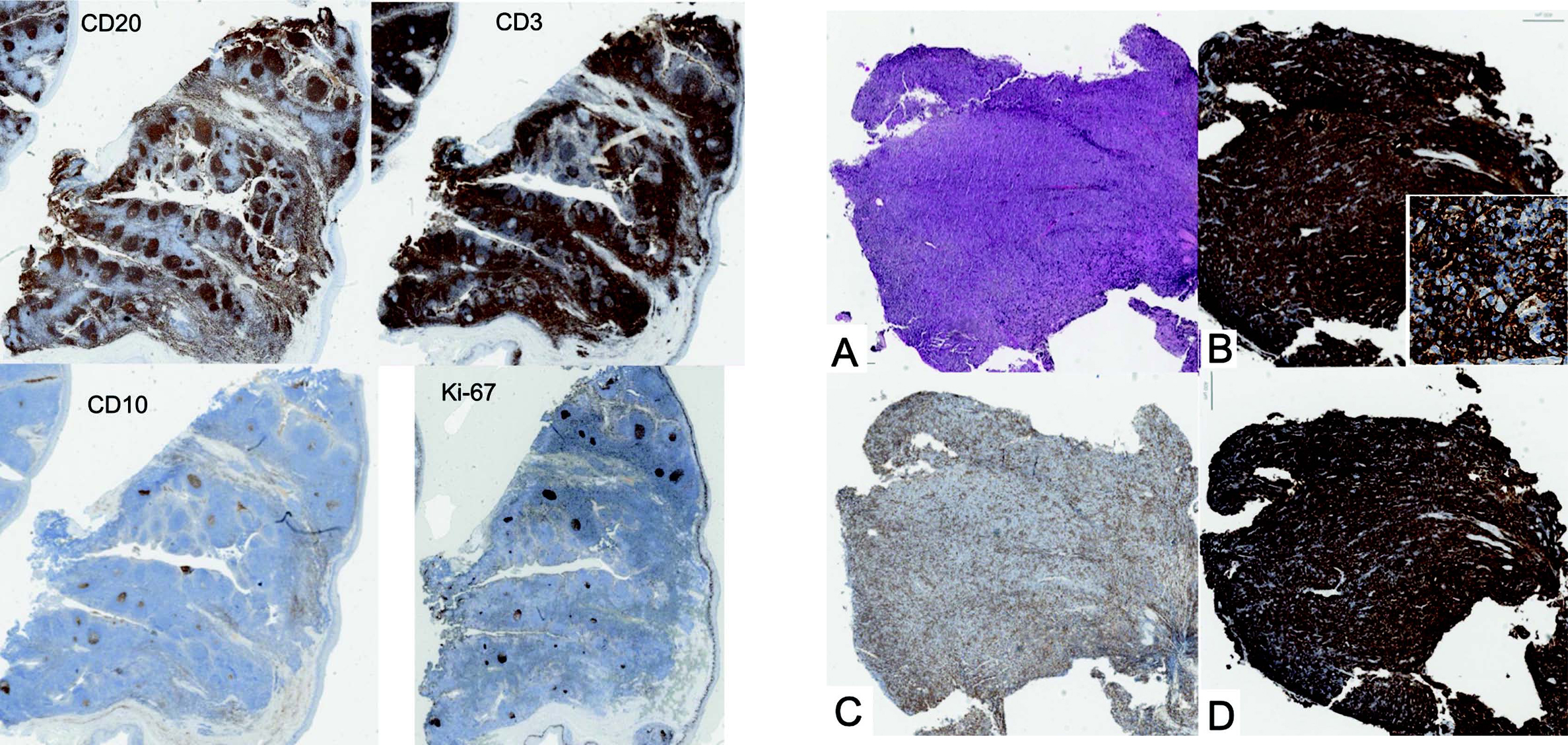
Figure 7 Figure 8
Figure 7 Immunohistochimie d'une amygdalite réactionnelle, non tumorale, avec une répartition physiologique des populations. Lymphocytes B présents en majorité dans les follicules, tandis que les lymphocytes T dans les zones interfolliculaires. Le CD10 souligne les LB des centres germinatifs.
Figure 8 DLBCL ; A. HPS – Présence d'une architecture diffuse ; B. CD20 - Au faible et fort grossissement, marquant l'ensemble de l'infiltrat lymphomateux ; C. CD3 - Marquant les lymphocytes T du microenvironnement ; D. Bcl2 - Retrouvant une surexpression de Bcl2 par le lymphome.
Avec l'ensemble de ces données, le médecin pathologiste pose le diagnostic de lymphome de Hodgkin nodulaire à prédominance lymphocytaire (NLPHL), ou lymphome de Poppema. Il transmet alors ce cas à un laboratoire du réseau Lymphopath, afin de bénéficier d'une relecture. Cette démarche mène à la reclassification du lymphome dans environ 20 % des cas1 , grâce à une expertise dans les cas rares, et l'accès à des techniques de biologie moléculaire. L'absence de population monoclonale lymphocytaire est un argument solide en faveur d'une étiologie bénigne d'une adénopathie, tandis que la mise en évidence d'anomalies moléculaires récurrentes par panel NGS permet de différencier entre deux lymphomes de bas grade.
Mais, ces techniques de pointe peuvent aussi être mises en défaut, notamment en raison d'un manque de matériel tumoral ou de situations borderline.
La relecture confirme le diagnostic suspecté. Cependant, dans l'intervalle, votre patient a été hospitalisé en réanimation pour hypercalcémie maligne et progression rapide de la lésion pulmonaire. La clinique n'étant pas en faveur du diagnostic de NLPHL, le pathologiste accède à la biopsie pulmonaire initiale. Limité par la taille réduite du prélèvement, le pathologiste retrouve tout de même une disparition de l'architecture nodulaire et des lymphocytes B non tumoraux. Aidé par la clinique et cet autre prélèvement, il ajuste le diagnostic : au niveau pulmonaire, le NLPHL présente une transformation en lymphome B riche en cellules T et histiocytes. Dans un second temps, des techniques de moléculaire seront réalisées (Figure 6-8).
L'avènement des techniques d'analyse moléculaire permet une compréhension plus appronfondie de la pathogénèse des lymphomes, et entraîne l'actualisation des classifications2, 3. La séparation de lymphomes en nouveaux sous-types contribuera à rendre les essais cliniques plus homogènes, et de se rapprocher d'une médecine personnalisée.

Figure 9 Clonalité lymphocytaire B – Le répertoire lymphocytaire B est créé grâce à la recombinaison des différents segments V, D et J des gènes codant pour les chaînes lourdes et légères, permettant la création de 5 millions de possibilités d'immunoglobulines différentes. L'étude de la clonalité permet de rechercher la présence majoritaire d'une seule immunoglobuline (donc un seul lymphocyte B). En pratique, après extraction ADN du prélèvement histologique, des amorces PCR des segments V, D et J permettent d'amplifier ces séquences. Ensuite, une analyse des produits issus de la première étape recherche la présence d'une multitude de combinaisons différentes (polyclonal), ou alors la présence d'un seul variant en grande quantité (monoclonal). On peut faire l'analogie avec une électrophorèse des protéines et la recherche d'un composant monoclonal. L'analyse est souvent difficile, et confrontée à un témoin négatif. Ici, présence d'une population B monoclonale. FR2 et FR3 sont différentes régions du gène, étudiées pour augmenter la spécificité de la technique. Grâce à la ligne « 5-DH » on remarque que le réarrangement clonal est composé du cinquième segment D de la chaîne lourde (Heavy).
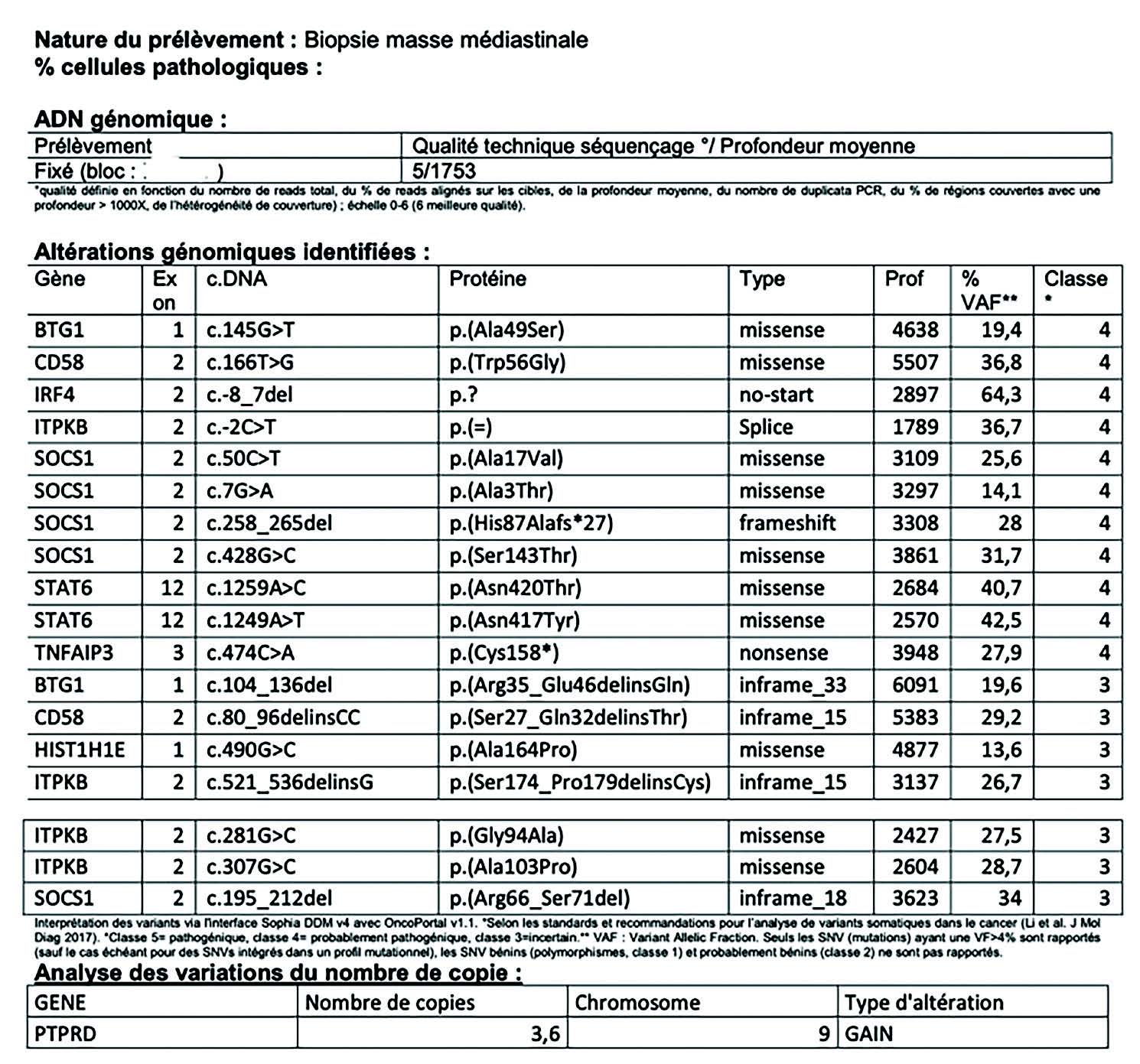
Figure 10 Panel NGS - Après extraction ADN, plusieurs gènes vont être séquencés selon le panel prédéfini, afin de rechercher des altérations génomiques orientant vers un sous-type de lymphome. Ici, profil mutationnel typique d'un lymphome B primitif du médiastin.
L'évolution de la discipline devra aussi se faire au rythme des nouvelles technologies. À l'instar d'autres domaines, l'intelligence artificielle a démontré son potentiel en hématopathologie, et constituera, dans les années à venir, une aide précieuse au diagnostic4.
Pour vous récompenser de votre attente, le pathologiste vous envoie une photo, afin de vous tester.
Si vous ne parvenez pas à reconnaître, n'hésitez pas à aller rencontrer vos collègues du laboratoire afin de leur demander !
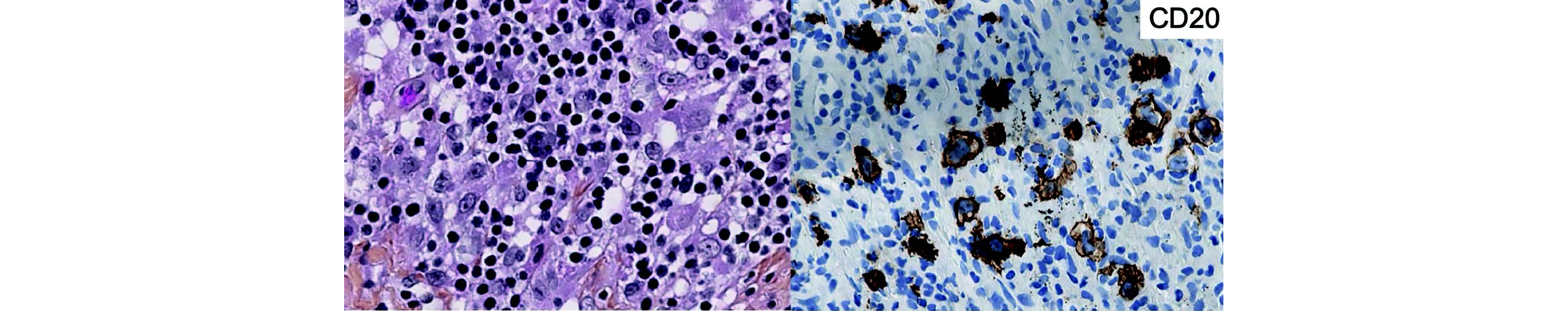
Figure 11 Photo mystère - À gauche, HPS environ x40 ; À droite, CD20

Références
1. Laurent C, Baron M, Amara N, Haioun C, Dandoit M, Maynadié M, et al. Impact of Expert Pathologic Review of Lymphoma Diagnosis: Study of Patients From the French Lymphopath Network. J Clin Oncol. 2017;35(18):2008-2017. 2. Alaggio R, Amador C, Anagnostopoulos I, Attygalle AD, Araujo IB, Berti E, et al. The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Lymphoid Neoplasms. Leukemia. 2022;36(7):1720-1748. 3. Campo E, Jaffe ES, Cook JR, Quintanilla-Martinez L, Swerdlow SH, Anderson KC, et al. The International Consensus Classification of Mature Lymphoid Neoplasms: a report from the Clinical Advisory Committee. Blood. 2022;140(11):1229-1253. 4. Syrykh C, Abreu A, Amara N, Siegfried A, Maisongrosse V, Frenois FX, et al. Accurate diagnosis of lymphoma on whole-slide histopathology images using deep learning. npj Digit Med. 2020;3.

