
Introduction
La fibrillation atriale (FA) est l'arythmie la plus fréquente, touchant 2 à 4 % des adultes (1) et jusqu'à 10 % des sujets de plus de 80 ans (2), soit environ 750 000 malades en France. Ce nombre pourrait être doublé d'ici à 2060 compte tenu d'une incidence en forte augmentation (3). Avec un risque relatif d'accident vasculaire cérébral (AVC) de l'ordre de 4, la FA est responsable d'environ 20 % des AVC (4). La présentation de ces AVC est majoritairement ischémique (5) et leur sévérité est volontiers plus marquée que celle des autres AVC ischémiques (6).
Le traitement de référence pour la prévention de ce risque repose sur les anticoagulants oraux (ACO) qui réduisent l'incidence annuelle des AVC de 4 % sans traitement à 1,5 % sous anticoagulation efficace, soit d'environ 60 % (7, 8). L'usage des ACO est néanmoins limité par le risque hémorragique (8, 9) et leur efficacité est diminuée en cas de mauvaise observance, rapportée chez au moins un quart des patients (10).
Comme alternative aux ACO en cas de contre-indication, la fermeture d'auricule gauche (FAG) percutanée est une intervention apparue progressivement dans les recommandations depuis plusieurs années (11, 12). En effet, 90 % des thrombi sont retrouvés dans l'auricule gauche (13), qui semble donc constituer un lieu de stase préférentiel avec une implication forte dans le risque d'AVC chez les patients atteints de FA (14, 15). Il existe également des perspectives de traitement conjoint avec un ACO chez les patients à haut risque thrombo- embolique, à l'instar de la FAG chirurgicale désormais recommandée au cours de toute chirurgie cardiaque chez tous les patients présentant une FA (11, 15).
Historique
La première FAG percutanée chez l'homme est réalisée en 2001 par une équipe allemande avec le dispositif PLAATO (Appriva Medical) (16). Malgré des résultats cliniques encourageants, le développement de ce dispositif cesse en 2005 (17). La même année, le dispositif WATCHMAN (Boston Scientific) reçoit le premier marquage CE d'un dispositif transca- théter dédié. Le principal dispositif concurrent, développé par AGA Medical, reçoit son marquage CE en 2008 puis est racheté par St. Jude Medical en 2010. Il est désormais commercialisé sous le nom d'AMPLATZER Amulet (Abbott). Avec le WATCHMAN FLX, évolution du modèle historique, ces dispositifs forment un duopole ayant totalisé 2360 implantations en France en 2023 (figure 1).

Figure 1. (A) Dispositif WATCHMAN® FLX commercialisé par Boston Scientific (Marlborough, MA, USA), fait d'une armature en nitinol recouverte sur son versant proximal d'une membrane plastique. (B) Dispositif AMPLATZER® Amulet commercialisé par Abbott (Chicago, IL, USA) fait d'une armature de nitinol (un lobe distal et un disque proximal) renfermant une membrane textile. Images tirées des sites internet de Boston Scientific et de Abbott.
Preuves et recommandations actuelles
Les premières études apportant un haut niveau de preuve de l'efficacité de la FAG sont les essais contrôlés randomisés PROTECT-AF et PREVAIL, publiés en 2013 et 2014 respectivement (18, 19). Ces deux essais au design similaire ont comparé la FAG percutanée avec le dispositif WATCHMAN à l'anticoagulation par warfarine chez 707 et 407 patients avec une FA non valvulaire (FANV). La méta-analyse de ces deux études, portant sur un total de 4343 patients-années, a mis en évidence la non-infériorité de la FAG percutanée sans ACO associé sur l'incidence combinée d'AVC, d'embolie systémique et de décès de cause cardiovasculaire ou inconnue (HR 0,82 IC95 % 0,58-1,17) (20). Ce critère de jugement composite était essentiellement porté par les décès de cause cardiovasculaire ou inconnue (HR 0,59 IC95 % 0,37-0,94) et les AVC hémorragiques (HR 0,2 IC95 % 0,07-1,17).
Suite à ces travaux, le dispositif WATCHMAN a été inscrit en 2016 à la liste des produits et prestations (LPP) remboursables par l'Assurance Maladie en France.
L'indication retenue pour le remboursement était limitée aux patients avec une FANV, un score CHA2DS2-VASc supérieure à 4 et une contre-indication définitive aux ACO.
Plus récemment, l'essai contrôlé randomisé PRAGUE-17 publié en 2020 a comparé la FAG percutanée avec le dispositif WATCHMAN sans ACO associé à un anticoagulant oral direct (AOD) chez 402 patients avec une FANV et un risque thrombo-embolique et/ou hémorragique accru (21). Après un suivi médian de 3,5 années, l'incidence combinée d'AVC, d'embolie systémique, de saignement cliniquement significatif (définition ISTH (22)) et de décès de cause cardiovasculaire était similaire dans les deux groupes (HR 0,81 IC95 % 0,56-1,18). Une méta-analyse de cet essai combiné aux essais PROTECT-AF et PREVAIL a permis de conforter les résultats obtenus quelques années auparavant et sert aujourd'hui de repère pour les chiffres d'efficacité et de sécurité de la FAG percutanée (14) (figure 2).

Concernant le dispositif AMPLATZER Amulet, l'essai Amulet IDE publié en 2021 a permis d'établir sa non-infériorité en comparaison au dispositif WATCHMAN avec un haut niveau de preuve chez 1878 patients avec une FANV et un risque thrombo-embolique accru (23). Après 3 années de suivi, l'incidence du critère composite d'efficacité (AVC, embolie systémique ou décès d'origine cardiovasculaire) et l'incidence des saignements
majeurs étaient de 11,1 % et 16,1 % dans le groupe testé (AMPLATZER Amulet) contre 12,7 % et 14,7 % dans le groupe contrôle (WATCHMAN), respectivement (24).
Des données observationnelles supplémentaires en faveur de ces dispositifs proviennent des registres de soins courants. Ces études prospectives rapportent un taux de succès d'implantation supérieur et un taux de complications péri-procédurales inférieur par rapport aux essais contrôlés randomisés précédemment cités (25, 26), témoignant probablement de l'expertise croissante des opérateurs au fil du temps.
Malgré ces résultats encourageants, les recommandations de la société européenne de cardiologie sur la FAG percutanée n'ont pas évolué depuis son apparition dans la version de 2012 en grade IIb et seulement chez les patients avec une contre-indication définitive aux ACO (11, 27). En revanche, Boston Scientific a obtenu de la Haute Autorité de Santé en 2024 une évolution de l'indication de son dispositif à la LPP aux patients avec un score CHA2DS2-VA supérieure à 2, toujours en cas de contre-indication définitive aux ACO.
Essai option
Les résultats de l'étude OPTION ont été publiés en novembre dernier (28). Dans cet essai contrôlé randomisé, les auteurs ont comparé la FAG percutanée avec le dispositif WATCHMAN FLX aux ACO après une ablation par cathéter chez des patients avec une FANV et un score CHA2DS2-VA supérieure à 2. Les patients du groupe testé recevaient un ACO pendant 3 mois après l'intervention puis un traitement par acide acétylsalicylique (AAS) faible dose pendant 9 mois tandis que les patients du groupe contrôle poursuivaient un traitement ACO tout au long de l'étude. Le CJP d'efficacité défini par les auteurs pour cet essai de non-infériorité était un critère composé des AVC, des embolies systémiques et des décès de toute cause.
Entre novembre 2019 et juin 2021, 1600 patients ont été inclus et randomisés dans 106 centres de 10 pays différents. Ces patients avaient un âge moyen de 70 ans (σ 8 ans), un score CHA2DS2-VASc moyen de 3,5 (σ 1,3) et un score HAS-BLED moyen de 1,2 (σ 0,8) à l'inclusion. Ils présentaient une FA paroxystique pour environ 60 % d'entre eux et la FA était diagnostiquée il y a moins d'un an pour environ 30 % des patients. Environ 60 % des patients inclus avaient déjà bénéficié de l'ablation par cathéter de FA (au minimum 90 jours et au maximum 180 jours avant l'inclusion) et donc la FAG était concomitante de l'ablation par cathéter chez seulement 40 % des patients du groupe testé.
Parmi les 803 patients randomisés dans le groupe testé, 81 étaient traités par ACO à 36 mois dont 50 qui n'ont pas bénéficié de FAG percutanée. Parmi les 797 patients randomisés dans le groupe contrôle, 82 patients ont bénéficié d'une FAG percutanée au cours du suivi, essentiellement en cas de survenue d'un saignement majeur contre-indiquant définitivement les ACO (82 % d'entre eux).
Dans le groupe testé, l'implantation du WATCHMAN FLX était jugée un succès chez 753 patients (98,8 %). Des complications liées à l'intervention étudiée étaient rapportées chez 22 patients (2,8 %). Une fuite péri-prothétique de 3 mm ou plus était constatée en échocardiographie transœsophagienne (ETO) chez 1,4 % des patients à 3 mois et 2,3 % des patients à 12 mois. Aux mêmes échéances, un thrombus lié au dispositif était mis en évidence chez 1,1 % et 1,9 % des patients, respectivement.
Le CJP de sécurité portait sur les saignements majeurs et cliniquement significatifs (définitions ISTH (22)) non liés à l'intervention. Au terme du suivi de 36 mois, il était rapporté chez 65 (8,5 %) patients du groupe testé et 137 (18,1 %) du groupe contrôle (HR 0,44 IC95% 0,33-0,59, p < 0,001 pour la supériorité) (figure 3A). Concernant les saignements majeurs, incluant ceux liés à l'intervention, il n'y avait pas de différence statistiquement significative entre les deux groupes (HR 0,77 IC 0,48-1,24).
Au terme du suivi de 36 mois, le CJP d'efficacité était rapporté chez 41 patients (5,3 %) du groupe testé et 44 patients (5,8 %) du groupe contrôle (HR 0,91 IC95 % 0,59-1,39, p inférieure à 0,001 pour la non-infériorité) (figure 3B).
Les composantes du CJP étaient homogènes entre le groupe testé et le groupe contrôle : 29 et 34 décès, 9 et 10 AVC ischémiques, 3 et 3 AVC hémorragiques, 2 et 1 embolies systémiques.
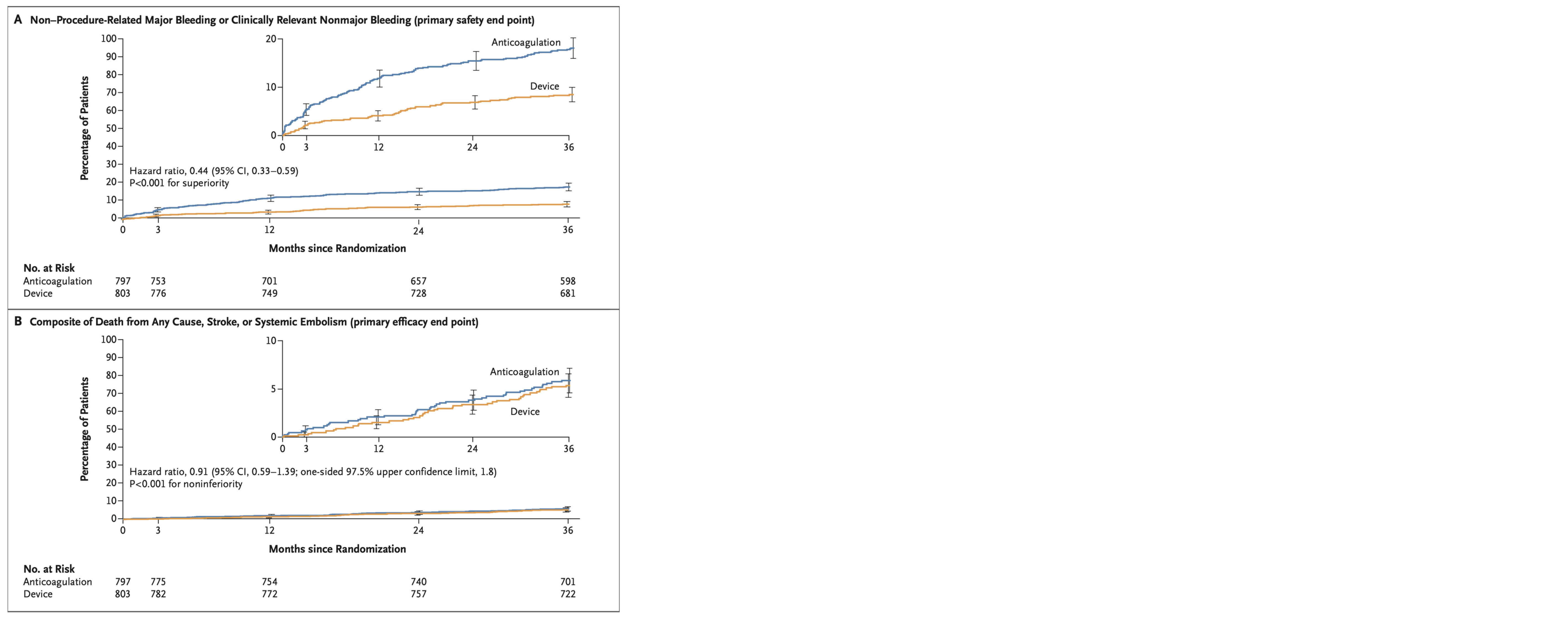
Figure 3. Courbes d'incidence cumul.e du CJP de s.curit. (A) et du CJP d'efficacit. (B) au cours du suivi de 36 mois dans l'.tude OPTION (28).
Discussion
Les résultats de l'étude OPTION sont cohérents avec ceux de la méta-analyse des essais précédents (figure 2). La FAG percutanée sans ACO associé diminue significativement le risque de saignement au-delà des saignements liés à la procédure et n'augmente pas le risque d'AVC ou d'embolie systémique en comparaison aux ACO chez les patients atteints de FANV.
L'essai OPTION se distingue par une population étu- diée à risque thrombo-embolique plus faible que dans la réunion des essais précédents. D'abord, le score CHA2DS2-VASc moyen était de 3,5 (σ 1,3) contre 4,1 (σ 1,4) (14). De plus, la proportion des patients inclus avec une FA paroxystique était d'environ 60 % contre 40 % (14). Enfin, tous les patients inclus avaient bénéficié d'une ablation par cathéter de FA, une intervention réduisant vraisemblablement le risque thrombo-embolique par diminution de la charge rythmique (29). Ces raisons peuvent expliquer la faible incidence annuelle des AVC et embolies systémique dans le groupe contrôle de l'essai OPTION (0,7 %) en comparaison aux essais précédents (1,8 %).
De la même façon, le risque hémorragique était certainement moins important dans la population de l'essai OPTION avec un score HAS-BLED moyen de 1,2 (σ 0,8) contre 3,0 (σ 1,4) dans l'essai PRAGUE-17 par exemple. L'incidence annuelle des saignements majeurs dans le groupe contrôle de l'essai OPTION était de 1,6 % contre 3,4 % dans les essais précédents. Cette différence peut aussi s'expliquer par le recours aux AOD plutôt qu'à la warfarine dans l'essai OPTION.
Les auteurs rappelent que les résultats de l'étude ne sont applicables qu'aux patients avec une fraction d'éjection du ventricule gauche (FEVG) supérieure à 30 % puisqu'une FEVG inférieure à 30 % constituait un critère de non-inclusion. Aussi, les auteurs soulignent le caractère ouvert de l'étude qui a pu conduire à une déclaration plus fréquente des saignements dans le groupe contrôle. Toutefois, ce biais de classement devrait concerner principalement les saignements mineurs.
De manière générale, les essais sur la FAG percutanée n'ont pas permis de mettre en évidence une réduction significative des saignements majeurs. Cependant, la durée moyenne de suivi dans ces études était limitée à environ 3 ans, ce qui ne permet pas d'évaluer complètement le bénéfice à long terme. En effet, le risque d'accident aux anticoagulants persiste tout au long du traitement et augmente même avec l'âge du patient (8). Un suivi plus prolongé de ces patients serait souhaitable.
Sur le plan économique, le coût d'un dispositif de FAG percutanée en France est actuellement de 4417,5 €, tandis que plusieurs AOD disposent maintenant de médicaments génériques. Par exemple, 60 comprimés d'apixaban 5 mg, correspondant à 1 mois de traitement, coûtent désormais 25,6 €. Selon le protocole de l'essai OPTION, il faudrait attendre 16 ans pour que le geste combiné (FAG percutanée + ablation par cathéter de FA) devienne économiquement avantageux. Aussi, l'âge moyen des patients inclus dans l'essai OPTION était de 70 ans (σ 8 ans), limitant l'intérêt à long terme dans cette population. Ce calcul n'intègre pas la réduction des saignements cliniquement significatifs (HR 0,39 IC95% 0,28-0,55) qui entraînent une consommation de soins diminuée dans le groupe testé.
Montants utilisés pour le calcul : 4417,5 € (FAG percutanée), 3*25,6 € (3 mois de traitement AOD), 9*1,6 € (9 mois de traitement par AAS faible dose) et 2*144,7 € (2 ETO de suivi).
Plusieurs essais en cours vont permettre de préciser la place de la FAG percutanée dans l'arsenal thérapeutique du cardiologue. Les essais CHAMPION-AF (NCT043945460) et CATALYST (NCT04226547) sponsorisés respectivement par Boston Scientific et Abbott portent sur la FAG percutanée comme alternative aux ACO. Ces essais vont concerner à eux deux plus de 5000 patients, soit bien davantage que les 3000 patients cumulés des essais publiés à ce jour sur le sujet. L'essai LAAOS IV (NCT05963698) vise à évaluer l'efficacité additive de la FAG percutanée en sus d'un ACO comme cela avait été montré pour la FAG chirurgicale par l'essai LAAOS III (15). Enfin, d'autres travaux en cours portent sur des populations plus spécifiques comme les patients avec AVC ischémique récidivant sous ACO, une situation qui ne permet pas un remboursement de la FAG percutanée actuellement.
Les points clés à retenir
• La FAG percutanée apparaît progressivement comme une alternative aux ACO, non-inférieure et sûre pour la prévention du risque thrombo-embolique chez les sujets atteints de FANV.
• Cette technique est actuellement remboursée en France chez les sujets atteints de FANV avec un score CHA2DS2-VA supérieure à 2 et une contre-indication définitive aux ACO.
• Son bénéfice sur les saignements majeurs n'est pas démontré mais un suivi davantage prolongé pourrait générer des données sur le bénéfice à long terme de l'arrêt des ACO.
• Les résultats de l'essai OPTION sont cohérents avec la littérature existante et étendent les preuves à une population à moindre risque thrombo-embolique et hémorragique.
• Le coût actuel de la FAG percutanée est important comparativement aux ACO, ce qui constitue un frein à l'élargissement de son remboursement en France.
• La place de la FAG percutanée dans la prise en charge de la FA va être précisée dans les années à venir grâce à plusieurs essais de grande ampleur en cours.
Références
1. Benjamin EJ, Muntner P, Alonso A, Bittencourt MS, Callaway CW, Carson AP, et al. Heart Disease and Stroke Statistics—2019 Update: A Report From the American Heart Association. Circulation [Internet]. 5 mars 2019 [cité 8 déc 2024];139(10). Disponible sur : https://www.ahajournals.org/doi/10.1161/CIR.0000000000000659
2. Feinberg WM, Blackshear JL, Laupacis A, Kronmal R, Hart RG. Prevalence, age distribution, and gender of patients with atrial fibrillation. Analysis and implications. Arch Intern Med. 13 mars 1995;155(5):469-73.
3. Chugh SS, Havmoeller R, Narayanan K, Singh D, Rienstra M, Benjamin EJ, et al. Worldwide Epidemiology of Atrial Fibrillation: A Global Burden of Disease 2010 Study. Circulation. 25 févr 2014;129(8):837-47.
4. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke. août 1991;22(8):983-8.
5. Arboix A, Alioc J. Cardioembolic Stroke: Clinical Features, Specific Cardiac Disorders and Prognosis. CCR. 1 août 2010;6(3):150-61.
6. Kamel H, Healey JS. Cardioembolic Stroke. Circ Res. 3 févr 2017;120(3):514-26.
7. Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation. Analysis of pooled data from five randomized controlled trials. Arch Intern Med. 11 juill 1994;154(13):1449-57.
8. Ruff CT, Giugliano RP, Braunwald E, Hoffman EB, Deenadayalu N, Ezekowitz MD, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet. mars 2014;383(9921):955-62.
9. Rubboli A. Incidence, clinical impact and risk of bleeding during oral anticoagulation therapy. WJC. 2011;3(11):351.
10. 10. Perreault S, De Denus S, White‐Guay B, Côté R, Schnitzer ME, Dubé M, et al. Oral Anticoagulant Prescription Trends, Profile Use, and Determinants of Adherence in Patients with Atrial Fibrillation. Pharmacotherapy. janv 2020;40(1):40-54.
11. Van Gelder IC, Rienstra M, Bunting KV, Casado-Arroyo R, Caso V, Crijns HJGM, et al. 2024 ESC Guidelines for the management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 29 sept 2024;45(36):3314-414.
12. Joglar JA, Chung MK, Armbruster AL, Benjamin EJ, Chyou JY, Cronin EM, et al. 2023 ACC/AHA/ACCP/HRS Guideline for the Diagnosis and Management of Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation [Internet]. 2 janv 2024 [cité 24 janv 2024];149(1). Disponible sur: https://www.ahajournals.org/doi/10.1161/CIR.0000000000001193
13. Blackshear JL, Odell JA. Appendage obliteration to reduce stroke in cardiac surgical patients with atrial fibrillation. ATS. févr 1996;61(2):755-9.
14. Turagam MK, Osmancik P, Neuzil P, Dukkipati SR, Reddy VY. Left Atrial Appendage Closure Versus Oral Anticoagulants in Atrial Fibrillation. JACC. déc 2020;76(23):2795-7.
15. Whitlock RP, Belley-Cote EP, Paparella D, Healey JS, Brady K, Sharma M, et al. Left Atrial Appendage Occlusion during Cardiac Surgery to Prevent Stroke. NEJM. 3 juin 2021;384(22):2081-91.
16. Sievert H, Lesh MD, Trepels T, Omran H, Bartorelli A, Della Bella P, et al. Percutaneous Left Atrial Appendage Transcatheter Occlusion to Prevent Stroke in High-Risk Patients With Atrial Fibrillation: Early Clinical Experience. Circulation. 23 avr 2002;105(16):1887-9.
17. Ostermayer SH, Reisman M, Kramer PH, Matthews RV, Gray WA, Block PC, et al. Percutaneous Left Atrial Appendage Transcatheter Occlusion (PLAATO System) to Prevent Stroke in High-Risk Patients With Non-Rheumatic Atrial Fibrillation. JACC. juill 2005;46(1):9-14.
18. Reddy VY, Doshi SK, Sievert H, Buchbinder M, Neuzil P, Huber K, et al. Percutaneous Left Atrial Appendage Closure for Stroke Prophylaxis in Patients With Atrial Fibrillation: 2.3-Year Follow-up of the PROTECT AF (Watchman Left Atrial Appendage System for Embolic Protection in Patients With Atrial Fibrillation) Trial. Circulation. 12 févr 2013;127(6):720-9.
19. Holmes DR, Kar S, Price MJ, Whisenant B, Sievert H, Doshi SK, et al. Prospective Randomized Evaluation of the Watchman Left Atrial Appendage Closure Device in Patients With Atrial Fibrillation Versus Long-Term Warfarin Therapy. JACC. juill 2014;64(1):1-12.
20. Reddy VY, Doshi SK, Kar S, Gibson DN, Price MJ, Huber K, et al. 5-Year Outcomes After Left Atrial Appendage Closure. JACC. déc 2017;70(24):2964-75.
21. Osmancik P, Herman D, Neuzil P, Hala P, Taborsky M, Kala P, et al. Left Atrial Appendage Closure Versus Direct Oral Anticoagulants in High-Risk Patients With Atrial Fibrillation. JACC. juin 2020;75(25):3122-35.
22. Schulman S, Kearon C. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in non‐surgical patients. JTH. avr 2005;3(4):692-4.
23. Lakkireddy D, Thaler D, Ellis CR, Swarup V, Sondergaard L, Carroll J, et al. Amplatzer Amulet Left Atrial Appendage Occluder Versus Watchman Device for Stroke Prophylaxis (Amulet IDE): A Randomized, Controlled Trial. Circulation. 9 nov 2021;144(19):1543-52.
24. Lakkireddy D, Thaler D, Ellis CR, Swarup V, Gambhir A, Hermiller J, et al. 3-Year Outcomes From the Amplatzer Amulet Left Atrial Appendage Occluder Randomized Controlled Trial (Amulet IDE). JACC CVI. août 2023;16(15):1902-13.
25. Boersma LV, Ince H, Kische S, Pokushalov E, Schmitz T, Schmidt B, et al. Efficacy and safety of left atrial appendage closure with WATCHMAN in patients with or without contraindication to oral anticoagulation: 1-Year follow-up outcome data of the EWOLUTION trial. Heart Rhythm. sept 2017;14(9):1302-8.
26. Landmesser U, Tondo C, Camm J, Diener HC, Paul V, Schmidt B, et al. Left atrial appendage occlusion with the AMPLATZER Amulet device: one-year follow-up from the prospective global Amulet observational registry. EuroIntervention. août 2018;14(5):e590-7.
27. Camm AJ, Lip GYH, De Caterina R, Savelieva I, Atar D, Hohnloser SH, et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation. Eur Heart J. 1 nov 2012;33(21):2719-47.
28. Wazni OM, Saliba WI, Nair DG, Marijon E, Schmidt B, Hounshell T, et al. Left Atrial Appendage Closure after Ablation for Atrial Fibrillation. NEJM. 16 nov 2024;NEJMoa2408308.
29. Kirchhof P, Camm AJ, Goette A, Brandes A, Eckardt L, Elvan A, et al. Early Rhythm-Control Therapy in Patients with Atrial Fibrillation. NEJM. 1 oct 2020;383(14):1305-16.

Hugo VILMIN
Interne, CHRU de Nancy

Dr Jean-Marc SELLAL
Praticien Hospitalier,
CHRU de Nancy

