
D'après le webinaire PID ANJMIR x ajpo2
Intervenants : Dr Le Guen, Dr Gibelin, Dr Bunel
La pneumopathie interstitielle diffuse (PID) aiguë correspond à une PID avec installation des symptômes respiratoires en quelques jours/semaines, avec souvent une dyspnée au premier plan.
On distingue deux situations :
1) PID aiguë sans diagnostic préalable.
2) PID aiguë dans un contexte de PID chronique (pathologie préexistante connue ou supposée).
3) Dans ces deux cas, la démarche diagnostique et thérapeutique est identique.
Les principaux enjeux vont être de conduire une démarche diagnostique urgente, l'encadrement de l'endoscopie bronchique si indiquée, et la réflexion autour de l'intensité des soins (Optiflow, intubation, ECMO) à apporter aux patients en fonction de leurs comorbidités et du terrain.
Avant d'aborder la liste des étiologies possibles on gardera en tête par argument de fréquence deux principales hypothèses :
1) Une PID aiguë FÉBRILE est une infection jusqu'à preuve du contraire. Il faudra s'enquérir du statut immunitaire du patient et prendre en compte la nécessité d'examens complémentaires tels que l'endoscopie et le lavage bronchoalvéolaire (LBA) pour les documentations microbiologiques.
2) Une PID aiguë NON FÉBRILE est une insuffisance cardiaque gauche jusqu'à preuve du contraire. Il s'agit en effet de la première cause de PID associant scanographiquement du verre dépoli, des épaississements des septas avec épanchements pleuraux. La démarche diagnostique inclura alors la recherche de signes cliniques compatibles, un ECG, un dosage des BNP, une échographie transthoracique si disponible et, éventuellement, un test aux diurétiques.
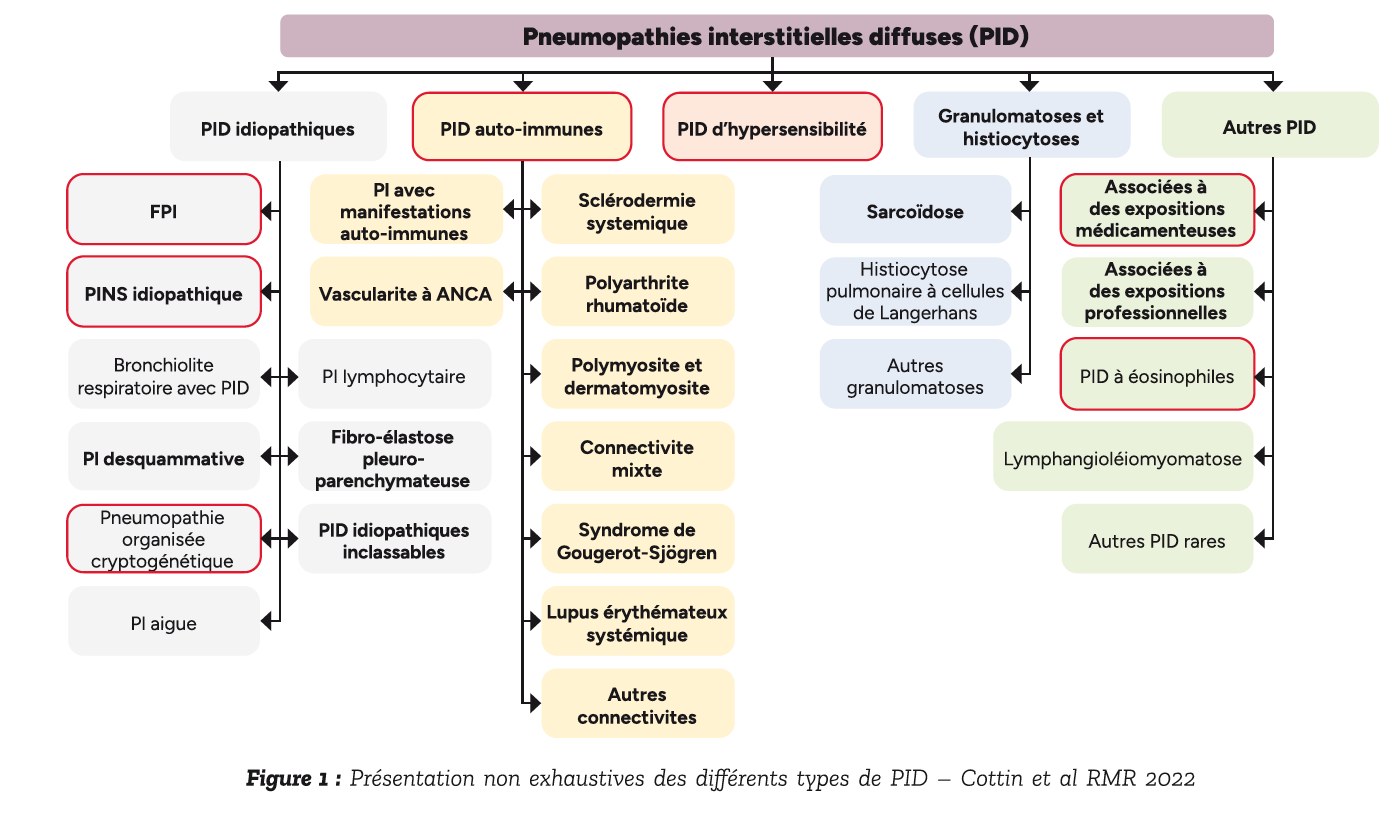
Étiologies des PID aiguë en réanimation
Nous allons aborder les PID pouvant se présenter sous une forme aiguë, ci-dessous encadrées en rouge, et qui sont susceptibles d'être rencontrées en réanimation (Figure 1).
Démarche diagnostique
Pour toute PID, cette démarche intégrera des éléments de l'interrogatoire, de l'examen clinique, biologique et scanographique :
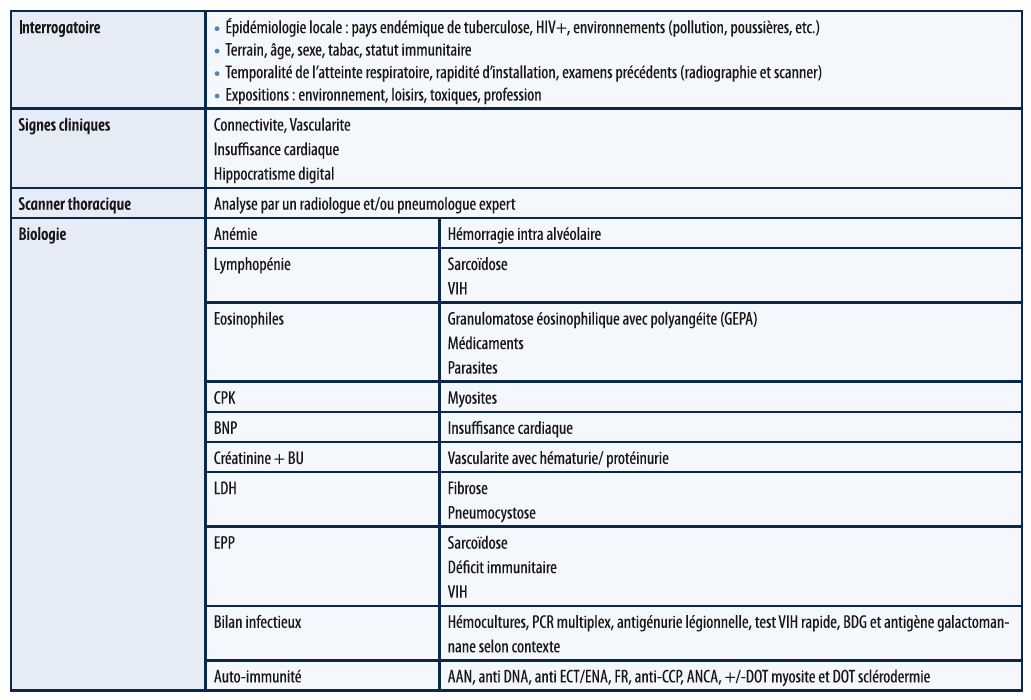
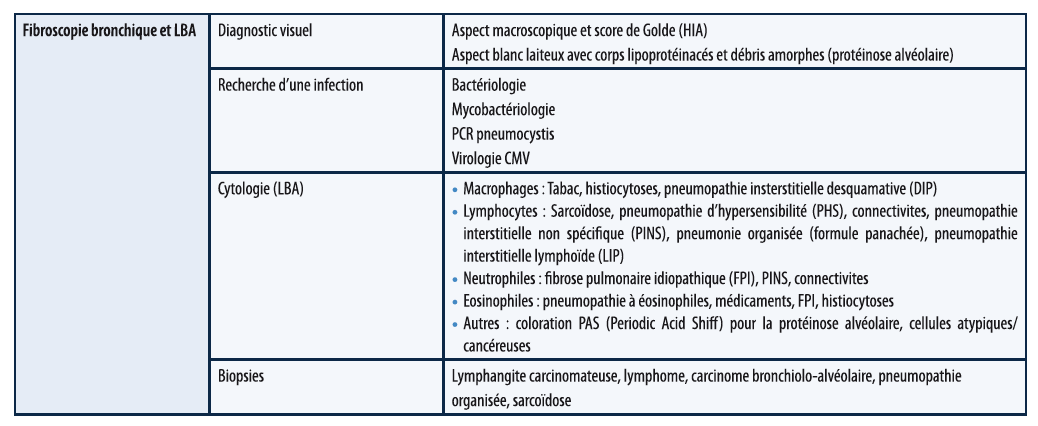
Un point particulier concernant le rôle de la fibroscopie bronchique et du LBA : celle-ci peut permettre d'étayer le diagnostic comme vu ci-dessus mais, dans plus de 80 % des cas, elle ne modifie pas la prise en charge, il faudra de plus tenir comme des risques engendrés par cet examen.
• Risques respiratoires : diminution du volume courant et de la ventilation alvéolaire, une augmentation de la CRF et baisse du VEMS, avec aggravation des rapports ventilation / perfusion. Tout ceci engendre une diminution de la saturation de 2 à 5 %, de la PaO2 de 15 à 30 %, et augmentation de la PaCO2 jusqu'à 10 %. Ces paramètres se normalisent en 2 heures environ.
• Risques hémodynamiques : Augmentation de la fréquence cardiaque, hypertension artérielle, arythmies, risque de cardiomyopathie de stress… Ces paramètres se normalisent en 15 minutes environ.
• Risque hémorragique selon le geste et l'hémostase du patient.
Si la fibroscopie bronchique est nécessaire et réalisée, on peut, pour prévenir les risques :
1) Assurer une meilleure gestion de l'hypoxémie : oxygénothérapie à haut débit (OHD) ou VNI.
2) 2) Assurer une meilleure analgésie : anesthésie locale +/- anesthésie intraveineuse à objectif de concentration (AIVOC) de Rémifentanyl (agent anesthésique IV, puis contrôle de la concentration cible choisie au niveau du cerveau, permettant une sédation vigile optimale, délai d'action de 1-2 min, demi-vie de 2-4 min).
3) Prévenir le risque hémorragique : vérifier la présence d'un taux de plaquettes supérieure à 20 G/L ou 50 G/L si biopsies à réaliser.
Nous allons aborder quelques étiologies particulières de PID
Le syndrome anti-synthétase Il est fréquemment révélé par une détresse respiratoire aiguë avec admission en réanimation, ce mode de révélation aiguë concerne environ 15 % des patients atteints d'un syndrome des anti-synthétases.
Biologiquement, on retrouve les anticorps suivants : MDA - le plus sévère (84 % de mortalité en réanimation), puis par ordre de fréquence : PL7/ PL12/ EJ/ JO1.
Il faut souligner la fréquence des formes amyopathiques, avec seulement 20 % de malades dont les CPK seront supérieurs à 2 fois la normale. Les signes de gravité « musculaires à rechercher seront les fausses routes et les signes d'insuffisance diaphragmatique.
Le scanner thoracique retrouve dans ce cadre un aspect de PINS / pneumonie organisée parfois associée à un pneumomédiastin.
Pneumopathie lupique
La pneumopathie lupique est rare, elle concerne 1 à 4 % des patients atteints de lupus systémique ; les signes extra thoraciques sont fréquemment associés (arthrite, atteinte cutanée, sérite, cytopénies auto immunes). S'y associe une positivité des anticorps anti-nucléaires et anti-DNA. L'imagerie thoracique montrera des condensation et une hémorragie intra-alvéolaire (sous forme de plage de verre dépoli).
Pneumonie organisée (PO)
La PO associe une alvéolite panachée au lavage broncho-alvéolaire et les arguments scanographiques incluent la présence de condensations migratrices, parfois avec un signe du halo.
Il s'agit d'un diagnostic d'élimination et il sera impératif d'éliminer les causes de condensations alvéolaires chroniques : infection, cancer, lymphome, pneumonie lipidique rarement. Le diagnostic de certitude reste histologique et souvent peu obtenu en pratique.
La PO peut être idiopathique, mais elle peut s'intégrer dans le cadre d'une PO secondaire (post-infectieuse, connectivite, médicaments, post radique). Sur le plan thérapeutique, elle se caractérise par une grande corticosensibilité.
Hémorragie intra-alvéolaire (HIA) L'HIA associe la triade : anémie, infiltrats pulmonaires (radiographique ou scanographique), et hémoptysie. Cependant, cette triade est inconstante et l'hémoptysie peut être absente. La réalisation d'une bandelette urinaire est nécessaire à la recherche d'arguments pour un syndrome pneumo-rénal (hématurie, protéinurie).
La fibroscopie aide au diagnostic positif d'HIA : présence de sang macroscopiquement, LBA montrant un liquide de plus en plus rouge, score de GOLDE élevé. À noter cependant qu'il n'y a pas forcément de sidérophages à la phase aiguë.
On distinguera les causes immunes et non immunes :
Immunes : vascularites (polyangéite microscopique, granulomatose avec polyangéite, granulomatose éosinophilique avec polyangéite (GEPA), anti MBG, vascularite cryoglobulinémique, à IgA…), lupus systémique, polyarthrite rhumatoïde, hépatite C avec cryoglobulinémie.
Non immunes : cardiogénique, médicaments / drogues, infection (coinfection grippe et staphylocoque, leptospirose, dengue, hantavirus), cancers, mécaniques (convulsions, œdème à pression négative) entre autres.
PID éosinophilique Définie par la présence au LBA de plus de 25 % d'éosinophiles ou une hyperéosinophilie sanguine. On retrouvera des étiologies diverses :
• Médicaments : Peut concerner sans spécificité tous les médicaments, tous types de terrains, tous les tableaux cliniques et scanographiques, tous les types cytologiques au LBA. L'imputabilité médicamenteuse est retenue sur des critères extrinsèques et intrinsèques avec une chronologie cohérente et une régression (ou absence de rechute) après l'arrêt du médicament. Cela reste un diagnostic d'élimination.
• Toxiques (vapoteuse, crack lung, inhalations poussières/ chantiers).
• Radiothérapie.
• Vascularite type GEPA (signes extra thoraciques : cutané, neurologique, cardiaque, rénal).
• Parasites (voyages à l'étranger).
• Pneumopathie aiguë à éosinophiles idiopathique (pas/peu d'éosinophilie sanguine).
• Syndrome hyper-éosinophilique.
Exacerbation de PID préexistantes
Elle représente une cause fréquente d'hospitalisation en réanimation.
Selon le type de PID sous-jacente, la prévalence des exacerbations est diff érente : pour la fibrose pulmonaire idiopathique (FPI) : 10 % / an, pour la PINS idiopathique : 4 % / an, les connectivites : 1 à 3 % / an, myosites : 5-20 %.
Devant toute aggravation aiguë d'une PID connue, il faudra rechercher une infection (dont la pneumocystose en cas d'immunosuppression), une insuffisance cardiaque, une embolie pulmonaire et évoquer l'imputabilité des médicaments.
Cas de la FPI
L'exacerbation de la FPI correspond à une aggravation aiguë des symptômes, principalement la dyspnée, sur une durée inférieure à un mois.
Sur le plan scanographique on observe de nouvelles opacités en verre dépoli et/ou des condensations parenchymateuses.
Histologiquement, on retrouve des lésions de dommage alvéolaire diffus +/- de pneumonie organisée.
La mortalité de l'exacerbation de FPI en réanimation est élevée, surtout en cas de nécessité de recourir à une intubation oro-trachéale (97 % de mortalité) et a fortiori s'il existe d'autres défaillances d'organes.
Cette mortalité élevée en cas de recours à la ventilation mécanique peut s'expliquer du fait d'une sensibilité accrue des PID au VILI (Ventilator Induced Lung Injury). Ainsi, en cas de ventilation invasive il sera nécessaire de pratiquer une ventilation ultra protectrice (volume courant à maximum 6 ml/kg de poids théorique), préférer une oxygénothérapie de haut débit (OHD) et ne pas utiliser de VNI dans la mesure du possible. L'ECMO vigile pourra être discutée selon le profil du patient.
Le traitement comprend des bolus de METHYLPREDNISOLONE puis relai à la dose de 1 mg/kg. Une réponse favorable sous corticothérapie est attendue entre 48h et 7 jours maximum. Au-delà, on peut considérer qu'il s'agit d'un échec du traitement.
De façon synchrone, il est important d'évaluer la faisabilité d'une transplantation si le patient est jeune inférieure à 65 ans (cf. page suivante), présente un bon état général ou s'il faudra s'orienter vers des soins palliatifs.
Dans la FPI, les facteurs de risque de mortalité sont la présence d'une fibrose sous-jacente ou se constituant, et la présence d'une hypertension pulmonaire associée.
Principes thérapeutiques des exacerbations de pid
On distinguera selon l'étiologie :
• ID de causes immunes et PID aiguës de novo : bolus de méthylprednisolone (au moins 120 mg) 3 jours puis relai 1 mg/kg.
• Pneumopathie aiguë à éosinophiles ou pneumonie organisée : bolus de méthylprednisolone (au moins 120 mg) 3 jours seuls puis relai 1 mg/kg.
• HIA de causes immunes : bolus de méthylprednisolone (au moins 120 mg) 3 jours associés à du rituximab ou du cyclophosphamide. Les échanges plasmatiques pourront être discutés à visée rénale dans les syndromes pneumo-rénaux bien que de moins en moins réalisés.
• PID aiguë dans un contexte de connectivites : bolus de méthylprednisolone (au moins 120 mg) 3 jours associés à du rituximab ou du cyclophosphamide. Les immunoglobulines intraveineuses pourront se discuter en cas de dermatomyosite ou les échanges plasmatiques.
• PID médicamenteuse : bolus de méthylprednisolone (au moins 120 mg) 3 jours associés à du rituximab ou du cyclophosphamide +/- échanges plasmatiques surtout si complications de l'immunothérapie (myocardite notamment).
• Protéinose alvéolaire : lavage thérapeutique (20L de sérum physiologique en lavage bronchoalvéolaire jusqu'à éclaircissement des lavages).
En dernier recours, il faudra savoir envisager la transplantation pulmonaire (TP) pour PID en soins intensifs.
Transplantation pulmonaire
La fibrose pulmonaire est devenue la 1ère cause de transplantation pulmonaire (TP) en 2022 devant l'emphysème et la BPCO, avec la constatation d'une chute drastique de la TP pour mucoviscidose.
Quand adresser le patient ?
Le parcours pré TP intègrera :
• L'évaluation de la gravité (bilan respiratoire et interrogatoire, retentissement fonctionnel).
• La recherche de contre-indications (cardiovasculaire, foyers infectieux notamment ORL, cancers, autres dysfonctions d'organes, diabète, toxicomanie…).
• L'information du patient et son entourage sur la greffe, les bénéfices attendues, le suivi, les complications entre autres.
Il faudra évaluer et adresser formellement le patient dans un centre de transplantation DÈS QUE :
Pneumonie interstitielle commune - PIC - sous traitement (la PIC étant une forme de PID avec scanographiquement la présence de kystes en rayon de miel à prédominance sous-pleurale et basale).
• CVF inférieure à 80 % ou DLCO inférieure à 40 %
• Évolutivité sur 2 ans : » Perte de 10 % de CV et 15 % la DLCO OU » Perte de 5 % CV ET atteinte scanographique avec nouvelles images.
• Oxygénothérapie au long cours.
• Progression de la PID sous traitement.
• Forme familiale ou connectivite.
Critères d'inscription sur liste
• Évolutivité sur 6 mois sous traitement : perte de 10 % de CV, 10 % de DLCO ou perte de 5 % de CV avec atteinte scanographique évocatrice.
• Test de marche de 6 minutes : perte de 50m en 6 mois, désaturation inférieure à 88 %.
• Présence d'une hypertension pulmonaire.
• Hospitalisation pour exacerbation.
Le patient doit présenter un bon état général, nutritionnel et musculaire avec un intérêt majeur de la réadaptation respiratoire pré-transplantation.
Critères d'inscription en super urgence
L'inscription en super-urgence rend le patient prioritaire pendant 8 jours, renouvelable 1 fois : indication dans la mucoviscidose / DDB, fibrose ou hypertension pulmonaire (non proposé pour la BPCO / emphysème).
Pour pouvoir être éligible, le patient doit avoir un état clinique compatible avec une greffe, une monodéfaillance respiratoire et aucune infection systémique en cours.
À noter que la mortalité après la TP est plus élevée si le patient a été inscrit en super urgence, sous ventilation, sous ECMO ou en cours d'une hospitalisation.
Risque de récidive sur greff on une fois transplanté ?
Ce risque concerne surtout les patients atteints de sarcoïdose, d'emphysème (déficit en alpha 1 antitrypsine, reprise de la consommation tabagique), certaines PHS ou PID de connectivite. Dans ce dernier cas, du fait de l'immunosuppression forte post-transplantation, les patients ont moins de risque d'exacerbation.
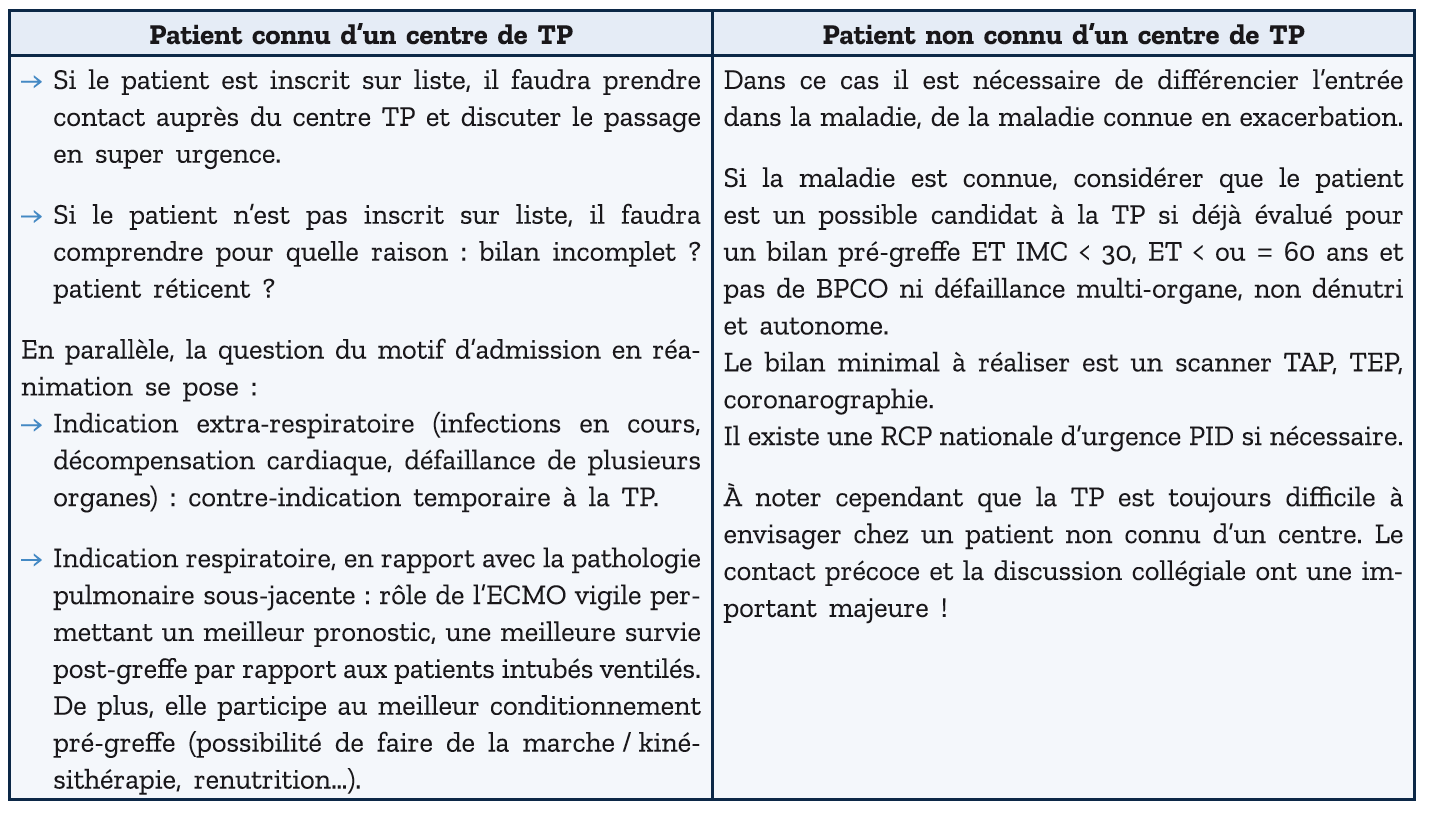
Pour tout patient sévère chez qui l'on envisage l'inscription sur liste de transplantation pulmonaire, on distinguera 2 cas de figures : le patient connu d'un centre de TP ou patient non connu.

Natalie AVIGNON
Interne de pneumologie Paris
Relecture
Dr Pierre LE GUEN PH,
Hôpital Bichat, Paris

