Introduction et épidémiologie
L'insuffisance mitrale correspond à l'une des valvulopathies les plus fréquentes, elle touche 2 à 3 % de la population générale. L'étiologie dégénérative est majoritaire et correspond à environ 60 % des insuffisances mitrales (IM). Sa prise en charge dépend du mécanisme, de sa sévérité, du caractère symptomatique ou non du patient et du retentissement sur le myocarde. Il est nécessaire de s'intéresser aux conséquences myocardiques de l'IM primaire pour guider au mieux le délai de prise en charge chirurgicale et pour mieux stratifier le risque des patients.
Mécanismes
Deux types d'IM primaire sont habituellement décrites (1), (2) (Figure 1). Il faut noter que la distinction entre les deux types est assez caricaturale et qu'il existe plutôt un continuum entre ces formes.
La forme myxoïde, également appelée Barlow, survient le plus souvent chez une patiente âgée de moins de 50-60 ans avec une histoire de souffle connu depuis plusieurs années voire décennies. Il peut également exister une histoire familiale d'IM avec une problématique de transmission génétique notamment lors des formes syndromiques type Marfan (3). L'échographie retrouvera des lésions volumineuses, épaisses avec un excès tissulaire, des cordages épaissis. La maladie de Barlow présente souvent des lésions multiples, plus complexes avec plusieurs segments impliqués dans le prolapsus. La rupture de cordage est moins fréquente. Les constatations chirurgicales retrouveront des valves épaisses, redondantes, volumineuses qui concernent plusieurs segments (Figure 2).
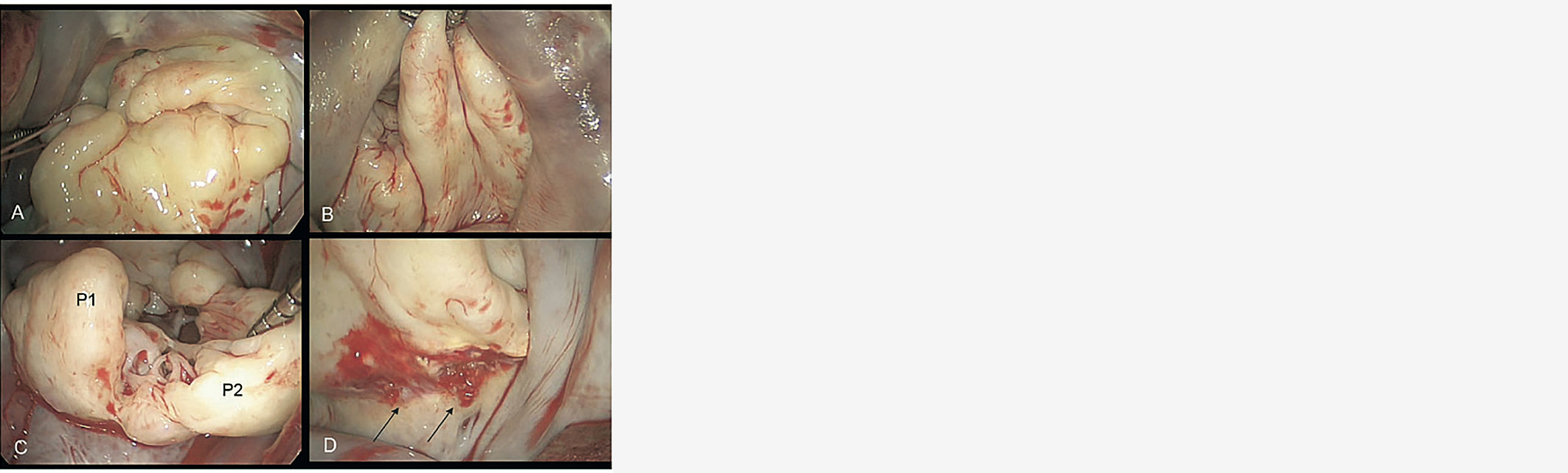
Figure 2 : Vues peropératoires d'IM sur une Maladie de Barlow avec valves redondantes, épaissies et multiples prolapsus. Etiologic Classification of Degenerative Mitral Valve Disease: Barlow's Disease and Fibroelastic Deficiency. Anyanwu AC et al.
La dégénérescence fibro-élastique réfère à une diminution du tissu conjonctif par altération de production du collagène, de l'élastine et des protéoglycanes. Elle survient plutôt chez l'homme plus âgé, après 60 ans, sans histoire de souffle connu. Il est retrouvé des valves plus fines avec un prolapsus qui concerne souvent un seul segment. La rupture de cordage est plus fréquente (1) (Figure 3).
La classification de Carpentier reprend les mécanismes possibles d'IM avec trois types. Le type 1 correspond à un mouvement valvulaire normal avec une IM par dilatation de l'anneau ou perforation valvulaire. Dans le type 2, les mouvements valvulaires sont exagérés lors d'un prolapsus valvulaire, d'une rupture de cordage ou de muscle papillaire. Le type 3 retrouve une restriction des mouvements et est divisé en deux avec le type 3A qui retrouve une restriction systolo-diastolique (post rhumatismal, toxique ou radique) et le type 3B avec une restriction uniquement systolique dans le cas d'une IM fonctionnelle. Dans l'IM dégénérative, deux principaux mécanismes vont participer : l'excès de mouvement valvulaire (type 2) et la dilatation de l'anneau (type 1) qui est auto entretenue (4) (Figure 4).

Figure 4 : Classification de Carpentier. El SA, Reddy YNV, Nishimura RA. Mitral Valve Regurgitation in the Contemporary Era.
Critères de sévérité
Afin d'évaluer la sévérité d'un IM, il existe des critères qualitatifs, semi-quantitatifs et quantitatifs (5).L'approche pour qualifier la sévérité la fuite doit donc être multiparamétrique (Figure 5).
Critères qualitatifs
Une première approche doit utiliser les critères qualitatifs pour évaluer l'IM. Cela repose sur la morphologie de la valve : un flail leaflet, une rupture de muscle papillaire, une rétraction sévère ou une large perforation seront en faveur d'une IM sévère.
Les recommandations évoquent le jet couleur pour évaluer la sévérité de manière qualitative mais ce paramètre est mauvais et souvent pris en défaut. La zone de convergence large holosystolique est en faveur d'une IM sévère. S'aider du doppler couleur en mode TM peut être utile pour confirmer un caractère holo ou télésystolique d'une régurgitation (Figure 6).
Critères semi quantitatifs
La Vena Contracta, quand elle est réalisable, est considérée comme le meilleur paramètre pour évaluer la sévérité d'une IM (6). Quand elle est supérieure ou égale à 7 mm, l'IM est considérée comme sévère. L'inversion du flux veineux pulmonaire (très spécifique mais peu sensible pour le caractère sévère), l'onde E prédo- minante au flux mitral supérieure à 1,2 m/s et le rapport des ITV mitral sur aortique supérieur à 1,4 plaident en faveur d'une IM sévère.
Critères quantitatifs
Les critères de sévérité quantitatifs sont les suivants : SOR supérieure à 40 mm2, volume régurgitant supérieure à 60mL et fraction de régurgitation supérieure à 50 %. Le volume régurgitant peut se calculer par deux méthodes : celle des débits utilisant la différence entre le VES en Simpson Biplan et le VES obtenu par l'ITV sous aortique et celle de la PISA.
Il y a quelques écueils à connaître pour critiquer les résultats obtenus avec les différentes méthodes : la SOR et la PISA surestiment la sévérité de la fuite dans les IM méso télé-systoliques, ce qui est souvent le cas dans les maladies de Barlow. Par ailleurs, la PISA est prise en défaut lorsque l'orifice est non circulaire, l'orifice est non plan, les jets sont multiples ou si l'IM est secondaire. Il n'est pas recommandé d'additionner les PISA lors de jets multiples. La PISA est également d'évaluation difficile si le jet est excentrique, il s'agit pourtant de la majorité des IM primaires avec prolapsus. Elle serait donc recommandée uniquement pour les IM primaires Carpentier 1. La méthode des volumes est une aide pour critiquer les mesures réalisées avec la PISA, celle-ci peut également s'avérer de réalisation difficile pour des problèmes d'échogénicité ou d'acquisition d'une ITV sous aortique de qualité.
Néanmoins, la méthode de la PISA reste une aide précieuse dans la quantification pour la comparaison avec les autres critères mais elle garde aussi un intérêt pronostique (7, 8).
Finalement, quand la quantification est compliquée en ETT, l'IRM cardiaque peut être une aide pour la quantification de la sévérité en calculant le volume régurgité et la fraction de régurgitation mais aussi pour étudier également le remodelage VG.
Conséquences et critères opératoires
L'IM entraîne une surcharge volumique qui va augmenter la précharge de l'oreillette gauche et du ventricule gauche qui va devoir éjecter un plus grand volume à la fois en sous-aortique mais également dans l'OG. Le régime de basse pression qui règne dans l'OG va induire une augmentation de la FEVG qui va devenir supra normale pour maintenir un débit systémique suffisant. Cela va permettre un mécanisme compensateur, de rester asymptomatique avec des PAP normales. Dans la durée, les mécanismes compensateurs vont évoluer et être dépassés. Le VG va continuer à se dilater avec la surcharge volumique.
La première conséquence qui sera mesurée sera le diamètre télésystolique du VG, il est retenu comme critère de prise en charge dans les recommandations lorsqu'il est supérieur à 40 mm car il apparaît comme un puissant marqueur de mortalité (9). La deuxième conséquence à regarder sera ensuite la dysfonction systolique du ventricule gauche, il s'agit également d'un marqueur de survie après chirurgie, on attend une perte de 10 à 15 % de la FEVG en post-opératoire (10). Il faut également s'intéresser à l'oreillette gauche, la surcharge volumique provoque une dilatation qui est étroitement liée à un risque de passage en fibrillation atriale et celle-ci est également pronostique (11) (12) (13). Enfin, tout en amont, l'augmentation des pressions pulmonaires doit également être évaluée car elle est tout aussi pronostique que les précédents paramètres (14). Comme dans le rétrécissement aortique, une classification en staging est apparue. Elle comporte des biais et ne reflète pas l'évolution certaine de chaque insuffisance mitrale, il y a quatre stades, le dernier étant celui de dysfonction ventriculaire droite (15) (Figure 7).

Figure 7 : Classification en staging de l'insuffisance mitrale primaire. van WAL, Mantegazza V, Hiemstra YL, Volpato V, van der BP, Pepi M, et al. Prognostic Impact of Extra–Mitral Valve Cardiac Involvement in Patients With Primary Mitral Regurgitation
Pour les critères opératoires, on peut retenir qu'une chirurgie urgente ou semi-urgente est généralement indiquée chez les patients avec une IM sévère aiguë, c'est le cas d'une IM aiguë sur rupture de muscle papillaire par exemple.
Dans l'IM chronique, les symptômes sont le point clef pour adresser un patient à une prise en charge. Le patient peut rapporter des signes droits ou gauches avec une dyspnée à l'effort. Dans ce cas, avec une IM sévère, le patient doit être adressé pour une prise en charge de l'IM. Si le patient se dit asymptomatique, il faut s'assurer qu'il ne s'agit pas d'un faux asymptomatique du fait d'un manque d'activité. Il existe trois façons de tester les patients à l'effort. Une première méthode utilise l'épreuve d'effort simple. Il existe aussi l'échocardiographie d'effort sur cycloergomètre et, enfin, l'épreuve d'effort métabolique. Il est rapporté, chez des patients avec une IM primaire asymptomatique, qu'une augmentation des PAPs de plus de 15 mmHg à de faibles efforts prédisait deux fois plus de risque d'événements cardiaques (16). De plus, on sait que 20 % des patients avec des IM asymptomatiques ont un pic de VO2 réduit (17). Chez des patients avec une IM au moins modérée sans critères de prise en charge de classe I, l'échocardiographie d'effort avec une PAPs supérieure à 55 mmHg à faible effort (25 à 50 Watts) ou ayant un pic de VO2 inférieure à 80 % de la théorique lors de l'épreuve d'effort métabolique sont prédictifs d'événements avec une valeur additionnelle (18) (Figure 8). Tester les patients à l'effort doit donc faire partie de la prise en charge pour dépister les faux asymptomatiques et traquer les patients qui feront des événements.
Les recommandations actuellement en vigueur sont celles de l'ESC 2021 (5). Elles reviennent sur les différentes étapes déjà citées. Il convient de s'assurer en premier lieu de la sévérité de l'IM. Si l'IM est sévère et symptomatique, une prise en charge chirurgicale est recommandée si le patient est opérable. Cependant, si le patient est asymptomatique, la FEVG inférieure à 60 % ou le diamètre télésystolique supérieur à 40mm sont les deux critères qui posent l'indication de prise en charge. Enfin, si les critères ne sont toujours pas remplis, les PAPs supérieures à 50 mmHg, la survenue d'une fibrillation atriale ou une taille d'OG supérieure à 60ml/m2 poseront l'indication de prise en charge (Figure 9).
Il existe quelques différences concernant la prise en charge de l'IM sévère asymptomatique entre les recommandations européennes et américaines (19). En effet, les critères d'OG et PAPs ne sont pas pris en compte par les recommandations américaines et il est noté qu'il est possible de prendre en charge les patients avec une IM sévère si la chirurgie est à bas risque, qu'il y a une haute probabilité de réparation chirurgicale (supérieure à 95 %) et un risque de mortalité opératoire inférieure à 1 % avec une recommandation IIA (Figure 10).
Place de la chirurgie
La plastie mitrale est la technique chirurgicale de référence pour la correction de l'IM primaire et doit toujours être privilégiée lorsqu'elle est techniquement réalisable. Il y a différentes techniques de plastie telles que la plicature, les résections, la mise bord à bord par technique d'Alfieri, l'utilisation de néocordages avec une association systématique à une annuloplastie. Le résultat de la plastie dépend de l'expérience et du nombre de plastie réalisée par le centre. Il est donc recommandé d'adresser les patients à des centres où un grand volume de plastie est réalisé, cela garantissant le risque opératoire inférieur à 1 % avec une haute probabilité de réparation chirurgicale.
Il y a deux façons différentes de prendre en charge les patients aux États-Unis et en Europe. Les recommandations européennes actuelles reposent sur les données d'étude d'une équipe autrichienne qui a suivi 280 patients atteints d'une IM sévère asymptomatique sans critère opératoire entre 1997 et 2015, durant le suivi de l'étude, 161 patients ont présenté une indication opératoire et leur mortalité a été comparée en les matchant par l'âge et le sexe à des personnes de la population générale. Les résultats montraient qu'une surveillance active par un centre expérimenté donnait une survie similaire entre la population générale et les patients atteints d'une IM sévère (20). Il faut cependant une équipe entraînée, avec une expertise dans le suivi des patients valvulaires asymptomatiques. S'affranchir des critères de remodelage pourrait permettre d'éviter une prise en charge trop tardive, éviter les perdus de vue et la survenue d'événements cardiovasculaires. Dans une étude multicentrique rétrospective, la prise en charge chirurgicale précoce des IM sévères par rapport à la surveillance rapprochée permet d'augmenter la survie au long terme et de diminuer le risque d'insuffisance cardiaque (21). Dans un registre prospectif, une équipe coréenne défend une prise en charge précoce de l'IM sévère, les patients étaient libres de choisir entre une prise en charge précoce (opération dans les 6 mois suivant le diagnostic d'IM sévère) ou surveillance active classique. Le groupe « chirurgie précoce » regroupait 161 patients et la surveillance conventionnelle regroupait 286 patients. Les résultats montraient alors une diminution de la mortalité cardiovasculaire et une diminution du risque d'hospitalisation pour insuffisance cardiaque chez les patients dans le groupe « chirurgie précoce » (22) (Figure 11).
Il n'y a cependant pas d'étude prospective randomisée répondant à la question de la chirurgie précoce dans l'IM sévère. C'est pourquoi, l'étude REVERSE-MR, un PHRC mené par l'équipe du CHU d'Amiens du Pr Tribouilloy est en cours pour répondre à cette question. Cet essai a pour but de démontrer la supériorité d'une prise en charge chirurgicale précoce chez les patients asymptomatiques avec une IM sévère due à un prolapsus valvulaire comparé à une approche conservatrice (NCT03389542). Les premiers résultats sont attendus dans les années à venir et présenteront une grande avancée pour la prise en charge des IM sévères asymptomatiques.
Quid de la place de la prise en charge percutanée ?
Plus de 150000 procédures par réparation bord à bord (TEER, transcatheter edge to edge repair) ont été réalisées depuis un peu plus d'une quinzaine d'années dans le monde. Aujourd'hui, la prise en charge percutanée est réservée aux patients à haut risque opératoire avec une IM sévère symptomatique. Il n'y a pas de place pour le traitement percutané chez le patient asymptomatique.
Des essais sont en cours. L'étude MITRA HR compare actuellement la chirurgie conventionnelle à la procédure percutanée par TEER chez les patients à haut risque chirurgical, le rationnel de cette étude repose sur le fait que les données à 5 ans de l'étude EVEREST II rapportaient une supériorité de la chirurgie pour diminuer la fuite mitrale chez des patients dont le STS score moyen était à 5 %, devant l'avancée des dispositifs TEER actuels, une nouvelle étude permettrait de comparer les deux prises en charge. L'étude REPAIR MR est un essai prospectif randomisé de non-infériorité comparant la chirurgie conventionnelle à la prise en charge percutanée chez les patients présentant une IM primaire sévère symptomatique ou asymptomatique remplissant les critères de classe I (FEVG inférieure à 60 %, DTSVG supérieure à 40mm) avec un risque opératoire modéré (âge de plus de 75 ans ou moins de 75 ans avec STS score à supérieure à 4 % ou la présence de comorbidité à risque pour la chirurgie). Ces différents essais permettront de mieux définir la place des procédures percutanées.
Il est primordial de rappeler que la prise en charge de ces patients doit toujours impliquer une concertation pluridisciplinaire au sein d'une Heart Team (23) dans un centre de compétence incluant chirurgiens cardiaques, échographistes, cardiologues interventionnels, anesthésistes-réanimateurs, radiologues et spécialistes en insuffisance cardiaque. Cela permet notamment de statuer sur la faisabilité technique ou non d'une prise en charge percutanée par rapport à l'anatomie de la fuite valvulaire. Les anatomies les plus favorables regrouperont des fuites centrales, un jet unique, un défaut de coaptation le plus petit avec une valve postérieure assez grande pour permettre un grasping facile lors de la pro- cédure (24) (Figure 12).
De même, de nombreuses prothèses de remplacement valvulaire mitral percutané ont été développés et sont en cours de validation. La seule prothèse ayant un marquage CE mais pas encore de remboursement est la prothèse TENDYNE d'Abbott qui s'implante par voie transapicale (Figure 13) (25).
Conclusion
Les recommandations actuelles de prise en charge de l'IM primaire sévère pourraient être amenées à évoluer avec les essais actuels en cours. Les résultats de l'étude REVERSE MR seront intéressants pour statuer de la meilleure stratégie à adopter entre chirurgie précoce et surveillance active pour les patients avec une IM sévère asymptomatique. La prise en charge percutanée par TEER évolue également et est réservée pour le moment aux patients à haut risque chirurgical et symptomatique. Les nouvelles recommandations sur les valvulopathies sont attendues dans les mois à venir.
Références
1. Anyanwu AC, Adams DH. Etiologic Classification of Degenerative Mitral Valve Disease: Barlow's Disease and Fibroelastic Deficiency. Semin Thorac Cardiovasc Surg. 1 juin 2007;19(2):90-6.
2. Levine RA, Hagége AA, Judge DP, Padala M, Dal-Bianco JP, Aikawa E, et al. Mitral valve disease--morphology and mechanisms. Nat Rev Cardiol. déc 2015;12(12):689-710.
3. Delwarde C, Capoulade R, Mérot J, Le Scouarnec S, Bouatia-Naji N, Yu M, et al. Genetics and pathophysiology of mitral valve prolapse. Front Cardiovasc Med. 16 févr 2023;10:1077788.
4. El SA, Reddy YNV, Nishimura RA. Mitral Valve Regurgitation in the Contemporary Era. JACC Cardiovasc Imaging. avr 2018;11(4):628-43.
5. Vahanian A, Beyersdorf F, Praz F, Milojevic M, Baldus S, Bauersachs J, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease: Developed by the Task Force for the management of valvular heart disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 14 févr 2022;43(7):561-632.
6. Lancellotti P, Pibarot P, Chambers J, La Canna G, Pepi M, Dulgheru R, et al. Multi-modality imaging assessment of native valvular regurgitation: an EACVI and ESC council of valvular heart disease position paper. Eur Heart J - Cardiovasc Imaging. 1 mai 2022;23(5):e171-232.
7. Clinical Outcome of Degenerative Mitral Regurgitation [Internet]. [cité 27 janv 2025]. Disponible sur : https://www.ahajournals.org/doi/epub/10.1161/CIRCULATIONAHA.117.033173
8. Enriquez-Sarano M, Avierinos JF, Messika-Zeitoun D, Detaint D, Capps M, Nkomo V, et al. Quantitative Determinants of the Outcome of Asymptomatic Mitral Regurgitation. N Engl J Med. 3 mars 2005;352(9):875-83.
9. Tribouilloy C, Grigioni F, Avierinos JF, Barbieri A, Rusinaru D, Szymanski C, et al. Survival Implication of Left Ventricular End-Systolic Diameter in Mitral Regurgitation Due to Flail Leaflets. J Am Coll Cardiol. 17 nov 2009;54(21):1961-8.
10. Enriquez-Sarano M, Tajik AJ, Schaff HV, Orszulak TA, Bailey KR, Frye RL. Echocardiographic prediction of survival after surgical correction of organic mitral regurgitation. Circulation. août 1994;90(2):830-7.
11. Rusinaru D, Tribouilloy C, Grigioni F, Avierinos JF, Suri RM, Barbieri A, et al. Left Atrial Size Is a Potent Predictor of Mortality in Mitral Regurgitation Due to Flail Leaflets. Circ Cardiovasc Imaging. sept 2011;4(5):473-81.
12. Essayagh B, Antoine C, Benfari G, Messika -Zeitoun David, Michelena H, Le TT, et al. Prognostic Implications of Left Atrial Enlargement in Degenerative Mitral Regurgitation. J Am Coll Cardiol. 20 août 2019;74(7):858-70.
13. Grigioni F, Benfari G, Vanoverschelde JL, Tribouilloy C, Avierinos JF, Bursi F, et al. Long-Term Implications of Atrial Fibrillation in Patients With Degenerative Mitral Regurgitation. J Am Coll Cardiol. 29 janv 2019;73(3):264-74.
14. Mentias A, Patel K, Patel H, Gillinov AM, Sabik JF, Mihaljevic T, et al. Effect of Pulmonary Vascular Pressures on Long-Term Outcome in Patients With Primary Mitral Regurgitation. J Am Coll Cardiol. 28 juin 2016;67(25):2952-61.
15. Van WAL, Mantegazza V, Hiemstra YL, Volpato V, van der BP, Pepi M, et al. Prognostic Impact of Extra–Mitral Valve Cardiac Involvement in Patients With Primary Mitral Regurgitation. JACC Cardiovasc Imaging. juin 2022;15(6):961-70.
16. Toubal O, Mahjoub H, Thébault C, Clavel MA, Dahou A, Magne J, et al. Increasing Pulmonary Arterial Pressure at Low Level of Exercise in Asymptomatic, Organic Mitral Regurgitation. J Am Coll Cardiol. 13 févr 2018;71(6):700-1.
17. Messika -Zeitoun David, Johnson BD, Nkomo V, Avierinos JF, Allison TG, Scott C, et al. Cardiopulmonary Exercise Testing Determination of Functional Capacity in Mitral Regurgitation. J Am Coll Cardiol. 20 juin 2006;47(12):2521-7.
18. A C, S A, E G, S M, M R, D D, et al. Prognostic values of exercise echocardiography and cardiopulmonary exercise testing in patients with primary mitral regurgitation. Eur Heart J Cardiovasc Imaging [Internet]. 20 oct 2022 [cité 19 janv 2025];23(11).
Disponible sur: https://pubmed.ncbi.nlm.nih.gov/34751769/
19. Coisne A, Lancellotti P, Habib G, Garbi M, Dahl JS, Barbanti M, et al. ACC/AHA and ESC/EACTS Guidelines for the Management of Valvular Heart Diseases. J Am Coll Cardiol. 22 août 2023;82(8):721-34.
20. Zilberszac R, Heinze G, Binder T, Laufer G, Gabriel H, Rosenhek R. Long-Term Outcome of Active Surveillance in Severe But Asymptomatic Primary Mitral Regurgitation. JACC Cardiovasc Imaging. sept 2018;11(9):1213-21.
21. Suri RM, Vanoverschelde JL, Grigioni F, Schaff HV, Tribouilloy C, Avierinos JF, et al. Association Between Early Surgical Intervention vs Watchful Waiting and Outcomes for Mitral Regurgitation Due to Flail Mitral Valve Leaflets. JAMA. 14 août 2013;310(6):609-16.
22. Comparison of Early Surgery Versus Conventional Treatment in Asymptomatic Severe Mitral Regurgitation [Internet]. [cité 27 janv 2025]. Disponible sur : https://www.ahajournals.org/doi/epub/10.1161/CIRCULATIONAHA.108.802314
23. Chambers JB, Prendergast B, Iung B, Rosenhek R, Zamorano JL, Piérard LA, et al. Standards defining a « Heart Valve Centre »: ESC Working Group on Valvular Heart Disease and European Association for Cardiothoracic Surgery Viewpoint. Eur Heart J. 21 juill 2017;38(28):2177-83.
24. Hausleiter J, Stocker TJ, Adamo M, Karam N, Swaans MJ, Praz F. Mitral valve transcatheter edge-to-edge repair [Internet]. [cité 16 févr 2025]. Disponible sur : https://eurointervention.pcronline.com/article/mitral-valve-transcatheter-edge-to-edge-repair
25. Scotti A, Munafò A, Margonato A, Godino C. Transcatheter therapies for secondary mitral regurgitation in advanced heart failure: what are we aiming for? Heart Fail Rev. 2022;27(4):1193-200.

Pr Augustin COISNE
PUPH, CHU de Lille

