Une nouvelle définition du syndrome de détresse respiratoire aiguë
Michael A. Matthay, Yaseen Arabi, Alejandro C. Arroliga, Gordon Bernard, Andrew D. Bersten, Laurent J. Brochard, Carolyn
S. Calfee, Alain Combes, Brian M. Daniel, Niall D. Ferguson, Michelle N. Gong, Jeffrey E. Gotts, Margaret S. Herridge, John
G. Laffey, Kathleen D. Liu, Flavia R. Machado, Thomas R. Martin, Danny F. McAuley, Alain Mercat, Marc Moss, Richard
A. Mularski, Antonio Pesenti, Haibo Qiu, Nagarajan Ramakrishnan, V. Marco Ranieri, Elisabeth D. Riviello, Eileen Rubin, Arthur S. Slutsky, B. Taylor Thompson, Theogene Twagirumugabe, Lorraine B. Ware, and Katherine D. Wick
Le syndrome de détresse respiratoire aiguë (SDRA) est une insuffisance respiratoire aiguë hypoxique attribuable à un œdème lésionnel pulmonaire sans défaillance cardiaque. Il a d'abord été décrit en 1967 (1), puis la définition a été modifiée à plusieurs reprises afin d'identifier les patients avec des caractéristiques les plus similaires possibles. La « définition de Berlin » datant de 2012 (2, 3) est celle utilisée actuellement et représente une avancée majeure même si elle a quelques limites. En particulier, les données sur l'utilisation de la ventilation invasive ou de la ventilation non invasive n'y ont pas été détaillées (4). Cette définition a donc évolué et a été élargie au fi l du temps avec le monitorage du SDRA par l'oxymétrie de pouls (plutôt que la PaO2) (5, 6) et l'oxygénothérapie à haut débit (étude FLORALI (7)) dont l'utilisation s'est généralisée pendant la pandémie à COVID 19 (8, 9). Elle présente également des limites puisque la radiographie thoracique, les gaz du sang et la ventilation mécanique ne sont pas disponibles dans tous les pays (10). Face à ces changements de pratique, la définition du SDRA a été mise à jour en juin 2021 par une conférence de consensus internationale.
Méthodes
La conférence de consensus a réuni un comité de 32 experts internationaux en soins critiques entre juin 2021 et mars 2022 au cours de 6 réunions en visioconférence.
Trois domaines majeurs de révision potentielle de la définition de Berlin ont été abordés : 1) les facteurs de risque, la temporalité, et l'atteinte d'organes extra pulmonaires, 2) la radiographie thoracique, 3) l'oxygénothérapie.
Des données comprenant des études récentes et des études observationnelles ont été utilisées à partir de la base de données PubMed (5, 6, 8, 10-12).
Après une discussion en commission et un vote, les recommandations du groupe de travail ont été incorporées afin de mettre à jour la définition du SDRA.
Résultats
La nouvelle définition du SDRA est présentée dans le tableau 1 et les mises à jour de la définition de Berlin dans le tableau 2. La figure 1 représente une illustration de la nouvelle définition du SDRA.
Facteurs de risque, temporalité, atteinte des organes extra pulmonaires
Le délai d'une semaine entre une « agression pulmonaire » (infection, traumatisme, brûlure, …) et la survenue du SDRA a été maintenu pour le diagnostic. En effet, l'introduction de l'OHD pourrait induire une forme plus indolente de SDRA, d'où l'intérêt de maintenir ce délai à 1 semaine plutôt que de la réduire.
Radiographie thoracique Les opacités bilatérales non expliquées par un épanchement pleural, une atélectasie ou une masse pulmonaire à la radiographie thoracique restent un critère obligatoire. Même si la reproductibilité de l'interprétation entre chaque lecteur est faible (13), elle reste l'imagerie la plus couramment utilisée chez les patients graves. L'échographie thoracique est retenue comme une méthode diagnostique supplémentaire pour identifier les condensations bilatérales d'origine non cardiogénique, en particulier lorsque la radiographie et le scanner thoracique ne sont pas disponibles (14-16). Cet examen est considéré comme fiable avec un opérateur formé.
Oxygénothérapie
Le groupe d'expert a étendu la définition du SDRA à trois catégories de patients : SDRA intubé, SDRA non intubé (incluant les patients sous VNI ou OHD) et SDRA pour les pays à ressources sanitaires limitées (tableau 1 et figure 1). L'utilisation de l'OHD a augmenté depuis l'étude FLORALI (7) et en particulier lors de la pandémie à COVID-19. De plus, 93 % des patients atteints de COVID-19 sous OHD ont toujours les critères de SDRA après intubation et le traitement par ventilation mécanique et PEEP. Par ailleurs, la mortalité de ces patients sous OHD seule est plus faible que les patients intubé et similaire à ceux sous VNI (8).
De plus, le rapport SpO2/FiO2, performant à partir d'une SpO2 inférieure à 97 %, a été validé comme alternative au rapport PaO2/FiO2 (5, 17). En effet, les gaz du sang ont une disponibilité limitée certains pays sous-développés et sont de moins en moins utilisés dans les pays les plus développés.
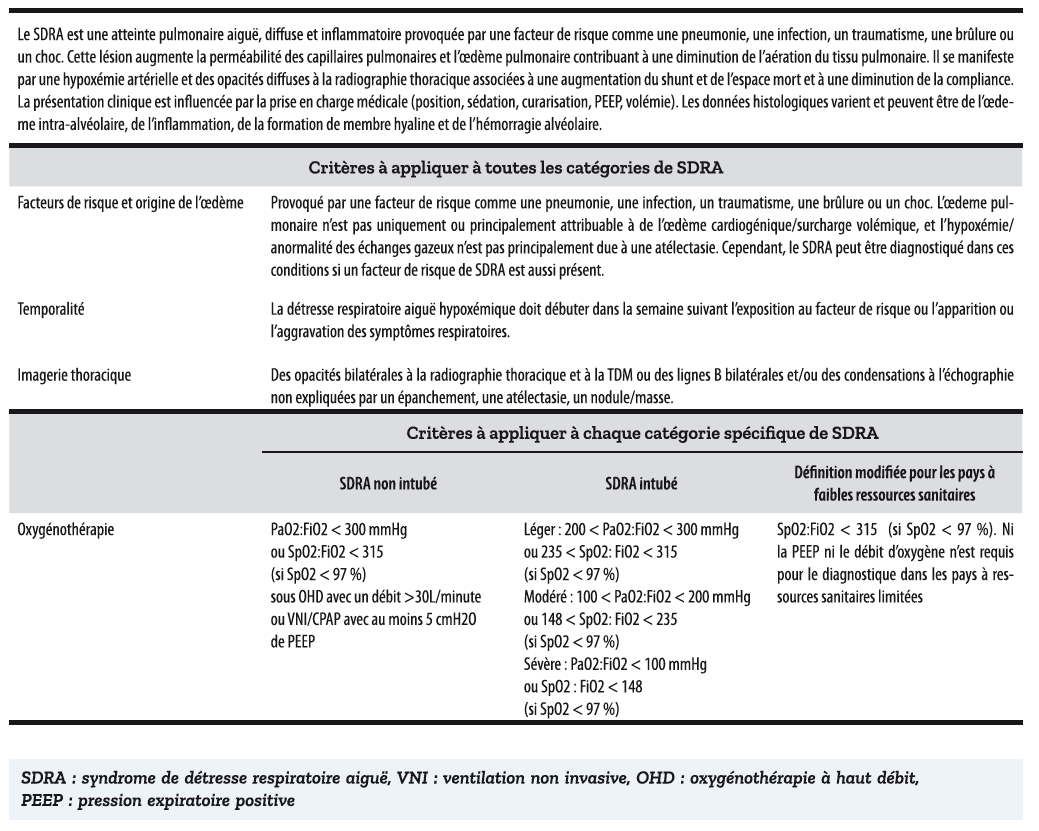
Tableau 1 : Critères diagnostique de la nouvelle définition du SDRA

Tableau 2 : Résumé des principales différences entre le nouvelle définition du SDRA et la définition de Berlin réunies avec la mise à jour des critères diagnostiques spécifiques.
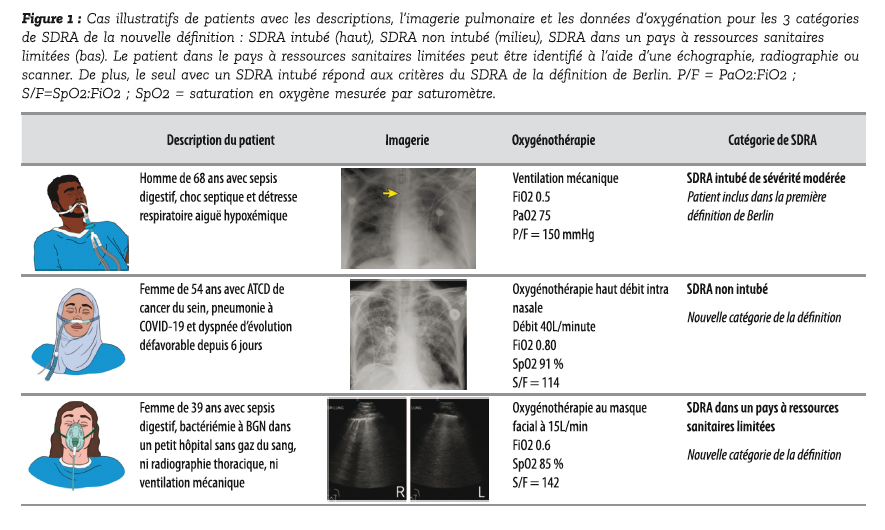
Figure 1 : Cas illustratifs de patients avec les descriptions, l'imagerie pulmonaire et les données d'oxygénation pour les 3 catégories de SDRA de la nouvelle définition : SDRA intubé (haut), SDRA non intubé (milieu), SDRA dans un pays à ressources sanitaires limitées (bas). Le patient dans le pays à ressources sanitaires limitées peut être identifié à l'aide d'une échographie, radiographie ou scanner. De plus, le seul avec un SDRA intubé répond aux critères du SDRA de la définition de Berlin. P/F = PaO2:FiO2 ; S/F=SpO2:FiO2 ; SpO2 = saturation en oxygène mesurée par saturomètre.
Discussion
Ces modifications de la définition de Berlin s'expliquent devant l'absence de biomarqueurs fiables ou de résultats histologiques cohérents du SDRA nécessitant un ajustement de la prise en charge des patients dans le temps (18-20). Une étude prospective, incluant 6 centres universitaires, sur les caractéristiques cliniques et biologiques du SDRA, de la pneumonie et du sepsis a été réalisée (21).
Concernant les patients dans la catégorie non intubé sous OHD, le seuil du débit de d'oxygénothérapie a été établi à 30L/minute afin de fournir de faibles niveaux de PEEP (22).
Le groupe destiné aux pays à ressources sanitaires limitées a été créé une nouvelle catégorie en l'absence de VNI et OHD disponible et afin de leur permettre d'utiliser tout autre dispositif d'oxygénothérapie.
Limites
Il n'existe par de test prospectif sur la validité du rapport du seuil SpO2/ FiO2 dans les SDRA non intubés. De plus, le retrait de la PEEP et l'utilisation de l'échographie pourraient induire à un diagnostic faussement positif du SDRA en particulier dans les pays à ressources limitées.
Conclusion
La mise à jour de la définition de Berlin du SDRA permet d'inclure les patients sous OHD à un débit supérieure à 30L/minute, l'oxymètre de pouls peut remplacer la réalisation de gaz du sang lorsque ceux-ci ne sont pas disponibles et l'échographie peut remplacer la radiographie ou le scanner thoracique. Les patients issus de pays à ressource limitées ne sont plus exclus de la définition du SDRA afin de pouvoir les intégrer à la recherche clinique et épidémiologique.

Emilie KLEIN
Docteur Junior
CHU de Bordeaux
Relecture
Dr Thibaud SOUMAGNE
Pneumologue à l'hôpital Européen Georges Pompidou (APHP)
1. Ashbaugh DavidG, Boyd Bigelow D, Petty ThomasL, Levine BernardE. ACUTE RESPIRATORY DISTRESS IN ADULTS.
The Lancet. août 1967;290(7511):319-23.
2. Acute Respiratory Distress Syndrome: The Berlin Definition. JAMA [Internet]. 20 juin 2012 [cité 13 oct 2024];307(23). Disponible sur : http://jama.jamanetwork.com/ article.aspx?doi=10.1001/jama.2012.5669
3. Ferguson ND, Fan E, Camporota L, Antonelli M, Anzueto A, Beale R, et al. The Berlin definition of ARDS: an expanded rationale, justification, and supplementary material.
Intensive Care Med. oct 2012;38(10):1573-82.
4. Angus DC. The Acute Respiratory Distress Syndrome: What's in a Name? JAMA [Internet]. 20 juin 2012 [cité 13 oct 2024];307(23). Disponible sur: http://jama.jamanetwork.com/ article.aspx?doi=10.1001/jama.2012.6761
5. Rice TW, Wheeler AP, Bernard GR, Hayden DL, Schoenfeld DA, Ware LB. Comparison of the Sp o 2 /F io 2 Ratio and the Pa o 2 /F io 2 Ratio in Patients With Acute Lung Injury or ARDS. Chest. août 2007;132(2):410-7.
6. Wick KD, Matthay MA, Ware LB. Pulse oximetry for the diagnosis and management of acute respiratory distress syndrome. The Lancet Respiratory Medicine.
nov 2022;10(11):1086-98.
7. Frat JP, Thille AW, Mercat A, Girault C, Ragot S, Perbet S, et al. High-Flow Oxygen through Nasal Cannula in Acute Hypoxemic Respiratory Failure. N Engl J Med.
4 juin 2015;372(23):2185-96.
8. Ranieri VM, Tonetti T, Navalesi P, Nava S, Antonelli M, Pesenti A, et al. High-Flow Nasal Oxygen for Severe Hypoxemia: Oxygenation Response and Outcome in Patients with COVID-19. Am J Respir Crit Care Med. 15 févr 2022;205(4):431-9.
9. Calligaro GL, Lalla U, Audley G, Gina P, Miller MG, Mendelson M, et al. The utility of high-fl ow nasal oxygen for severe COVID-19 pneumonia in a resource-constrained setting: A multi-centre prospective observational study.
EClinicalMedicine. nov 2020;28:100570.
10. Wooten WM, Shaffer LET, Hamilton LA. Bedside Ultrasound Versus Chest Radiography for Detection of Pulmonary Edema: A Prospective Cohort Study. J of Ultrasound Medicine. avr 2019;38(4):967-73.
11. Riviello ED, Kiviri W, Twagirumugabe T, Mueller A, Banner-Goodspeed VM, Offi cer L, et al. Hospital Incidence and Outcomes of the Acute Respiratory Distress Syndrome Using the Kigali Modification of the Berlin Definition.
Am J Respir Crit Care Med. 1 janv 2016;193(1):52-9.
12. Hernu R, Wallet F, Thiollière F, Martin O, Richard JC, Schmitt Z, et al. An attempt to validate the modification of the American-European consensus definition of acute lung injury/acute respiratory distress syndrome by the Berlin definition in a university hospital. Intensive Care
Med. déc 2013;39(12):2161-70.
13. Rubenfeld GD, Caldwell E, Granton J, Hudson LD, Matthay MA. Interobserver Variability in Applying a Radiographic Definition for ARDS. Chest. nov 1999;116(5):1347-53.
14. Lichtenstein D, Goldstein I, Mourgeon E, Cluzel P, Grenier P, Rouby JJ. Comparative Diagnostic Performances of Auscultation, Chest Radiography, and Lung Ultrasonography in Acute Respiratory Distress Syndrome. Anesthesiology.
1 janv 2004;100(1):9-15.
15. Copetti R, Soldati G, Copetti P. Chest sonography: a useful tool to differentiate acute cardiogenic pulmonary edema from acute respiratory distress syndrome. Cardiovasc Ultrasound. avr 2008;6(1):16.
16. International Liaison Committee on Lung Ultrasound (ILC-LUS) for the International Consensus Conference on Lung Ultrasound (ICC-LUS), Volpicelli G, Elbarbary M, Blaivas M, Lichtenstein DA, Mathis G, et al. International evidence-based recommendations for point-of-care lung ultrasound. Intensive Care Med. avr 2012;38(4):577-91.
17. Brown SM, Grissom CK, Moss M, Rice TW, Schoenfeld D, Hou PC, et al. Nonlinear Imputation of Pao2/Fio2 From Spo2/Fio2 Among Patients With Acute Respiratory Distress Syndrome. CHEST. août 2016;150(2):307-13.
18. Cardinal-Fernández P, Lorente JA, Ballén-Barragán A, Matute-Bello G. Acute Respiratory Distress Syndrome and Diffuse Alveolar Damage. New Insights on a Complex Relationship. Annals ATS. juin 2017;14(6):844-50.
19. Thompson BT, Matthay MA. The Berlin Definition of ARDS versus Pathological Evidence of Diffuse Alveolar Damage.
Am J Respir Crit Care Med. 1 avr 2013;187(7):675-7.
20. Guerin C, Bayle F, Leray V, Debord S, Stoian A, Yonis H, et al. Open lung biopsy in nonresolving ARDS frequently identifies diffuse alveolar damage regardless of the severity stage and may have implications for patient management. Intensive Care Med. févr 2015;41(2):222-30.
21. Herridge MS, Azoulay É. Outcomes after Critical Illness.
Hardin CC, éditeur. N Engl J Med. 9 mars 2023;388(10):913-24.
22. Groves N, Tobin A. High flow nasal oxygen generates positive airway pressure in adult volunteers. Australian Critical Care. nov 2007;20(4):126-31.

