
Syndrome néphrotique et sca chez l'enfant
Introduction
Le syndrome néphrotique se définit par une protéinurie massive (supérieure à3 grammes/jour) associée à une hypo-albuminémie (inférieure à30g/L). Il est responsable d'oedèmes, d'hyperlipidémie et de complications thromboemboliques le plus souvent veineuses.
Le cause la plus fréquente de syndrome néphrotique chez l'enfant est le syndrome néphrotique idiopathique (SNI). C'est un motif fréquent de consultation en néphro-pédiatrie avec une incidence annuelle estimée à 1-4 pour 100 000 enfants (1).
La pathologie peut débuter à tout âge, notamment in-utéro, mais plus généralement entre 2 et 7 ans. Le début de la maladie est souvent brutal avec d'importants oedèmes notamment du visage. Le SNI peut être une poussée unique ou multi-récidivant.
La physiopathologie du SNI est complexe et non clairement élucidée, elle repose sur l'existence d'un facteur circulant qui serait responsable de l'augmentation de la perméabilité de la barrière de filtration glomérulaire. Cette origine immunologique explique le développement des immunosuppresseurs comme possibilité thérapeutique dans cette pathologie en deuxième ligne. Cependant, le traitement actuel repose en première intention sur la corticothérapie systémique qui permet une restauration de la volémie et donc une diminution du syndrome oedémateux et de l'oligurie.
En fonction de la réponse aux corticoïdes, on peut définir les patients cortico-sensibles (90-95 % des patients) dont 50 % sont cortico-dépendants et les patients cortico-résistants.
Présentation du cas clinique
Un patient âgé de 16 ans se présente aux urgences pour des céphalées associées à des troubles visuels depuis 24h dans un contexte de rechute récente de syndrome néphrotique.
Il est suivi depuis l'âge de 24 mois pour un SNI cortico-dépendant avec de multiples rechutes mais il était contrôlé depuis 3 ans sous traitement immunosuppresseur (CELLCEPT) en monothérapie. La rechute actuelle intervient à 6 mois de l'arrêt progressif du traitement par CELLCEPT. Devant cette rechute avec symptômes cliniques, il est initié une corticothérapie à 60mg/jour et le patient est hospitalisé pour surveillance.
Vingt-quatre heures après le début de la corticothérapie, le patient présente une violente douleur thoracique rétrosternale constrictive irradiant dans le membre supérieur gauche persistante malgré une antalgie simple.
Un traitement par Trinitrine et Risordan est mis en place mais se solde par un échec.
Cliniquement, le patient reste stable sur le plan hémodynamique avec une pression artérielle à 130/70mmHg, une fréquence cardiaque à 89 bpm et une apyrexie.
Hormis la douleur, il n'existe aucun signe d'insuffisance ventriculaire gauche et aucun signe d'hypoperfusion périphérique. En revanche, on note des oedèmes des membres inférieurs, de l'ascite et des épanchements pleuraux.
Évaluation diagnostique
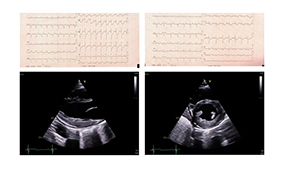
L'électrocardiogramme qualifiant déroule un rythme sinusal régulier avec sus-décalage du segment ST en latéral et en inférieur avec miroir antéro-septal.
L'échocardiographie retrouve une FEVG préservée à 50 % avec une franche hypokinésie de la paroi latérale, inféro-basale et inféromédiane.
Le premier dosage de troponines revient normalement à 43 ng/L.
La biologie met en évidence un syndrome néphrotique important avec une protéinurie sur échantillon à 92 g/L associé à une hypoalbuminémie profonde à 9 g/L.
Interventions
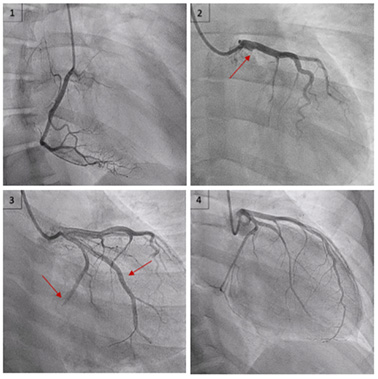
Devant des arguments forts pour un tableau de syndrome coronarien aigu, une coronarographie est réalisée.
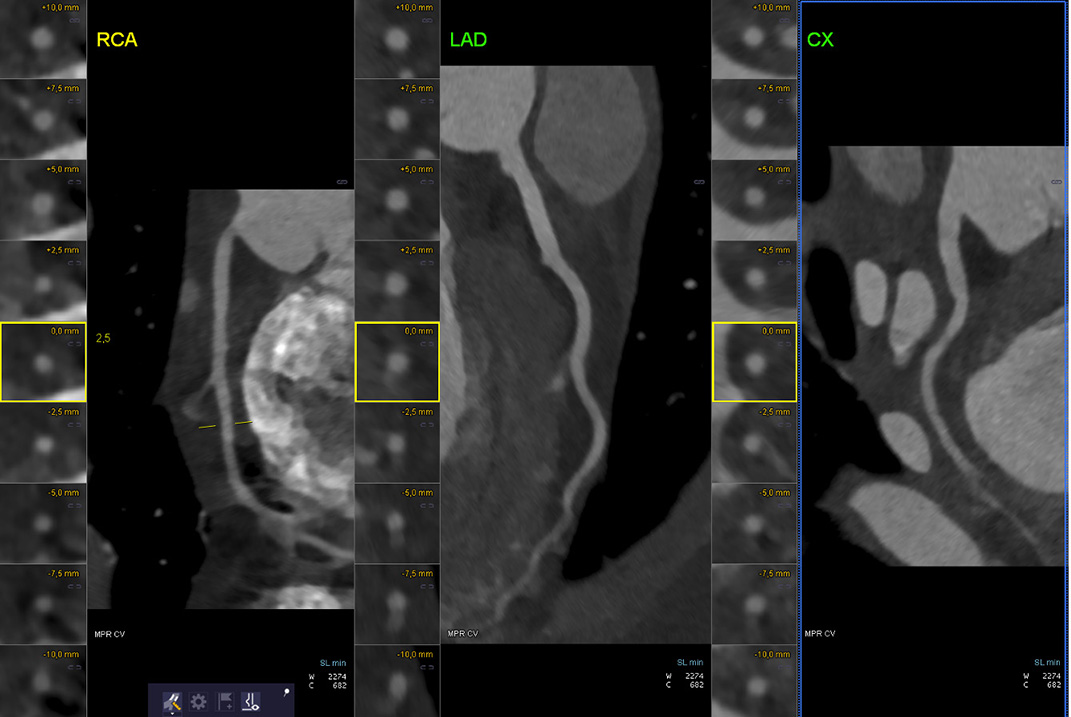
Cette dernière retrouve une lésion monotronculaire sur occlusion aiguë de l'artère circonflexe proximale d'allure thrombotique (image 1 et 2).
Une thrombectomie productive permet un succès de revascularisation sans pose de stent (image 3). Il existe malheureusement une embolisation distale dans l'artère circonflexe et dans la première artère marginale (image 4).
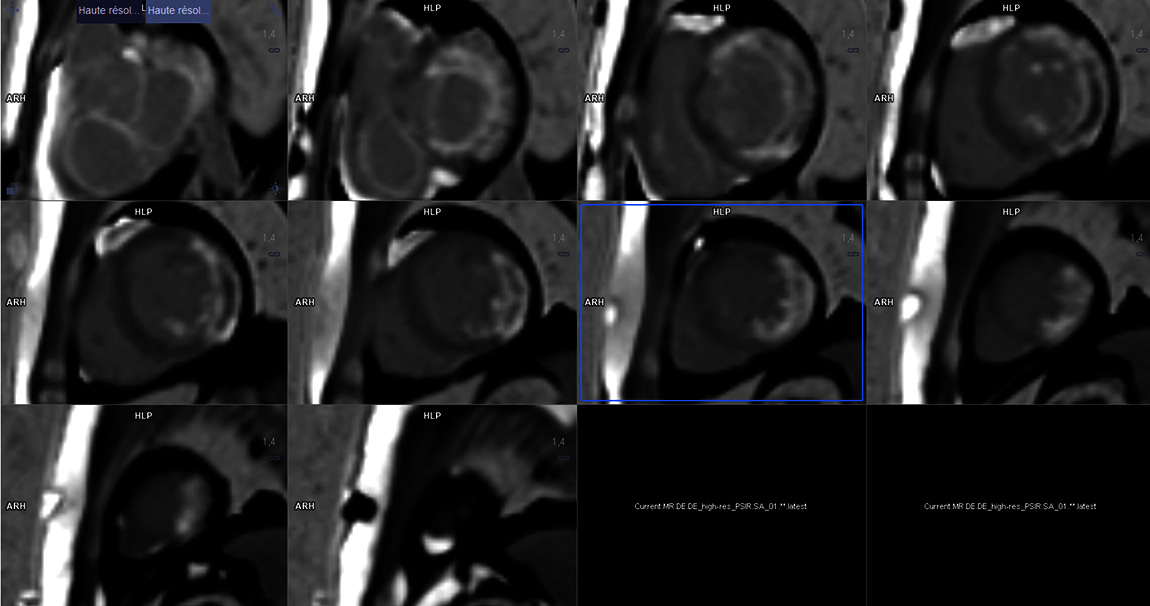
En raison d'une altération de la FEVG constatée dans les suites en ETT, une IRM myocardique objective une FEVG à 38 % et la présence d'une séquelle de nécrose transmurale sur 7 à 8 segments du territoire latéral débordant en antérieur et inférieur.
Le bilan lipidique réalisé après rémission du syndrome néphrotique retrouve un LDL cholestérol à 1,7 g/L.
Un traitement anti-thrombotique par Aspirine est donc débuté devant la séquelle de nécrose transmurale en IRM cardiaque. Un traitement par IEC et bétabloquant est également introduit tout comme un traitement hypolipémiant.
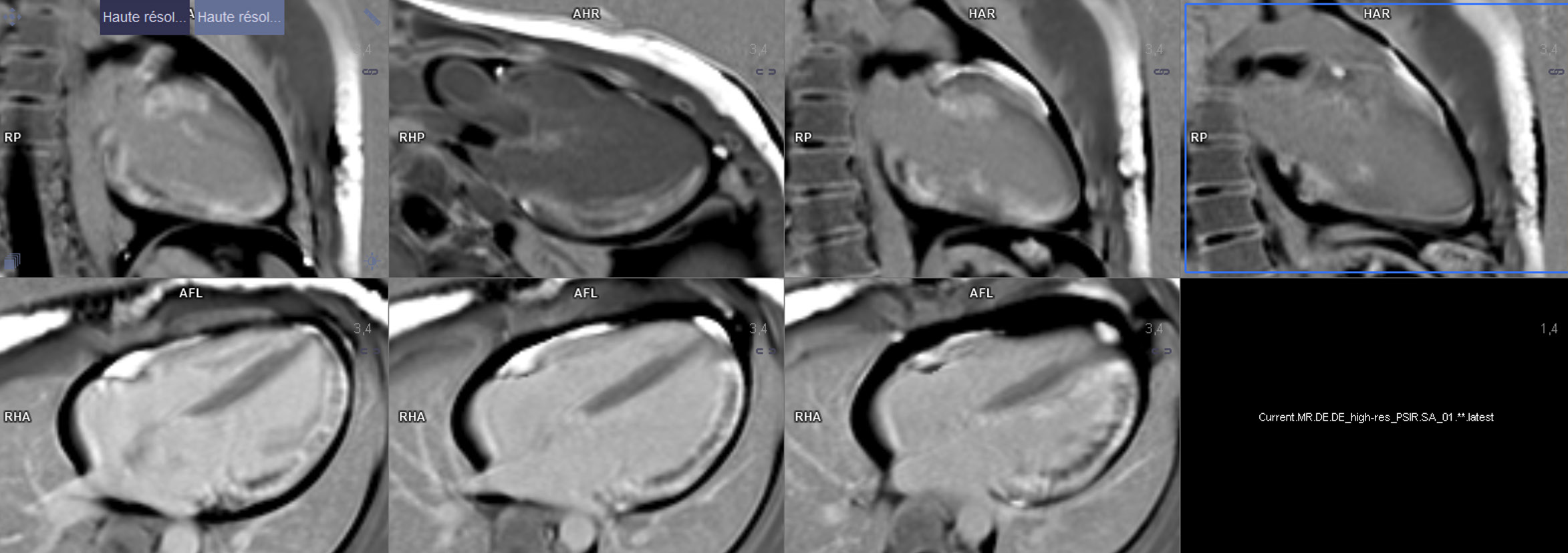
Une IRM cérébrale est réalisée devant le tableau neurologique initial comprenant des céphalées et des troubles visuels depuis 24h, et retrouve de multiples évènements ischémiques constitués récents avec les localisations suivantes : gyrus frontal supérieur gauche, operculaire et insulaire droit, punctiforme pariétal gauche, punctiforme cérébelleux inférieur droit. La multiplicité des événements ischémiques dans les territoires artériels différents fait évoquer en premier lieu une origine cardio-embolique, ce qui expliquerait également l'embolisation coronaire.
Un bilan exhaustif de pathologie cardio-embolique est réalisé et un scanner cardiaque retrouve une auricule gauche libre de thrombus (pas d'argument pour une fibrillation atriale) avec des artères coronaires d'implantation physiologique et un score calcique nul, ce qui écarte à priori un processus athérosclérotique.
La rémission du syndrome néphrotique est obtenue après 8 jours d'une corticothérapie à 60 mg/jour associé à la reprise du traitement par CELLCEPT. Devant une hypovolémie relative responsable d'un syndrome oedémateux majeur, le patient a bénéficié de plusieurs perfusions d'albumine IV.
Le dossier a été discuté en RCP nationale. Devant la gravité du tableau et la rechute précoce à l'arrêt du CELLCEPT, il a été décidé d'initier un traitement par RITUXIMAB (375mg/m2) avec décroissance de la corticothérapie et arrêt du CELLCEPT. Nous avons réalisé un bilan immunologique devant ce SNI mais qui reviendra négatif.
Suivi du patient
Lors du suivi à 3 semaines, le patient est resté asymptomatique sur le plan cardiologique et néphrologique.
Il n'existe plus d'oedèmes à l'examen clinique avec une perte de 8 kg et un retour à un poids de base. Le bilan biologique de contrôle est également normal.
L'échocardiographie retrouve une FEVG en amélioration à 50-55 % avec toutefois la persistance d'une hypokinésie latérale et inférieure.
L'électrocardiogramme déroule un rythme sinusal à 71bpm avec un aspect de bloc de branche droit incomplet et une onde Q minime en latéral haut.
Une IRM myocardique de contrôle a été réalisée à 3 mois et objective une amélioration de la FEVG à 47 % malgré les séquelles transmurales persistantes.
Discussion
Le syndrome néphrotique est donc à l'origine d'un tableau d'embolies artérielles multiples (2). Il s'agit à notre connaissance du seul cas décrit en France de syndrome néphrotique présentant une complication artérielle cardiaque.
Ces emboles ont été favorisées par une hypoalbuminémie profonde reconnue comme un des facteurs de risque majeur de thrombose veineuse et artérielle (3, 4). Les pertes urinaires de facteurs anticoagulants comme l'anti-thrombine III et la protéine S et la synthèse de facteurs procoagulants comme le facteur V, le facteur VIII et le fibrinogène provoquent un état d'hypercoagulabilité (5).
L'anticoagulation curative est donc nécessaire afin d'éviter les récidives. La durée de cette dernière est une question cruciale. D'une part, une anticoagulation curative efficace est indispensable, au minimum jusqu'à rémission du syndrome néphrotique. Et d'autre part, il existe un tableau récent de syndrome coronarien aigu sur thrombose de l'artère circonflexe proximale motivant possiblement un prolongement du traitement anticoagulant ainsi que l'ajout d'un antiagrégant plaquettaire.
Finalement, une bithérapie par Aspirine et HBPM est mise en place suite à la coronarographie, rapidement relayée par une monothérapie par HBPM avec relai Antivitamine K (6).
Les Antivitamines K sont les seules molécules ayant prouvées leur efficacité dans ces contextes (7). En effet, peu importe la localisation de la thrombose artérielle, les anti-vitamines K sont efficaces, les AOD n'ont quant à eux aucunement prouvé leur efficacité.
Il existe malgré tout une difficulté supplémentaire d'équilibrer les INR en raison d'anomalies pharmacocinétiques.
En effet, la liaison à l'albumine étant diminuée du fait de l'hypoalbuminémie, on assiste à une augmentation de la forme libre (8).
De manière concomitante, une diminution du LDL cholestérol en prévention secondaire est discutée. Une réunion pluridisciplinaire entre cardiopédiatres, cardiologues interventionnels et néphrologues tranche en faveur de l'initiation d'un traitement par Atorvastatine.
Le LDL cholestérol cible à la suite à un syndrome coronarien aigu est de 0,55 g/L. Une surveillance armée des CPK devra être réalisée devant le risque accru de rhabdomyolyse.
Concernant le traitement du syndrome néphrotique, la rémission complète est maintenue sous corticothérapie et reprise du CELLCEPT. Il a été décidé en RCP nationale de relayer le traitement immunosuppresseur par RITUXIMAB avec monitorage des lymphocytes CD20+, pour le rythme des perfusions. Le CELLCEPT a été stoppé dès que la déplétion des lymphocytes B a été réalisée par anti-CD20 (9,10) et la corticothérapie arrêtée de manière progressive sur 1 mois.
Suite à une rémission complète du syndrome néphrotique, l'anticoagulation est stoppée de manière définitive au profit d'Aspirine seule au vu du syndrome coronarien aigu récent.
Les syndromes coronariens aigus de l'enfant sont une entité rare mais avec de multiples étiologies (11,12).
Le syndrome néphrotique en faisant partie intégrante.
Conclusion
Il s'agit donc d'un rare cas de rechute d'un syndrome néphrotique idiopathique compliqué de multiples embolies artérielles. L'occlusion de l'artère circonflexe d'origine thrombo-embolique chez un enfant de 16 ans n'a jamais été observée auparavant. Un traitement efficace à la fois étiologique et symptomatique du syndrome néphrotique idiopathique est nécessaire afin de limiter au mieux les complications. Une surveillance cardiologique s'impose également en cas de SNI déséquilibré afin de dépister au plus vite d'éventuelles complications potentiellement graves.
Auteur

Thibaut POMMIER
CHU de Dijon
Caroline GHANIMÉ,
Mehdi GHEMRANI
Références
1. Masson E. Syndrome néphrotique chez l'enfant. EM-Consulte. Accessed June.
3, 2023. https://www.em-consulte.com/article/179611/syndrome-nephrotique-chez-l-enfant.
2. Kerlin BA, Ayoob R, Smoyer WE. Epidemiology and pathophysiology of nephrotic syndrome-associated thromboembolic disease. Clin J Am Soc Nephrol CJASN. 2012;7(3):513-520. doi:10.2215/CJN.10131011.
3. Gigante A, Barbano B, Sardo L, et al. Hypercoagulability and nephrotic syndrome.
Curr Vasc Pharmacol. 2014;12(3):512-517. doi:10.2174/157016111203 140518172048.
4. Kaizu K, Etoh S. Nephrotic syndrome and anticoagulant therapy. Intern Med Tokyo Jpn. 1998;37(2):210-212. doi:10.2169/internalmedicine.37.210.
5. Kanfer A. Coagulation factors in nephrotic syndrome. Am J Nephrol. 1990;10 Suppl 1:63-68. doi:10.1159/000168196.
6. Chen D. Heparin beyond anti-coagulation. Curr Res Transl Med.
2021;69(4):103300. doi:10.1016/j.retram.2021.103300
7. Hemker HC, Béguin S. [Thrombosis and thrombin]. Ann Pharm Fr.
1992;50(3):121-135.
8. El-Helou N, Al-Hajje A, Ajrouche R, et al. Adverse drug events associated with vitamin K antagonists: factors of therapeutic imbalance. Vasc Health Risk Manag. 2013;9:81-88. doi:10.2147/VHRM.S41144.
9. Dossier C, Prim B, Moreau C, et al. A global antiB cell strategy combining obinutuzumab and daratumumab in severe pediatric nephrotic syndrome. Pediatr Nephrol Berl Ger. 2021;36(5):1175-1182. doi:10.1007/s00467-020-04811-0.
10. Basu B, Angeletti A, Islam B, Ghiggeri GM. New and Old Anti-CD20 Monoclonal Antibodies for Nephrotic Syndrome. Where We Are? Front Immunol. 2022;13:805697. doi:10.3389/fimmu.2022.805697.
11. Dymnicka S, Tomaszewski M, Aleszewicz J, Bielińska B. [Myocardial infarction in children]. Pol Tyg Lek Wars Pol 1960. 1995;50(36-39):58-61.
12. Reich JD, Campbell R. Myocardial infarction in children. Am J Emerg Med.1998;16(3):296-303. doi:10.1016/s0735-6757(98)90107-3.

