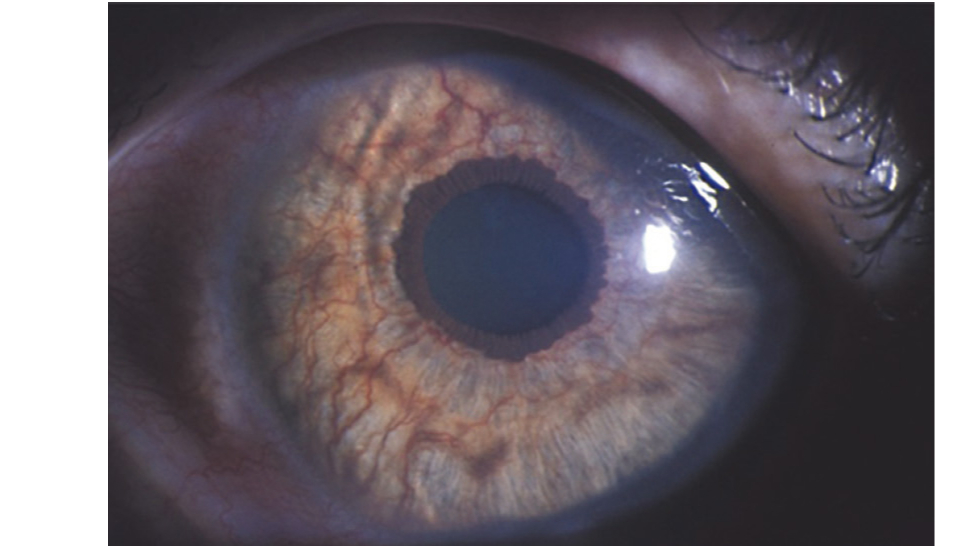
Myopie évolutive et myopie forte
La myopie est le trouble réfractif le plus fréquent dans le monde. Pour rappel, la myopie est caractérisée par un œil trop long pour sa puissance (myopie axile) ou trop puissant pour sa longueur (myopie d’indice). Les patients se plaindront d’une vision floue en VL et auront besoin d’une correction optique [1].
La myopie évolutive se caractérise par une évolution supérieure à 0,5D tous les 6 mois et/ou une progression de la longueur axiale de 0.2 mm tous les 6 mois [2].
On surveillera la progression de la myopie en effectuant un contrôle régulier de la réfraction du patient sous cycloplégique avec une biométrie pour surveiller l’évolution de la longueur axiale.
On conseillera dans un premier temps au patient de regarder fréquemment au loin durant le travail de près ainsi qu’une exposition à la lumière extérieure. [3]
Les traitements freinateurs de la myopie vont être :
- Verres freinateurs de la myopie.
- Orthokératologie (lentilles rigides portées seulement la nuit).
- L’instillation d’atropine diluée de 0,01%, 0,025% ou encore 0,05% (produite par le CHU Hôtel Dieu, Paris) [4,5].
On parlera de myopie forte lorsque la longueur axiale est supérieure à 26 mm et une réfraction supérieure à - 6D. Elle évolue sur plusieurs années se manifestant par une augmentation de la myopie accompagnée d’un allongement progressif du globe oculaire [6].
Les risques et complications de la myopie forte vont être :
- Néovaisseaux du myope fort.
- Atrophie [7].
- GPAO (glaucome primitif à angle ouvert).
- Cataracte précoce.
- Trou maculaire.
- Décollement de rétine [8]
Les examens nécessaires au suivi de la myopie seront :
- Un OCT maculaire montrant un amincissement rétinien.
- Un OCT du nerf optique.
- Une RNM : on pourra y retrouver des zones atrophiques [9].
Dans un trouble réfractif, il est entre autres possible de se faire opérer afin de ne plus porter de lunettes. Dans ce cas, l’ophtalmologiste proposera une chirurgie réfractive. Deux techniques sont envisageables :
- Laser excimer : Consiste en une abrasion d’une partie de l’épithélium cornéen, adapté dans le cadre de la myopie pour des troubles de 1 à 6 dioptries.
- Lasik : Consiste en la découpe d’un capot afin d’agir avec le laser sur le stroma, adapté dans le cadre des myopies jusqu’à 8-10 dioptries.
Afin d’envisager tout acte chirurgical, il est nécessaire de s’assurer que la myopie est stable [7].
Bibliographie
[1]. Soler V, Calvas P, Malecaze F. Rapport SFO 2019 : Les myopies ; 3
[2]. Yam JC, Jiang Y, Tang SM, Law AKP, Chan JJ, Wong E, Ko ST, Young AL, Tham CC, Chen LJ, Pang CP. Low-Concentration Atropine for Myopia Progression (LAMP) Study: A Randomized, Double-Blinded, Placebo-Controlled Trial of 0.05%, 0.025%, and 0.01% Atropine Eye Drops in Myopia Control. Ophthalmology. 2019 Jan;126(1):113-124. doi: 10.1016/ j.ophtha.2018.05.029. Epub 2018 Jul 6. PMID: 30514630
[3]. Milazzo S, Badguerahanian. Rapport SFO 2019 : Les myopies ; 17
[4]. Sauer A, Speeg-Schatz C. Rapport SFO 2019 : Les myopies ; 12
[5]. Ji-Sun Moon 1 , Sun Young Shin 2 The diluted atropine for inhibition of myopia progression in Korean children Int J Ophthalmol. 2018 Oct 18;11(10):1657-1662. doi: 10.18240/ ijo.2018.10.13. eCollection 2018
[6]. Chiquet C. Collège des Ophtalmologistes Universitaires de France (COUF) ; 49
[7]. Sauer A. Rapport SFO 2019 : Les myopies ; 10
[8]. Syndicat National des Ophtalmologistes de France (SNOF). Encyclopédie de la vue : chirurgie de la myopie
[9]. Delyfer M-N. Rapport SFO 2019 : Les myopies ; 79-80
Kératocône
Il s’agit d’une dystrophie d’origine mécanique qui entraîne une modification structurelle de la cornée caractérisée par sa déformation et accompagnée de son amincissement.
La cornée tend à prendre une forme conique. [1] Le kératocône entraîne un astigmatisme et souvent une myopie. L’astigmatisme est d’axe variable et au fur et à mesure de son évolution ne sera plus corrigeable de manière optimale par une correction optique. [2] Généralement, le kératocône est excentré en inférieur, c’est-à-dire que le point pachymétrique le plus fin est situé en inférieur de la cornée. [1]
Le kératocône peut être associé à d’autres pathologies ou syndromes tels que la trisomie 21, les terrains atopiques et/ou allergiques (conjonctivite printanière…) [3].
Signes fonctionnels :
- Sensation de BAV en VL accompagnée d’une impression de brouillard visuel et de déformation des images.
- Photophobie [4].
- Douleur oculaire et/ou palpébrale.
Examens complémentaires :
- Topographie cornéenne : permet de voir le type d’astigmatisme (régulier ou irrégulier) et de suivre son évolution en se basant sur la kératométrie.
- Pachymétrie : épaisseur cornéenne restante et objective l’amincissement avec le temps [1].
On classe les kératocônes en 5 stades, de I (stade infra-clinique) à V (stade le plus évolué) selon l’atteinte des couches cornéennes, définis selon l’acuité visuelle du patient, ses plaintes, la pachymétrie… [1, 5].
Selon le stade auquel le patient est, le traitement proposé diffère :
- Lentilles rigides.
- Cross-linking : dans un but de stopper la progression du kératocône.
- Anneau intra-cornéen : dans un but réfractif (sur l’astigmatisme), il n’impacte pas l’évolution du kératocône.
- Greffes : entre autres via la kératoplastie transfixiante consistant en une greffe totale [6]
Post-it : on incite le patient à ne pas se frotter les yeux afin de ne pas contribuer à l’évolution du KC.
Figure 1. Cornée normale (à gauche) et Kératocône (à droite)
Bibliographie
[1]. Baudouin C, Labbé A, Touboul D. Rapport SFO 2019 : OCT en ophtalmologie ; 30
[2]. Arné J-L, Fournié P. Communication scientifique : La plus commune des dystrophies cornéennes : le kératocône peut-on éviter la greffe
[3]. Syndicat National des Ophtalmologistes de France (SNOF). Encyclopédie de la vue : le kératocône ; incidence et épidémiologie
[4]. Syndicat National des Ophtalmologistes de France (SNOF). Encyclopédie de la vue : le kératocône ; clinique
[5]. Fournié P. Rapport SFO 2019 : OCT en ophtalmologie ; 53-54
[6]. Fournié P, Touboul D, Arné J-L, Colin J, Malecaze F. Journal français d’ophtalmologie (2013) Vol 36 : le kératocône ; 623-625
Figure 1. Cassagne M, Fournié P, Malecaze F. Rapport SFO 2015 : surface oculaire ; 503
Rétinopathie diabétique
Le diabète, hyperglycémie chronique, peut générer des atteintes ophtalmologiques, on parle de rétinopathie diabétique (RD).
La rétinopathie diabétique est la 1ère cause de cécité chez les moins de 55 ans en France, elle touche environ 1 million de français, soit 30% des personnes diabétiques [1]. Au niveau mondial, en 2020, le nombre d’adultes avec une RD était estimé à environ 103 millions de personnes. D’après une étude, ce chiffre atteindrait les 160 millions de personnes en 2045 [2].
Les facteurs de risques de développer une RD sont :
- L’ancienneté du diabète.
- Le déséquilibre du diabète.
- L’hypertension artérielle [3].
Figure 1. Œdème maculaire diabtéique diffus
L’hyperglycémie entraîne une altération des capillaires rétiniens qui deviennent perméables, ce phénomène est à l’origine d’un œdème maculaire diabétique, entraînant une baisse d’acuité visuelle et une déformation des lettres. On retrouve également des occlusions capillaires provoquant une ischémie rétinienne menant à l’apparition de néovaisseaux : on parle de rétinopathie diabétique proliférante [4].
Les différents stades de RD sont classés selon l’aspect de la rétine au fond d’œil [5]. Cette classification est en cours de changement mais actuellement nous distinguons les :
- RD non proliférante :
- Minime : quelques micro-anévrismes.
- Modérée : plus de micro-anévrismes que la RD minime.
- Sévère : hémorragie intra-rétinienne dans 4 quadrants, anomalies veineuses dans 2 quadrants, AMIRs (anomalie microvasculaire intra-rétinienne) dans 1 quadrant.
- RD proliférante : non compliquée ou compliquée [6].
Figure 2. Deux exemples de rétinopathie diabétique non proliférante sévère
Une RD proliférante peut se compliquer d’une :
- Rubéose irienne (néovaisseaux de l’iris) avec +/- un glaucome néo-vasculaire.
- Hémorragie intra-vitréenne.
- Décollement de rétine tractionnel [5].
Figure 3. Rubéose irienne
Figure 4. Décollement séreux rétinien
Figure 5. Hémorragie intravitréenne
Le suivi d’une RD demande la réalisation de plusieurs examens :
- Une acuité visuelle.
- Un examen à la lampe à fente.
- Un OCT maculaire.
- +/- une angiographie à la fluorescéine ou angio-OCT qui permet une bonne visualisation des micro-anévrismes, zones non-perfusées et néo-vascularisées [7].
- Rétinographie en UWF (2 photographies par œil : une centrée sur la macula, une sur la papille) et/ou un fond d’oeil dilaté.
Le rythme de suivi est adapté en fonction de la sévérité de l’atteinte. [8]
Le traitement d’une RD commence par le contrôle du diabète. Ensuite on peut envisager de faire de la photocoagulation panrétinienne (PPR) et des injections d’anti-VEGF qui stopperont l’apparition de néovaisseaux [9].
Les principaux risques d’évolution rapide d’une RD sont :
- La puberté, l’adolescence.
- Une grossesse (suivi plus régulier).
- Une équilibration rapide d’un diabète déséquilibré
- La chirurgie de la cataracte [10].
L’éducation, la bonne information et un suivi rapproché des patients sont donc primordiaux pour éviter une évolution accélérée vers des formes graves de RD durant ces périodes.
À noter : Les orthoptistes peuvent faire du dépistage de RD via la réalisation de rétinophotos non mydriatiques colorées, avec lecture différée par un ophtalmologiste [11]. Depuis plusieurs années, l’intelligence artificielle fait son apparition dans le domaine de la santé, en ophtalmologie des études ont montré son efficacité dans le dépistage de la RD à partir de rétinophotos [12].
Bibliographie
[1]. Creuzot C. Collège des Ophtalmologistes Universitaires de France (COUF) ; 301
[2]. Zhen Ling Teo 1 , Yih-Chung Tham 2 , Marco Yu 2 , Miao Li Chee 1 , Tyler Hyungtaek Rim 2 , Ning Cheung 2 , Mukharram M Bikbov 3 , Ya Xing Wang 4 , Yating Tang 5 , Yi Lu 5 , Ian Y Wong 6 , Daniel Shu Wei Ting 2 , Gavin Siew Wei Tan 2 , Jost B Jonas 7 , Charumathi Sabanayagam 2 , Tien Yin Wong 8 , Ching-Yu Cheng 9. Global Prevalence of Diabetic Retinopathy and Projection of Burden through 2045 : Systematic Review and Meta-analysis
[3]. Delcourt C, Delyfer M-N. Rapport SFO 2016 : oedème maculaire ; 224
[4]. Massin P, Pournaras J-A. Rapport SFO 2016 : oedème maculaire ; 227
[5]. Syndicat National des Ophtalmologistes de France (SNOF). Encyclopédie de la vue : rétinopathie diabétique ; anomalie du fond d’oeil
[6]. Lecleire-Collet A. Les cahiers d’ophtalmologie n°152 (septembre 2011) : classification, dépistage et surveillance de la rétinopathie diabétique
[7]. Gherdaoui F, Ayrault S. Les cahiers d’orthoptie n°2 (mai 2016) : l’angio-OCT dans la rétinopathie diabétique
[8]. Creuzot C. Collège des Ophtalmologistes Universitaires de France (COUF) ; 307-309
[9]. Creuzot C. Collège des Ophtalmologistes Universitaires de France (COUF) ; 312-314
[10]. Creuzot C. Collège des Ophtalmologistes Universitaires de France (COUF) ; 311
[11]. Legifrance : arrêté du 1er mars 2021 relatif à l’autorisation du protocole de coopération
[12]. Jie He # 1 , Tingyi Cao # 1 , Feiping Xu 1 , Shasha Wang 1 , Haiqi Tao 2 , Tao Wu 2 , Liyan Sun 2 , Jili Chen 3. Artifi cial intelligence-based screening for diabetic retinopathy at community hospital
Figure 1 : Rougier M-B, Delyfer M-N, Korobelnik J-F. OCT & Rétine ; 41
Figure 2 : Lecleire-Collet A. Les cahiers d’ophtalmologie n°152 (septembre 2011) : classification, dépistage et surveillance de la rétinopathie diabétique
Figure 3 : Creuzot C. Collège des Ophtalmologistes Universitaires de France (COUF) ; 308
Figure 4 : Rougier M-B, Delyfer M-N, Korobelnik J-F. OCT & Rétine ; 41
Figure 5 : Lehmann M. Rapport SFO 2018 : urgences en ophtalmologie ; 432
Syndrome de Stilling-Türk-Duane
Le syndrome de Stilling-Duane est un syndrome congénital dans lequel il y a une agénésie partielle ou totale du noyau du VI (nerf abducens). Une innervation aberrante du muscle droit latéral par les fibres du nerf III (nerf oculomoteur commun) est observée, ainsi qu’une fibrose des parties musculaires non innervées (droit latéral et parfois droit médial).
Ce syndrome entraîne un déficit des mouvements oculomoteurs horizontaux, une rétraction de la fente palpébrale en adduction et est généralement associé à un torticolis.
Ce syndrome provoque une anomalie motrice due à une :
- « Co-contraction » ou « co-inhibition » des muscles droit médial (DM) et droit latéral (DL) selon la direction du regard, résultat de leur co-contraction par le nerf III
- Fibrose et/ou contraction musculaire
Quatre types de ce syndrome ont été décrits, leur diagnostic est essentiellement clinique mais la réalisation d’une IRM peut permettre d’appuyer celui-ci.
Type 1 : Réinnervation partielle du droit latéral par le III (environ 78 % des cas)
- Limitation de l’abduction.
- Adduction +/- normale.
- Rétraction et rétrécissement de la fente palpébrale en adduction.
- Élévation ou abaissement en adduction.
- Torticolis tête tournée du côté sain.
Figure 1 : Stilling Duane de type 1 droit
Type 2 : innervation du droit latéral par le VI et par le III (environ 7 % des cas)
- Limitation de l’adduction.
- Abduction +/- normale.
- Rétraction et rétrécissement de la fente palpébrale en adduction.
- Exotropie en position primaire.
Figure 2 : Stilling Duane de type 2 gauche
Type 3 : VI absent ou non fonctionnel avec une innervation du droit latéral et médial par le III
- Limitation de l’abduction et de l’adduction.
- Limitation des mouvements verticaux.
- Rétraction et rétrécissement de la fente palpébrale en adduction.
Figure 3 : Stilling Duane de type 3 gauche
Type 4 (rare +++) : divergence synergistique des globes oculaires
- Adduction de l’œil atteint impossible provoquant une abduction paradoxale.
- Énophtalmie et rétrécissement de la fente palpébrale en adduction.
- Torticolis de fixation dans le sens qui diminue la déviation.
Le traitement à mettre en place est la correction optique totale avec traitement de l’amblyopie si besoin. Une prise en charge chirurgicale est possible afin de diminuer le torticolis et la déviation des globes oculaires. Elle ne résoudra en rien les limitations oculomotrices.
Moyen mnémotechnique
- Type 1 => 1 D donc déficit d’abDuction.
- Type 2 => 2 D donc déficit d’aDDuction.
- Type 3 => 3 D donc déficit d’aDDuction et d’abDuction.
Morgane GUEX CROSIER et
Clémence JEANNETEAU
Article paru dans la revue « Le magazine de la Fédération Française des Étudiants en Orthoptie » / FFEO N°02

