Les carcinomes adénoïdes kystiques (ACC) correspondent à un sous-type rare de tumeurs ma- lignes aux localisations variées dont celle des glandes salivaires. Les récentes analyses molécu- laires offrent de nouveaux axes potentiels à l’arsenal thérapeutique actuel, limité par l’indolence et le potentiel de récidive de ces tumeurs.
Epidémiologie
Correspondant à 1 % des tu- meurs de la tête et du cou et 10 % des tumeurs des glandes salivaires, les carcinomes adé- noïdes kystiques surviennent à tout âge mais concernent essen- tiellement les 5e et 6e décades de la vie et plus fréquemment les femmes (sexe ratio à 6/4). Néanmoins, les caractéristiques démographiques sont variables selon la localisation de la tu- meur [1]. Du fait de leur faible prévalence, les facteurs de risque ne sont pas clairement identifiés.
Diagnostic
Topographie
Les carcinomes adénoïdes kys- tiques se développent essentiel- lement aux dépens des glandes salivaires accessoires mais sont également décrits au niveau des glandes salivaires principales, des sinus paranasaux, de la langue, du palais, du nasopharynx, du canal auditif externe et d’autres localisations plus rares [2].
Histologie
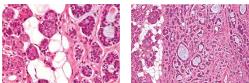
On identifie 3 sous-types d’ACC, caractérisés par leur architec- ture et classés en tumeur de grade intermédiaire ou haut [3] : le sous-type cribriforme, le plus fréquent, avec des ilots de cel- lules basaloïdes et des espaces kystiques, le sous-type solide (aspect de lamelles solides, agré- gats de cellules basaloïdes) de plus mauvais pronostic et celui tubuleux (cellules arrangées en nid au sein d’un stroma éosino- phile et hyalin) [4]. L’architecture solide et le nombre élevé de mi- toses sont considérés comme des facteurs histologiques de mauvais pronostic [5]. L’invasion s’effectue par voie périneuronale et peu par voie lymphatique.
Génétique
Récemment, l’analyse chromoso- mique de ces tumeurs a permis de révéler la présence d’une translo- cation chromosomique 6q/9p jux- taposant les gènes MYB et le fac- teur nucléaire NFIB dans 86 % des tumeurs. D’autres translocations de MYB ont pu être retrouvées, suggérant un rôle central de la dérégulation de MYB dans les car- cinomes adénoïdes kystiques [6]. Plus récemment, se sont ajoutées à ces schémas génétiques tumo- raux, des altérations de NOTCH1, du promoteur TERT, de NOTCH1fs, BCOR, KDM6A et ARID1A [7]. Quant au microenvironnement immunogène des ACC des glandes salivaires, il s’est révélé pauvre en CD8+TILs, exprimant peu PD- L1 mais potentiellement riche en PD-L2 et HLA-G, source pos- sible d’échappement tumoral
Diagnostic positif et évolution
Révélés devant une masse, le plus souvent de la tête et du cou, une douleur ou une pa- ralysie, la croissance des car- cinomes adénoïdes kystiques initialement lente se poursuit par une invasion périneuronale puis une phase d’extension rapide hématogène (40 % de stades métastatiques) pulmo- naire, hépatique et osseuse. L’évolution est variable mais le pronostic fréquemment défavo- rable avec un taux de survie à 5 ans estimé à 89 % mais un taux à 15 ans estimé à 40 % (données actualisées de janvier 2021).
Prise en charge actuelle
Les essais cliniques demeurant peu nombreux ou négatifs du fait de l’indolence des tumeurs, l’arsenal thérapeutique à l’en- contre des carcinomes adé- noïdes reste limité.
Les formes localisées
La résection chirurgicale apparaît comme un standard avec néan- moins 30 à 75 % de récidives locales. Une irradiation de 60Gy du lit post-opératoire semble ré- duire les récidives locales avec un effet demeurant discuté sur la survie globale (études rétros- pectives) [9] [10]. Devant la ra- diorésistance des ACC, l’alterna- tive par Hadronthérapie, avec notamment la radiothérapie par ion carbone, offre des premiers résultats encourageants [11].
Place de la chimiothérapie
La cinétique lente de ces car- cinomes explique le faible taux de réponse aux chimiothéra- pies, qui ne constituent pas un standard et sont réservées aux stades avancés avec métastases symptomatiques [12] [13].
Perspectives
Thérapies ciblées Actuellement, aucune molécule n’a démontré une efficacité suf- fisante pour devenir un stan- dard dans la prise en charge des ACC. Devant la difficulté à cibler spécifiquement MYB, les recherches se penchent plutôt sur des cibles en aval de cette voie de signalisation. L’Imatinib (inhibiteur de c-kit) n’a à ce jour pas démontré d’efficacité signi- ficative, fait confirmé par des études récentes qui ont souli- gné la présence d’un phénotype c-kit sauvage dans les tumeurs ACC. Cibler la voie EGFR avec le Gefitinib ou le Cetuximab s’est également soldé par un échec. Devant la surexpression du fac- teur de croissance FGFR dans les ACC surexprimant MYB, l’utilisation du Dovitinib dans un essai de phase II encourage de futures explorations d’un blocage sélectif de FGFR [14]. Par ailleurs, suite à un essai de phase II, le Vorinostat, inhibiteur d’histone desacetylase, pourrait permettre l’obtention d’une sta- bilisation oncologique [15].
Des résultats prometteurs ont été apportés par une étude de phase II s’intéressant au blocage de la voie VEGF avec l’Axitinib [16] et par l’essai français de phase II PACSA avec le Pazopanib dans les formes récurrentes ou mé- tastatiques [17].
Ainsi, compte-tenu de la résis- tance de ces tumeurs aux trai- tements classiques et de leur rareté, une prise en charge stan- dardisée est difficile à instaurer. En pratique, une chirurgie suivie d’une radiothérapie sont réali sées dans les formes localisées. La prise en charge des formes évoluées est discutée de façon pluridisciplinaire et en RCP mo- léculaire, avec l’inclusion des patients dans des essais théra- peutiques. Elle tend à être un formisée via la création de re- gistres et de réseaux nationaux tels que le REFCOR (Réseau d’Ex- pertise Français sur les Cancers ORL Rares – https://refcor.org).
Références
1 - Li N, Xu L, Zhao H, El-Naggar A, Sturgis E. A comparison of the demographics, clinical features, and survival of patients with adenoid cystic carcinoma of major and minor salivary glands versus less common sites within the Surveillance, Epidemiolo- gy, and End Results registry. Cancer. 2012 Aug 15;118(16):3945-53.
2 - Papaspyrou G, Hoch S, Rinaldo A, Rodrigo J, Takes R, Van Herpen C, et al. Chemotherapy and targeted therapy in adenoid cystic carcinoma of the head and neck: a review. Head Neck. 2011 Jun;33(6):905-11.
3 - Seethala RR, Stenman G. Update from the 4th Edition of the World Health Organization Classification of Head and Neck Tumours: Tumors of the Salivary Gland. Head Neck Pathol. 2017 Mar;11(1):55-67. doi: 10.1007/s12105-017-0795-0.
4 - Azumi N, Battifora H. The cellular composition of adenoid cystic carcinoma. An immunohistochemical study. Cancer. 1987 Oct 1 ;60(7) :1589-98.
5 - Xu B, Drill E, Ho A, Ho A, Dunn L, Prieto-Granada C et al. Predictors of Outcome in Adenoid Cystic Carcinoma of Salivary Glands: A Clinicopathologic Study With Correlation Between MYB Fusion and Protein Expression. Am J Surg Pathol. 2017 Oct; 41(10):1422-1432.
6 - Persson M, Andrén Y, Moskaluk C, Frierson H, Cooke S Futreal P et al. Clinically significant copy number alterations and complex rearrangements of MYB and NFIB in head and neck adenoid cystic carcinoma. Genes Chromosomes Cancer. 2012 Aug;51(8):805-17.
7 - Ho A S, Ochoa A, Jayakumaran G, Zehir A, Mayor V, Tepe J. Genetic hallmarks of recurrent/metastatic adenoid cystic carcino- ma. J Clin Invest. 2019 Oct 1;129(10):4276-4289.
8 - Mosconi C, Almeida de Arruda J, Rodrigues de Farias A et al. Immune microenvironment and evasion mechanisms in ade- noid cystic carcinomas of salivary glands. Oral Oncol. 2019 Jan ;88 :95-101.
9 - Chen A, Bucci M, Weinberg V, Garcia J, Quivey J, Schechter N et al. Adenoid cystic carcinoma of the head and neck treated by surgery with or without postoperative radiation therapy: prognostic features of recurrence. Int J Radiat Oncol Biol Phys. 2006 Sep 1;66(1):152-9.
10 - Lee A, Givi B, Osborn VW, Schwartz D, Schreiber D. Patterns of care and survival of adjuvant radiation for major salivary adenoid cystic carcinoma. Laryngoscope. 2017 Sep;127(9):2057-2062. doi: 10.1002/lary.26516.
11 - Takagi M, Demizu Y, Hashimoto N, Mima M, Terashima K, Fujii O, Jin D, Niwa Y, Morimoto K, Akagi T, Daimon T, Sasaki R, Hishikawa Y, Abe M, Murakami M, Fuwa N. Treatment outcomes of particle radiotherapy using protons or carbon ions as a single-modality therapy for adenoid cystic carcinoma of the head and neck. Radiother Oncol. 2014 Dec;113(3):364-70. doi: 10.1016/j.radonc.2014.11.031.
12 - Cerda T, Sun X, Vignot S, Marcy, P-y, Baujat B, Baglin A-C et al, A rationale for chemoradiation (vs radiotherapy) in saliva- ry gland cancers? On behalf of the REFCOR (French rare head and neck cancer network). Crit Rev Oncol Hématol. 2014 Aug;91(2):142-58.
13 - Chefiri F, Rambeau A, Johnson A, Florescu C, Gery B, Babun E et al. Systemic treatments of metastatic or locally recurrent adenoid cystic carcinoma of the head and neck, a systematic review. Bull Cancer. 2019 Oct;106(10):923-938.
14 - Dillon P, Petroni G, Horton B, Moskaluk C, Fracasso P, Douvas M et al. A Phase II Study of Dovitinib in Patients with Recurrent or Metastatic Adenoid Cystic Carcinoma. Clin Cancer Res. 2017 Aug 1;23(15):4138-4145.
15 - Goncalves P, Heilbrun L, Barrett M, Kummar S, Hansen A, Siu L et al. A phase 2 study of vorinostat in locally advanced, re- current, or metastatic adenoid cystic carcinoma. Oncotarget. 2017 May 16;8(20):32918-32929.
16 - Keam B, Kang E, Ahn M, Ock C, Lee K, Kwon J et al. Randomized phase II study of axitinib versus observation in patients with recurred or metastatic adenoid cystic carcinoma. JCO 2020 ASCO A6503.
17 - Guigay J, Fayette J, Even C, Cupissol D, Rolland F, Peyrade F et al. PACSA: Phase II study of pazopanib in patients with pro- gressive recurrent or metastatic (R/M) salivary gland carcinoma (SGC). JCO 2016 A6086.
Julie Chartier Interne
en oncologie
Relu par le Dr Laurence Bozec
Service d’oncologie médicale Institut Curie
Site Saint-Cloud
Article paru dans la revue “Association pour l'Enseignement et la Recherche des Internes en Oncologie” / AERIO n°2

