RECOMMANDATIONS DES SOCIÉTÉS D’EXPERTS SUR LA PRISE EN CHARGE DU PNEUMOTHORAX SPONTANÉ PRIMAIRE
RECOMMENDATIONS FROM EXPERT SOCIETIES ON THE MANAGEMENT OF PRIMARY SPONTANEOUS PNEUMOTHORAX
A. Beauvais, E. NoelSavina, G. Mangiapan, J. Messika, S. Jounneau et T. Desmettre, Revue des maladies respiratoires, Juin 2022
Dr Pauline LERICHE
CCA
Amiens
Louis DANCHIN
Docteur Junior
Amiens
« Le pneumothorax est une pathologie rencontrée fréquemment en pneumologie et sa prise en charge reste encore très hétérogène. Il s’agit d’un épanchement gazeux dans la cavité pleurale. Il est qualifié de spontané lorsqu’il survient en dehors de tout contexte iatrogène ou traumatique et il est qualifié de primaire lorsqu’il survient chez un patient indemne de toute pathologie respiratoire. La question du drainage thoracique occupe une place centrale dans la stratégie thérapeutique du pneumothorax spontané primaire (PSP). De nouvelles recommandations ont été publiées en 2022 afin d’homogénéiser nos pratiques. »
DIAGNOSTIC DU PNEUMOTHORAX SPONTANÉ PRIMAIRE
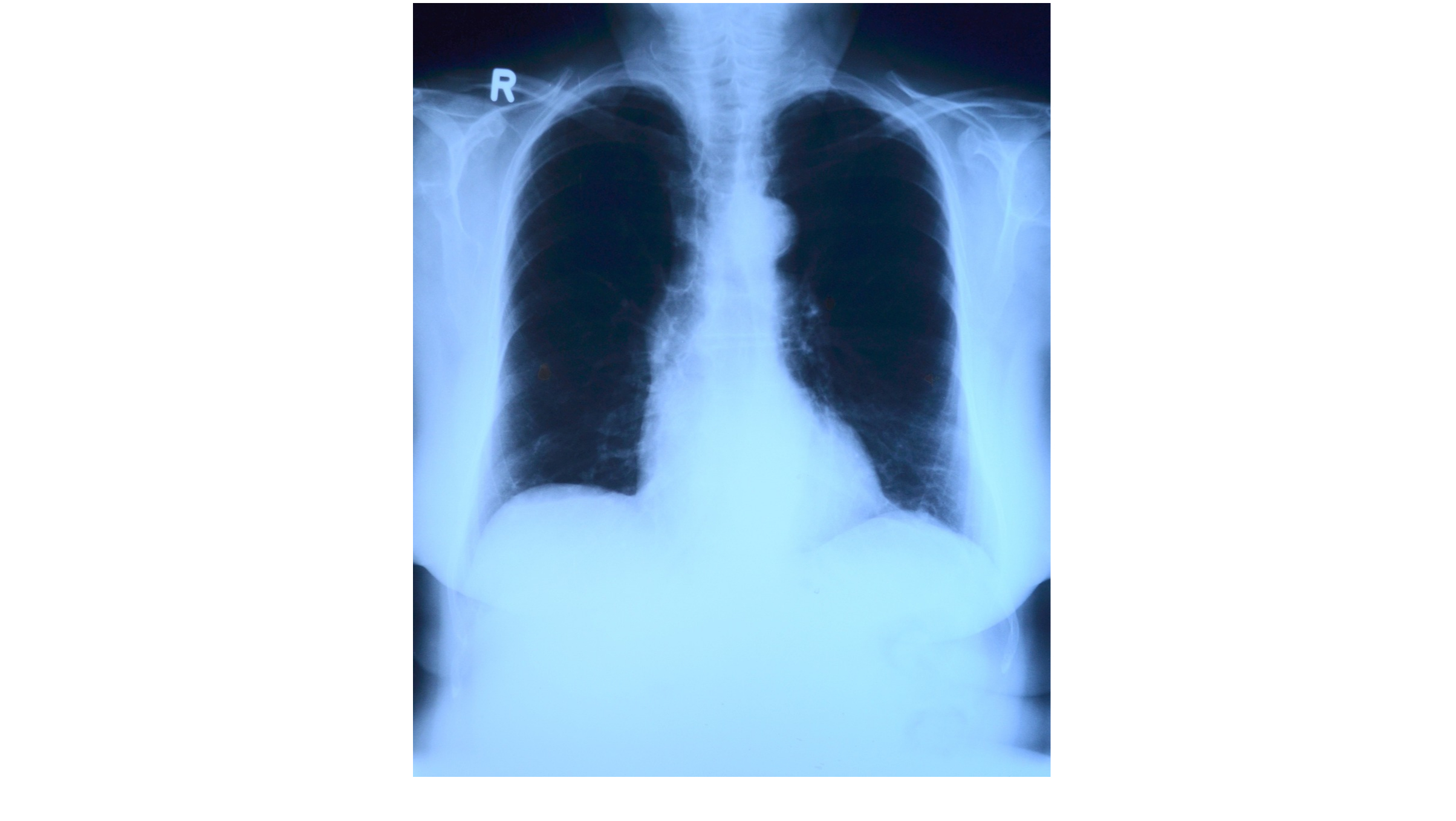
Le pneumothorax spontané primaire est défini comme de grande abondance lorsqu’il existe un décollement sur toute la ligne axillaire, d’une largeur de plus de 2 cm au niveau du hile sur une radiographie de thorax de face en inspiration.
Le scanner thoracique à faible irradiation doit être réalisé dans un second temps, en cas de doute diagnostique.
L’échographie pleurale est une bonne alternative à la radiographie de thorax pour le diagnostic positif chez les équipes expérimentées. Elle est recommandée pour le diagnostic de pneumothorax résiduel chez les patients drainés.
PRISE EN CHARGE INITIALE DU PNEUMOTHORAX SPONTANÉ PRIMAIRE
Pour les PSP suff ocants (avec signes de détresse respiratoire ou hémodynamique), il faut réaliser une exsuffl ation à l’aiguille en urgence, par voie antérieure ou axillaire.
Pour les PSP de grande abondance, sans signe de sévérité immédiat, il faut réaliser une évacuation de l’air soit par exsuffl ation soit par drainage thoracique.
L’exsuffl ation se fait par voie antérieure, à la seringue ou à l’aspiration murale douce.
Le drainage thoracique se fait par voie antérieure ou axillaire, par un drain de petit calibre inférieur ou égal à 14 Fr, sous repérage échographique. Il faut débuter le drainage de façon passive par une valve unidirectionnelle et dans un second temps par une aspiration de 5 à 20 cmH20. En fin de drainage, il faut arrêter l’aspiration pendant 6 à 8h avant l’ablation du drain.
Pour les PSP de faible abondance,une prise en charge conservatrice (surveillance) et ambulatoire est recommandée si :
→Stabilité clinique et radiologique à 4 heures ;
→Existence d’une organisation préalable à cette prise en charge ambulatoire ;
→Consultation avec échographie pleurale ou radiographie de thorax à 2472h programmée afin de suivre l’évolution.
Il faut s’assurer que :
→Le patient ait bien compris la conduite à tenir en cas de problème 24h/24, 7j/7 avec les numéros de téléphone à contacter en urgence (remise d’un document écrit standardisé) ;
→Le patient ne soit pas seul les 2448 premières heures suivant son retour à domicile ;
→Le patient puisse rejoindre un centre médical en moins d’une heure en cas de dégradation ;
→L’heure de sortie importe peu si tous les critères précédents sont réunis. À noter que pour les PSP de grande abondance, une prise en charge ambulatoire avec évacuation de l’air est possible si tous les critères cités ci-dessus sont remplis, avec des dispositifs de drainage thoracique à domicile (ROCKET, PNEUMOSTAT).
Figure 1 : Algorithme de prise en charge du pneumothorax spontané primaire sans signe de gravité, inspiré des nouvelles recommandations
MESURES ASSOCIÉES
L’utilisation de l’oxygénothérapie n’est pas recommandée.
Il ne faut pas préconiser de repos strict au lit mais une limitation des activités de sports intenses ou de contact jusqu’à la résolution complète de l’épisode. Les activités sportives d’intensité modérée et la pratique d’instruments à vent ne doivent pas être empêchées. La plongée sous-marine est contre-indiquée définitivement.
Il faut éviter de prendre l’avion pendant au moins deux semaines après la résolution d’un PSP (le personnel navigant doit se voir proposer une pleurodèse dès le 1er épisode ainsi que les pratiquants de parachutisme).
L’aide au sevrage tabagique est incontournable.
SUIVI
L’intérêt du suivi est de dépister les pathologies respiratoires sousjacentes, d’informer et de prévenir la récidive notamment avec le sevrage tabagique. Une consultation de pneumologie doit être organisée et un scanner thoracique doit être réalisé en cas de signes, d’antécédents ou d’histoire clinique évocateurs d’une pathologie respiratoire sous-jacente.
CAS PARTICULIERS
Le PSP bilatéral est rare et grave. En cas de signe de sévérité ou de grande abondance, il faut réaliser un drainage thoracique immédiat. Sinon, le drainage n’est pas obligatoire en urgence et il faut contacter un centre expert.Le PSP avec bride ou adhérence pleurale peut se compliquer d’hémothorax. En cas de signe de sévérité ou de grande abondance, il faut réaliser un drainage thoracique en urgence et rapprocher le patient d’un centre expert (pour éventuelle hémostase chirurgicale). Sinon, une simple surveillance peut être discutée.
CONCLUSION
Les recommandations concernant les PSP vont nous permettre d’homogénéiser nos pratiques et de réaliser lorsque cela est possible des prises en charges conservatrices et ambulatoires qui ont pour but de diminuer les taux d’hospitalisations, d’arrêts de travail, de douleurs, d’alitements et de complications liées au drainage qui sont des éléments qu’une prise en charge trop interventionniste peut impliquer chez des patients jeunes et peu comorbides.
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Beauvais A, Noel-Savina E, Mangiapan G, Messika J, Jounneau S, Desmettre T.Recommandations des sociétés d’experts sur la prise en charge du pneumothorax spontané primaire. Rev Mal Respir Actual. juin 2022;14(1):1S1114.
2. Brown SGA, Ball EL, Perrin K, Asha SE, Braithwaite I, EgertonWarburton D, et al. Conservative versus Interventional Treatment for Spontaneous Pneumothorax. N Engl J Med. 30 janv 2020;382(5):40515.
3. Hallifax RJ, McKeown E, Sivakumar P, Fairbairn I, Peter C, Leitch A, et al. Ambulatory management of primary spontaneous pneumothorax: an openlabel, randomised controlled trial. The Lancet. Juill 2020;396(10243):3949.
4. Salazar AJ, Aguirre DA, Ocampo J, Camacho JC, Díaz XA. Evaluation of Three Pneumothorax Size Quantification Methods on Digitized Chest Xray Films Using MedicalGrade Grayscale and ConsumerGrade Color Displays. J Digit Imaging. avr 2014;27(2):2806.
5. Massongo M, Leroy S, Scherpereel A, Vaniet F, Dhalluin X, Chahine B, et al. Outpatient management of primary spontaneous pneumothorax: a prospective study. Eur Respir J. 1 févr 2014;43(2):58290.
CHECKMATE 816 : INTÉRÊT DU NIVOLUMAB EN NÉOADJUVANT POUR LA PRISE EN CHARGE DU CANCER PULMONAIRE NON À PETITES CELLULES RÉSÉCABLE
NEOADJUVANT NIVOLUMAB PLUS CHEMOTHERAPY IN RESECTABLE LUNG CANCER
Forde PM & al. CheckMate 816 Investigators. N Engl J Med. 2022 May 26. Doi: 10.1056/NEJMoa2202170
Ali CHOUR
Interne de Pneumologie Lyon
Relecture
Pr Nicolas GIRARD
Institut Curie
« Le cancer pulmonaire non à petites cellules (CBNPC) est encore aujourd’hui majoritairement diagnostiqué au stade métastatique1, pour un cancer qui reste la première cause de décès par cancer en France. Parmi les traitements ayant amélioré la prise en charge des patients ces dernières années il y a les inhibiteurs du check-point immunitaire (ICI), initialement développés en deuxième ligne de traitement métastatique et qui sont maintenant le standard de prise en charge pour la majorité des patients en première ligne métastatique (sans altération oncogénique ciblable)2. »
Depuis l’étude PACIFIC, le durvalumab est maintenant indiqué après radiochimiothérapie pendant un an pour les patients ayant un CBNPC localement avancé inopérable3.
Les ICI ne sont néanmoins pas encore indiqués dans la prise en charge des CBNPC localisés résécables. Y atil une place pour eux en périopératoire ? L’étude CheckMate 816 s’intéresse au contexte néoadjuvant4. Pour les CBNPC de stade I à IIIA résécables, la chirurgie d’exérèse anatomique complète avec curage ganglionnaire reste le traitement de référence, avec néanmoins un taux de rechute non négligeable5. L’ajout d’une chimiothérapie de façon adjuvante ou néoadjuvante pour les stades II à III permet un gain modeste de survie globale de l’ordre de 5 %6. On comprend alors la nécessité d’évaluer de nouveaux traitements périopératoires pour ces patients.
CheckMate 816 est un essai clinique de phase III randomisé, multicentrique et international, en ouvert, qui vise à évaluer l’intérêt de l’immunothérapie en néoadjuvant dans le cancer pulmonaire de stade IB à IIIA résécable.
MÉTHODES
Les patients inclus présentaient un CBNPC de stade IB (T > 4cm) à IIIA et un statut OMS à 0 ou 1. Les patients ne devaient pas avoir été pré-traités, et n’avaient pas de mutation de l’EGFR ou de translocation d’ALK. Pour être inclus les patients devaient avoir une tumeur ré-sécable d’emblée (l’objectif de la chimiothérapie néo-adjuvante n’est pas de rendre une tumeur non ré-sécable)
Une fois inclus, les patients étaient randomisés en deux groupes :Le premier recevait 3 cycles de Nivolumab associé à un doublet de-chimiothérapie à base de sel de platine (un cycle toutes les 3 semaines) avant chirurgie.
Le deuxième recevait uniquement 3 cycles de chimiothérapie à base de sel de platine (un cycle toutes les 3 semaines) avant chirurgie.
RÉSULTATS
358 patients ont été inclus dans cette étude, 179 dans chaque bras. Les caractéristiques étaient équilibrées dans les deux bras avec un âge médian autour de 65 ans, une majorité d’hommes, et une grande majorité de fumeurs ou d’anciens fumeurs.
L’histologie était aussi équilibrée entre adénocarcinomes et carcinomes épidermoïdes, avec une majorité de tumeurs de stade IIIA (> 60 % des cas). Environ 40 % des patients avaient un statut PDL1 < 1 %, et un peu plus de 20% des patients avaient un statut PDL1 ≥ 50 %.
Parmi les résultats clés, on retient :
1) Que l’ajout du Nivolumab ne s’est pas traduite par une majoration importante des effets indésirables :
→93,8 % des patients du groupe Nivolumab-chimiothérapie ont terminé les 3 cycles du traitement, contre 84,7 % dans le groupe chimiothérapie seule.
→Les eff ets indésirables de grade 3 ou 4 (selon la classification CTCAEv4) étaient similaires dans les deux groupes (autour de 30 % des patients). La principale toxicité de grade 3 ou 4 était la neutropénie dans les deux groupes (autour de 10 % des patients).
→Les eff ets indésirables de grade 3 ou 4 immunomédiés étaient rares dans le groupe Nivolumab-chimiothérapie (6 cas incluant 3 rashs cutanés, 2 insuffisances adrénergiques, 1 hypophysite).
→Il n’y a pas eu de toxicité de grade 5 (décès) dans le groupe Nivolumab-chimiothérapie, contre 3 cas dans le groupe chimiothérapie seule.
2) Que l’ajout du Nivolumab n’a pas empêché la chirurgie complète pour la majorité des patients : 83,2 % des patients du groupe Nivolumab-chimiothérapie contre 75,4 % du groupe chimiothérapie seule ont pu être opérés. Chez ceux qui n’ont pas pu être opérés, une minorité l’était pour toxicité du traitement néoadjuvant (1,1 % vs 0,6 % des cas dans le groupe Nivolumab-chimiothérapie et chimiothérapie seule, respectivement). La chirurgie a été repoussée pour eff et indésirable chez 3,4 % des patients du groupe Nivolumab-chimiothérapie contre 5,1 % dans le groupe chimiothérapie seule ; et les complications postopératoires n’étaient pas plus fréquentes dans le groupe Nivolumab-chimiothérapie (41,6 % contre 46,7 % dans le groupe chimiothérapie seule).
3) Que l’ajout du Nivolumab s’est traduit par une amélioration importante et significative de la survie sans évènements (EFS) avec une EFS médiane à 31,6 mois contre 20,8 mois dans le groupe chimiothérapie seule. Les évènements pris en compte étaient la progression survenue avant chirurgie, après chirurgie ou le décès toute cause. Le nombre de patients sans rechute à 2 ans est de 63,8 % dans le groupe Nivolumab-chimiothérapie contre 45,3 % dans le groupe chimiothérapie seule. Les données de survie globale ne sont pas encore matures, mais le pourcentage de réponse pathologique complète, qui est un facteur prédictif de la survie reconnu dans le contexte néoadjuvant7 est plus important chez les patients du groupe Nivolumab-chimiothérapie (24 % contre 2,2 %, p<0,001).
CONCLUSION
Que retenir pour la pratique ? L’essai CheckMate 816 montre un bénéfice clair de l’immunothérapie en néoadjuvant pour les patients ayant une tumeur résécable de stade IB à IIIA (hors mutation de l’EGFR ou translocation d’ALK), quel que soit l’expression du PDL1 et ce sans majoration de la toxicité. Un changement des pratiques sera probablement opéré dans les prochaines recommandations françaises.
En contexte adjuvant, une autre étude est à retenir : IMpower 0106. Cette étude retrouve un bénéfice de l’Atézolizumab en adjuvant pour les patients ayant un CBNPC de stade IB à IIIA et une expression du PDL1 ≥ 1 %. Contrairement à CheckMate 816 où les patients n’ont que 3 cycles de traitement, les patients d’IMpower 010 avaient une maintenance d’une année par Atézolizumab après 1 à 3 cycles de chimiothérapie. D’autres essais sont encore en cours évaluant le Nivolumab en adjuvant (essai ALCHEMIST8) ou encore le Pembrolizumab en adjuvant (PEARLS/KEYNOTE0919).
Les prochaines années sont donc porteuses d’espoir pour la prise en charge de nos patients localisés et localement avancés opérables.
BIBLIOGRAPHIE
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68(1):730. doi:10.3322/caac.21442
2. Formes métastatiques – stade IV – AURA. Accessed October 1, 2022. http://referentielsaristot.com/129cancerbronchiquenonpetitescellules/134modalitestherapeutiques/138formesmetastatiquesstadeiv/
3. FaivreFinn C, Vicente D, Kurata T, et al. FourYear Survival With Durvalumab After Chemoradiotherapy in Stage III NSCLCan Update From the PACIFIC Trial. J Thorac Oncol. 2021;16(5):860867. doi:10.1016/j.jtho.2020.12.015
4. Forde PM, Spicer J, Lu S, et al. Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer. N Engl J Med. 2022;386(21):19731985. doi:10.1056/NEJMoa2202170
5. Stade I et II cliniques (bilan préthérapeutique), patient opérable – AURA. Accessed October 1, 2022. http://referentielsaristot.com/129cancerbronchiquenonpetitescellules/134modalitestherapeutiques/135stadeietiicliniquesbilanpretherapeutiquepatientoperable/
6. Pignon JP, Tribodet H, Scagliotti GV, et al. Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol. 2008;26(21):35523559. doi:10.1200/JCO.2007.13.9030
7. Hellmann MD, Chaft JE, William WN, et al. Pathological response after neoadjuvant chemotherapy in resectable nonsmallcell lung cancers: proposal for the use of major pathological response as a surrogate endpoint. Lancet Oncol. 2014;15(1):e4250. doi:10.1016/S14702045(13)703346
8. Govindan R, Mandrekar SJ, Gerber DE, et al. ALCHEMIST Trials: A Golden Opportunity to Transform Outcomes in EarlyStage NonSmall Cell Lung Cancer. Clin Cancer Res. 2015;21(24):54395444. doi:10.1158/10780432.CCR150354
9. PazAres L, O’Brien MER, Mauer M, et al. VP32022: Pembrolizumab (pembro) versus placebo for earlystage nonsmall cell lung cancer (NSCLC) following complete resection and adjuvant chemotherapy (chemo) when indicated: Randomized, tripleblind, phase III EORTC1416LCG/ETOP 815 – PEARLS/KEYNOTE091 study. Annals of Oncology. 2022;33(4):451453. doi:10.1016/j.annonc.2022.02.224
CANCER PULMONAIRE ET MUTATION KRAS G12C : ÉTUDE CODEBREAK
Hugues SULTANA
Interne de Pneumologie Besançon
Relecture
Dr Pascale JACOULETPH
à Bensançon
Dr JeanBaptiste ASSIÉCCA
à Paris
« KRAS fait partie de la famille des protéines RAS dont l’activité GDP/GTP module d’autres voies (MAP kinase/PI3Kinase) impliquées dans la survie et la prolifération cellulaire. Sa mutation est dans le cancer bronchique non à petites cellules, la mutation la plus fréquente, représentants 30 % des adénocarcinomes dans les pays occidentaux1. Contrairement aux autres addictions oncogéniques, cette mutation se retrouve le plus souvent chez le fumeur. Lorsqu’elle survient elle affecte le codon 12 du gène (>80 % des cas) sous la forme d’une mutation G12c (4045 % des mutations KRAS), G12v ou G12d2. Les adénocarcinomes mutés G12C représentent 13 % des CBNPC de stade IV. »
Sur le plan clinique, les adénocarcinomes mutés KRAS étaient historiquement associés à un pronostic plus sombre, mais leur tendance à présenter une forte charge mutationnelle et une importante infiltration lymphocytaire en a fait de bons répondeurs à l’immunothérapie (3, 4). Par ailleurs des comutations peuvent être associées (STK11, TP53, KEAP1, etc.) modifiant les caractéristiques de la tumeur et sa réponse aux traitements (moindre réponse à l’immunothérapie en cas de comutations à STK11 et KEAP1).
Le panel des thérapies ciblant des drivers oncogéniques a considérablement évolué ces dernières années. Néanmoins, la découverte d’une mutation KRAS n’a eu, pendant longtemps, qu’un impact pronostic jusqu’à l’arrivée du Sotorasib en 2021, premier inhibiteur irréversible ciblant spécifiquement la mutation G12c de ce driver oncogénique.
CODE BREAK 100
La première étude qui a définitivement donné à cette mutation un intérêt thérapeutique est l’essai de phase II CodeBreak 100 publié en juin 2021 (5). 126 patients ont été inclus, tous avaient été traités préalablement par une première ligne et la médiane de traitement était de 2 lignes. Ils recevaient du Sotorasib par voie orale, une fois par jour, à la dose de 960 mg.
Une réponse objective a été observée chez 37,1 % (95% IC, 28,646,2) d’entre eux et un contrôle de la maladie chez 80,6 % (95% IC, 72,687,2). À noter que la réponse survenait rapidement, puisque 71 % des réponses objectives étaient observées à la première évaluation à 6 semaines. Par ailleurs, la durée de réponse était à la fois relativement longue pour un traitement donné dans la majorité des cas en 3e ligne (11,1 mois (95% IC, 6,9NE) mais également identique quelle que soit la ligne antérieure reçue (chimiothérapie ou immunothérapie). Concernant les analyses de sousgroupes, les taux de réponse étaient similaires quelle que soit la charge mutationnelle, la fraction allélique de la mutation KRAS G12C, ou la présence de comutation TP53, STK11 et KEAP1.
Le bénéfice d’un traitement par Sotorasib se traduisait par une PFS (survie sans progression) médiane de 6,8 mois (95% IC, 5,18,2) et une survie médiane de 12,5 mois (95% IC, 10NE).
Le problème essentiel posé par cette molécule reste sa tolérance, 69.8 % des patients rapportaient des événements indésirables (EI), dont environ 20 % de grade 3, essentiellement de nature digestive (diarrhée, nausée, vomissement et perturbation du bilan hépatobiliaire étaient les principaux EI rapportés) avec modification de dose dans 22 % des cas.
Courbes de survie avec en haut survie sans progression et en bas survie globale refaites à partir de l’article Codebreak 100
CODE BREAK 200
Aux vues de ces excellents résultats, Les données de la phase III (CodeBreak 200) évaluant le bénéfice du Sotorasib comparé au Docetaxel (standard actuel du traitement de 2e ligne), étaient très attendus. Le critère de jugement principal quiétait la survie sans progression est atteint et l’étude positive.
Dans cet essai, 345 patients étaient randomisés (1 :1) entre sotorasib (960mg/jour) et docétaxel (75mg/m2 J1=J21). Après un suivi médian de 17,7 mois, le taux de survie sans progression (SSP) à 1 an était de 24,8 % dans le groupe sotorasib contre 10,1 % dans le groupe docétaxel correspondant ainsi à une diminution de 34 % du risque de progression (p=0,002). Le bénéfice du sotorasib était retrouvé dans tous les sousgroupes étudiés.
En revanche la survie globale (SG) ne diff érait pas significativement entre les deux bras de traitement. Cependant, l’étude ne présentait pas une puissance suffisante pour répondre à cette question à la suite d’une réduction des eff ectifs des patients à inclure (650 patients devaient être inclus initialement). Par ailleurs, le crossover était autorisé par suite d’un amendement. Les patients progressant sous docetaxel pouvaient recevoir du sotorasib secondairement.Le profil de tolérance serait en faveur du Sotorasib puisque les auteurs rapportent un taux d’évènements indésirables de grade 3 ouplus de 33.1 % dans le groupe Sotorasib contre 40.4 % dans le groupe Docétaxel. Avec 1 décès rapporté lié au Sotorasib et 2 liés au Docétaxel.
CONCLUSION
La population traitée par thérapie ciblée était jusqu’à présent d’environ 25 % dans les adénocarcinomes de stade avancé. Le développement de ces nouvelles molécules, permet d’espérer, dans un futur proche, pouvoir proposer une thérapie ciblée à environ 40 % des malades atteint par ce type de pathologie. Depuis le 7 juin 2022, le Sotorasib est disponible en accès précoce postAMM.
Reste premièrement la problématique de la tolérance à de tels traitements. Le Sotorasib semble avoir un index thérapeutique étroit et impose d’être vigilant sur le risque d’interaction médicamenteuse et sur les diff érents symptômes relevant d’un traitement symptomatique dans le cadre de soins de supports.
Deuxièmement, la question de la résistance acquise survenant inexorablement sous traitement. Une étude récente a ainsi étudié, chez 38 patients traités par Adagrasib (autre thérapie ciblant la mutation KRAS G12c en cours de développement), la biologie moléculaire au moment de la progression comparé à celle avant traitement objective 3 mécanismes de résistances : l’apparition de nouvelles mutations ou amplifications de KRAS ellemême, des altérations des voies en aval (MAPK/PI3K) et la transformation histologique de l’adénocarcinome en épidermoïde (6).
Dans le futur, le développement à la fois de nouvelles générations de traitement et de nouvelles stratégies thérapeutiques basées sur des associations (avec l’immunothérapie ou avec la chimiothérapie) seront donc nécessaires.
Enfin la question du dosage reste importante, des études sont en cours pour déterminer si des posologies inférieures seraient aussi efficaces tout en étant moins toxiques.
SOURCES
1. Dogan S, Shen R, Ang DC, Johnson ML, D’Angelo SP, Paik PK, et al. Molecular Epidemiology of EGFR and KRAS Mutations in 3,026 Lung Adenocarcinomas: Higher Susceptibility of Women to Smoking-Related KRAS Mutant Cancers. Clin Cancer Res. 15 nov 2012;18(22):616977.`
2. Riely GJ, Kris MG, Rosenbaum D, Marks J, Li A, Chitale DA, et al. Frequency and Distinctive Spectrum of KRAS Mutations in Never Smokers with Lung Adenocarcinoma. Clin Cancer Res. 15 sept 2008;14(18):57314. 3. El Osta B, Behera M, Kim S, Berry LD, Sica G, Pillai RN, et al. Characteristics and Outcomes of Patients With Metastatic KRASMutant Lung Adenocarcinomas: The Lung Cancer Mutation Consortium Experience. J Thorac Oncol. Mai 2019;14(5):87689.
4. André T, Lonardi S, Wong KYM, Lenz HJ, Gelsomino F, Aglietta M, et al. Nivolumab plus lowdose ipilimumab in previously treated patients with microsatellite instabilityhigh/mismatch repairdeficient metastatic colorectal cancer: 4year follo-wup from CheckMate 142. Ann Oncol. Oct 2022;33(10):105260.
5. Skoulidis F, Li BT, Dy GK, Price TJ, Falchook GS, Wolf J, et al. Sotorasib for Lung Cancers with KRAS p.G12C Mutation. N Engl J Med. 24 juin 2021;384(25):237181.
6. Awad MM, Liu S, Rybkin II, Arbour KC, Dilly J, Zhu VW, et al. Acquired Resistance to KRAS G12C Inhibition in Cancer. N Engl J Med. 24 juin 2021;384(25):238293.
Article paru dans la revue «La revue du jeune Pneumologue» / AJPO2 N°1

