Overall Survival with Pembrolizumab in Early-Stage Triple-Negative Breast Cancer
Peter Schmid, M.D et al., NEJM novembre 2024
Mots-clés
Overall survival, triple negative breast cancer, pathological complete response
Le cancer du sein est le cancer le plus fréquent chez la femme en France avec une incidence de 61 214 nouveaux cas en 2023 et représente la première cause de mortalité par cancer chez la femme avec environ 12 600 décès en 2021.
Le cancer du sein triple négatif (TN) est le sous-type de cancer du sein le moins fréquent et représente environ 15 % de l'ensemble des cancers du sein soit environ 9 000 cas chaque année. Il se caractérise par l'absence d'expression des récepteurs hormonaux (RH) et l'absence de surexpression des récepteurs 2 du facteur de croissance épidermique humain (HER-2). Il n'y a donc pas de traitement ciblant ces 2 voies à proposer. Comparativement aux cancers RH positifs, les tumeurs TN sont diagnostiquées à un âge plus jeune avec des facteurs de mauvais pronostic clinique et anatomopathologique (haut grade, KI67 élevé, grande taille tumorale et un envahissement ganglionnaire plus fréquent).
Le risque de rechute est plus élevé comparé aux autres types de cancers du sein et le pronostic est mauvais avec une survie globale médiane de 14 mois et demi et un taux de survie à 5 ans de 11,3 %.
Bien que dit triple négatif, ce sous-type a la particularité d'être plus immunogène avec la présence plus importante de lymphocytes T infiltrant la tumeur et la surexpression de PD-L1 sur les cellules cancéreuses ou les cellules du micro-environnement tumoral. L'immunothérapie devient donc une approche prometteuse dans l'arsenal thérapeutique des cancers du sein triple négatif comme avec le Pembrolizumab qui agit comme un inhibiteur de PD-1. À noter qu'une étude parue en 2020 (KEYNOTE-355, Cortes et al Lancet 2020 (1)) a montré une amélioration significative de la survie sans progression des patientes au stade métastatique dans le cancer du sein triple négatif d'où l'intérêt de savoir si l'utilisation du Pembrolizumab dans les stades précoces a également cette même efficacité.
Les premiers résultats de cette étude ont déjà démontré une augmentation significative du nombre de réponses pathologiques complètes dans le groupe Pembrolizumab avec un taux de pCR de 64,8 % vs. 51,2 % (p=0,0006) dans le groupe placebo. Cette publication est une mise à jour des données avec principalement les résultats du suivi et de la survie globale à 5 ans.
Matériels et méthodes
L'étude KEYNOTE-522 est une étude de phase III internationale de supériorité, multicentrique contrôlée, randomisée contre placebo en double aveugle.
Elle consiste à inclure des patientes nouvellement diagnostiquées pour un cancer du sein triple négatif au stade localisé éligible à une chimiothérapie néo-adjuvante.
En néoadjuvant, les patientes recevaient toutes les 3 semaines 4 cycles de chimiothérapie par Carboplatine-Paclitaxel puis, 4 cycles d'Épirubicine/Doxorubicine et cyclophosphamide en association à chaque cure à du Pembrolizumab ou Placebo en IV.
Les patientes étaient opérées 3 à 6 semaines après la fin du traitement néoadjuvant et recevaient ensuite une radiothérapie adjuvante si indiquée et poursuivaient le Pembrolizumab ou placebo toutes les 3 semaines pour 9 cycles.
Les patientes étaient randomisées en 2/1. Les patientes étaient stratifiées selon la taille de la tumeur, l'atteinte ganglionnaire ou non et la fréquence d'administration de la chimiothérapie par Carboplatine.
Le critère de jugement principal était la réponse pathologique complète au moment de la chirurgie et la survie sans évènement. Un critère de jugement secondaire était la survie globale. Une analyse exploratoire du taux d'expression de PDL1 tumoraux a été réalisée.
Résultats
1174 patientes ont été randomisées entre mars 2017 et septembre 2018 avec 784 patientes traitées dans le groupe Pembrolizumab et 390 patientes dans le groupe placebo avec une durée médiane de suivi de 75.1 mois.
Dans cette étude on retrouve une diminution relative de 35 % du risque de rechute de la maladie dans le groupe traité par Pembrolizumab versus placebo. La survie sans évènement à 5 ans était de 81.2 % (95% CI, 78.3 à 83.8) dans le groupe Pembrolizumab vs 72.2 % (95% CI, 67.4 to 76.4) dans le groupe placebo soit une différence de 9 % en faveur du groupe Pembrolizumab. De plus, on retrouve moins de récidive à distance dans le groupe Pembrolizumab avec 9,8 % vs 14.4 % dans le groupe placebo.
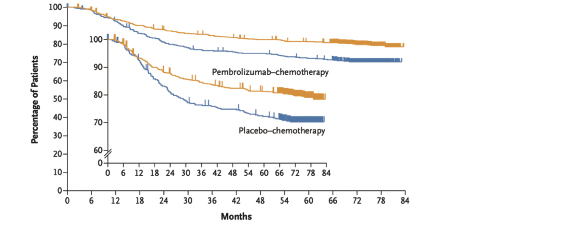
On retrouve également une amélioration significative de la survie globale dans le groupe des patients traités par Pembrolizumab par rapport au groupe placebo avec respectivement un taux de survie globale de 86.6 % (95% CI, 84.0 to 88.8) vs 81.7 % (95% CI, 77.5 to 85.2) à 5 ans.
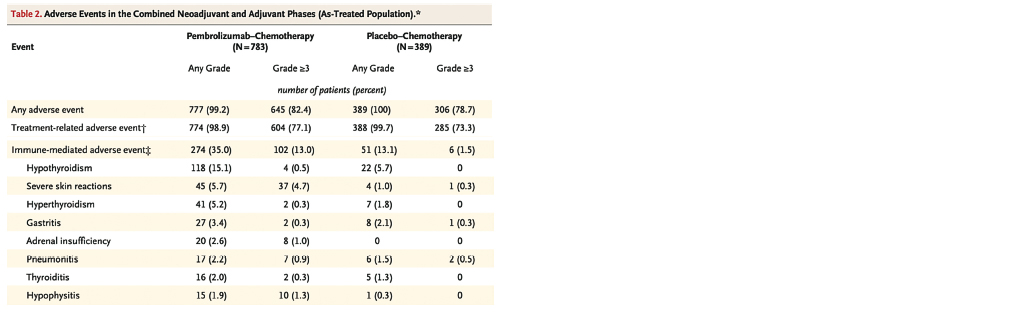
Au total, 159 patients (20.3 %) dans le groupe Pembrolizumab vs 114 patients (29.2 %) dans le groupe placebo ont eu un évènement indésirable grave (grade III ou IV). Il est à noter que toutes les patientes incluses ont pu terminer leur protocole de traitement.
Il a été recensé 77.1 % d'effets secondaires de grade III ou plus dans le groupe Pembrolizumab vs 73.3 % des cas dans le groupe placebo. Les effets secondaires immuno-médiés ont été observé dans 35 % des cas dans le groupe Pembrolizumab avec 13 % de grade III ou plus, avec 0,2 % (2) des cas qui ont eu des effets immuns médiés à l'origine d'un décès.
Discussion / Conclusion
Nous avions déjà les résultats de cette étude sur l'augmentation du nombre de réponses pathologiques complètes mais nous attendions encore les résultats de survie globale à 5 ans. Cette étude de phase III confirme que l'ajout du Pembrolizumab en néoadjuvant et adjuvant au schéma classique de traitement du cancer du sein triple négatif non métastatique en première ligne améliore significativement la survie globale des patientes par rapport au groupe Placebo (de 5 %).
L'augmentation de la survie globale des patientes dans le groupe Pembrolizumab est essentiellement à mettre en lien avec l'augmentation du nombre de réponses pathologiques complètes et à la diminution du nombre de récidive obtenue par rapport au groupe placebo.
Les patientes du groupe Pembrolizumab-chimiothérapie bénéficient d'une augmentation de la survie sans événement significatif à 60 mois ce qui est d'autant plus important que l'on sait que le cancer du sein triple négatif rechute principalement (90 %) dans les cinq premières années.
Le profil d'effets secondaires du groupe Pembrolizumab en association avec une chimiothérapie suggère un profil de toxicité acceptable avec notamment de nombreux effets secondaires de bas grade réversibles sous traitement médical non invasif.
Les études ancillaires sont en cours avec notamment l'analyse de la réponse clinique en fonction du taux d'expression de PDL1 par les cellules tumorales.
À noter qu'une analyse en sous-groupe chez les patientes supérieur ou égale à 65 ans, avec un faible effectif (84 patientes dans le groupe Pembrolizumab et 48 patientes dans le groupe Placebo) a été réalisée ne retrouvant pas de différence significative de survenue d'évènement entre le groupe Pembrolizumab et le groupe Placebo. Il faut toutefois rester prudent sur l'utilisation du Pembrolizumab dans cette population qui est plus fragile, avec un traitement à l'origine d'effets indésirables même chez les plus jeunes.
Une autre question ouverte à la suite de cette étude est la place de la Capécitabine pour les patientes qui ne sont pas en réponse pathologique complète en situation adjuvante. En effet, la Capécitabine fait habituellement partie du traitement de référence en adjuvant dans le cas de non réponse complète. Cette étude ne répond donc pas à la question du traitement de choix dans cette situation (Capecitabine vs Pembrolizumab vs Capécitabine+Pembrolizumab ?).
Références
1. Cortes J, Cescon DW, Rugo HS, Nowecki Z, Im SA, Yusof MM, Gallardo C, Lipatov O, Barrios CH, Holgado E, Iwata H, Masuda N, Otero MT, Gokmen E, Loi S, Guo Z, Zhao J, Aktan G, Karantza V, Schmid P; KEYNOTE-355 Investigators. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer (KEYNOTE-355): a randomised, placebo-controlled, double blind, phase 3 clinical trial. Lancet. 2020 Dec 5;396(10265):1817-1828. doi: 10.1016/S0140-6736(20)32531-9. PMID: 33278935.
2. Schmid P, Cortes J, Pusztai L, McArthur H, Kümmel S, Bergh J, Denkert C, Park YH, Hui R, Harbeck N, Takahashi M, Foukakis T, Fasching PA, Cardoso F, Untch M, Jia L, Karantza V, Zhao J, Aktan G, Dent R, O'Shaughnessy J; KEY NOTE-522 Investigators. Pembrolizumab for Early Triple-Negative Breast Cancer. N Engl J Med. 2020 Feb 27;382(9):810-821. doi: 10.1056/NEJMoa1910549. PMID: 32101663.

Tiphaine KERAMBRUN
Interne en Gynécologie
Médicale, 3ème semestre
Caen

Dr François CHERIFI
Oncologue médical
CCA au CLCC François Baclesse
Caen

