Cette année encore, l'AERIO et l'AFIHGE se sont associées pour organiser une soirée de formation dédiée aux cancers colorectaux localisés. Nous remercions très chaleureusement les intervenants, le Dr Gallois (Paris), le Dr Durand Labrunie (Villejuif), et le Pr Pioche (Lyon).
Ce format Question/Réponse revient sur les points clés de la soirée, bonne lecture.
La chimiothérapie adjuvante dans les cancers du côlon, pour quels patients ?
Le premier objectif d'un traitement adjuvant est la guérison ! Avant l'initiation d'un traitement, il est indispensable de bien évaluer le patient et ses comorbidités. En effet, environ 15-20 % des patients bénéficieront réellement du traitement adjuvant pour les tumeurs du côlon stade III, le reste des patients étant guéris par la chirurgie seule (environ 60 %) et 20 % rechuteront malgré la chimiothérapie adjuvante. Pour les stades II, c'est seulement 5 % des patients qui bénéficieront d'un traitement adjuvant.
Les patients âgés (supérieure à70 ans) doivent préférentiellement avoir une évaluation onco-gériatrique. L'âge n'est pas un critère suffisant pour limiter le traitement adjuvant.
En effet, le 5FU adjuvant a bien démontré son bénéfice dans cette population.
La chimiothérapie adjuvante dans les cancers du côlon, pour combien de temps?
Pour les cancers du côlon stade III, c'est l'essai MOSAIC en 2004 qui a démontré la supériorité du FOLFOX par rapport au 5FU avec une réduction du risque de récidive de 23 %. Depuis, ce traitement est devenu le standard européen.
La durée du traitement adjuvant (3 ou 6 mois) a été étudiée par la grande étude multicentrique IDEA. Nous pouvons retenir schématiquement pour nos pratiques qu'une tumeur stade III opérée sera traitée préférentiellement en adjuvant par CAPOX 3 mois si T1,2,3 – N1, et FOLFOX 6 mois si T4 et/ou N2. Les recommandations ESMO 2020 reviennent sur les options thérapeutiques disponibles (Figure 1).
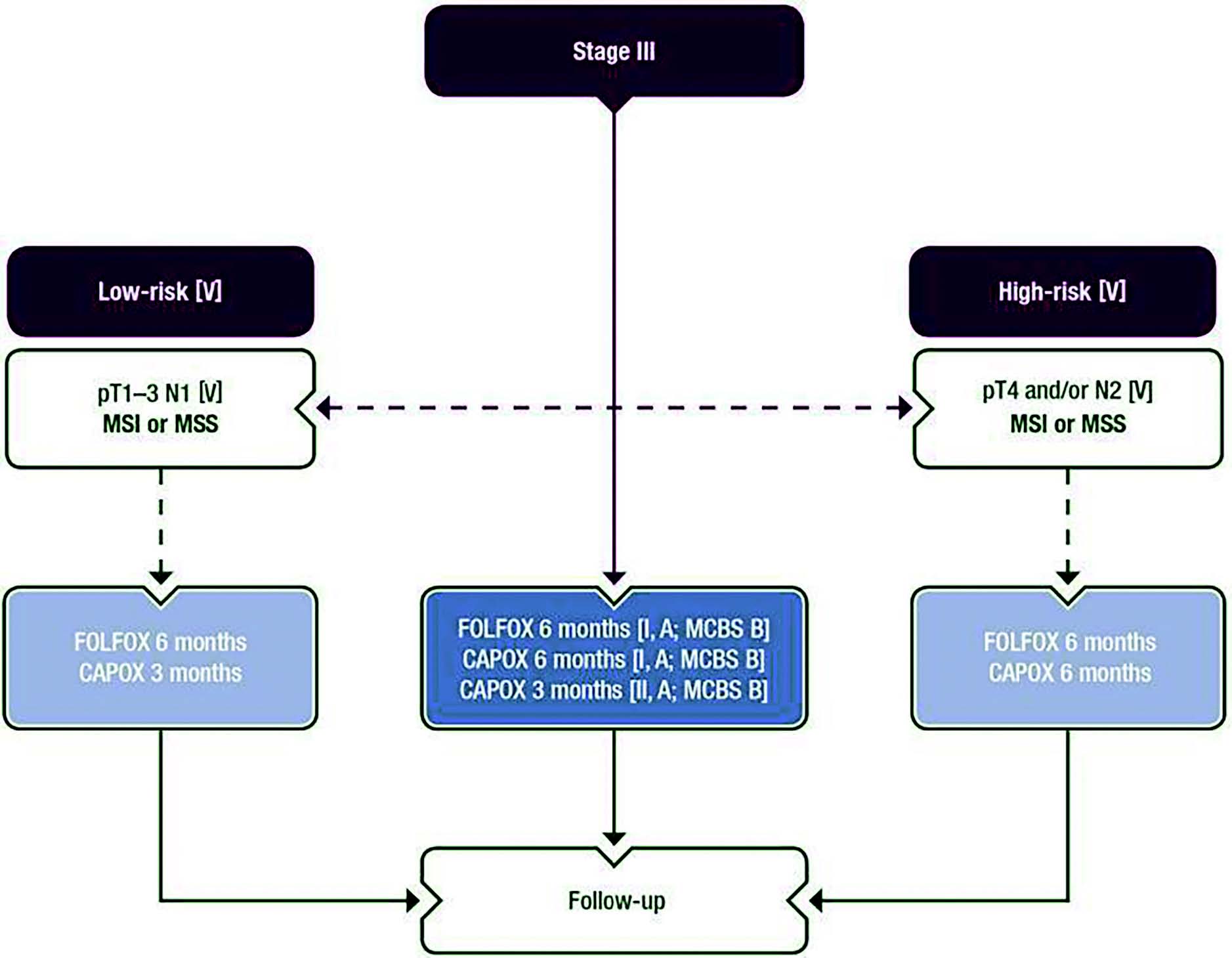
Figure 1 : Recommandations ESMO 2020 pour le traitement adjuvant des tumeurs du côlon stade III.
Notons l'importance de surveiller l'apparition d'une neuropathie à l'oxaliplatine. Cette vigilance doit nous conduire à arrêter les administrations d'oxaliplatine tout en continuant le 5FU jusqu'à l'apparition d'une toxicité grade 2 ou plus. En effet, l'arrêt de l'oxaliplatine à 3/4 des cycles ne diminue pas le pronostic avec la poursuite du 5FU seul pendant les 6 mois de traitement totaux. Les patients peuvent être rassurés !
En ce qui concerne les tumeurs du côlon stade II, résumons les traitements et durées ainsi :
• Pas de chimiothérapie adjuvante pour les tumeurs MSI. Si critère de mauvais pronostic, et décisions de traiter par chimiothérapie, il faudra alors favoriser l'oxaliplatine, le 5FU pouvant être potentiellement délétère (Sargent et al., JCO, 2010).
• Pour les tumeurs à haut risque : CAPOX 3 mois.
• Pour les tumeurs MSS de risque intermédiaire : 5FU ou capécitabine pendant 6 mois.
• Pour les tumeurs à bas risque: surveillance.
Les recommandations ESMO 2020 reviennent sur les options thérapeutiques pour les stade II (Figure 2).
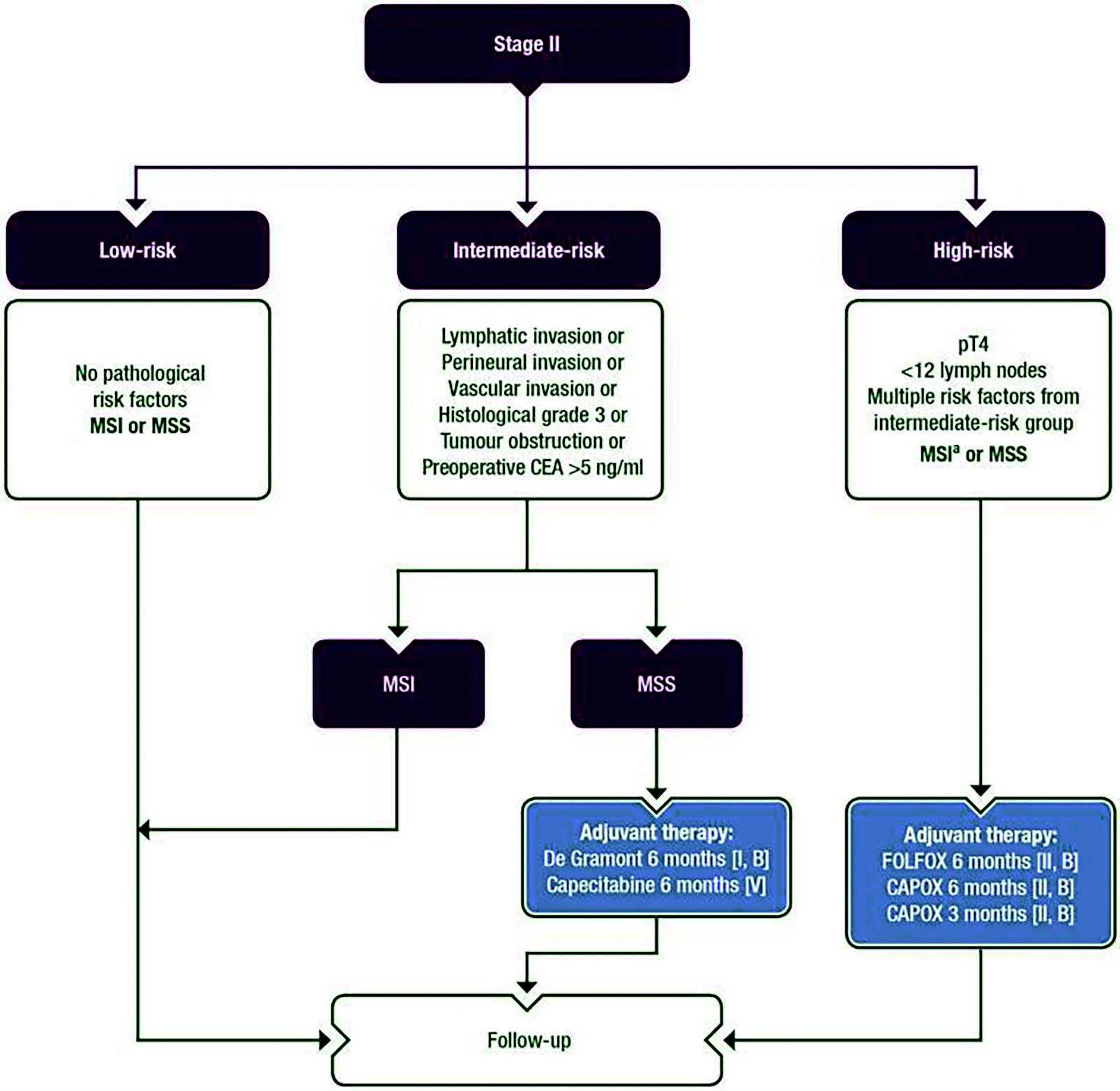
Figure 2 : Recommandations ESMO 2020 pour le traitement adjuvant des tumeurs du côlon stade II.
Comment y voir plus clair sur l'hétérogénéité des stade II?
Pour simplifier, nous allons caractériser les facteurs pronostiques utilisés en pratique clinique. On distingue ainsi:
• Les facteurs à haut risque, c'est-à-dire une lésion pT4, et/ ou moins de 12 ganglions examinés.
• Les facteurs de risque intermédiaires que sont la perforation tumorale, les emboles veineux/ péri-nerveux/lymphatiques, une différenciation pauvre (pour les MSS) et enfin +/- le diagnostic réalisé sur une occlusion tumorale opérée en urgence, des cellules néoplasiques isolées dans un ganglion N0 et un ACE préopératoire supérieure à 5 ng/mL.
Il est important de retenir que les tumeurs stade II MSI ont un excellent pronostic. Pour ces dernières, il a même été montré qu'une chimiothérapie adjuvante à base de 5FU pourrait avoir un effet délétère sur la survie (Sargent et al., JCO, 2010).
La détermination du statut MSI est donc indispensable pour poser l'indication d'une chimiothérapie adjuvante.
Qu'en est-il des traitements néo-adjuvants ?
Rappelons que les principaux intérêts d'un traitement néo-adjuvant sont de permettre de mieux délivrer un traitement de chimiothérapie à des patients qui ne seraient pas en état de le recevoir en post-opératoire, et de permettre potentiellement une chirurgie plus efficace avec un « downstaging ».
Un traitement par FOLFOX 3 mois en néo-adjuvant semblait intéressant après l'essai FOxTROT, avec cependant un faible niveau de preuve. La référence actuelle reste la chirurgie d'emblée pour les tumeurs MSS. En ce qui concerne les tumeurs MSI, deux études importantes récentes NICHE 1 et 2 ont permis de démontrer un bénéfice important de la double immunothérapie par nivolumab et ipilimumab avec 67 % de réponse pathologique complète et 95 % de réponse majeure ! À l'avenir, l'ADN tumoral circulant (comme biomarqueur de rechute en post-opératoire) et l'Immunoscore pourraient améliorer la stratification du risque et être utilisés en routine dans un future proche.
Comment résumer 3 des essais majeurs de traitement des tumeurs du rectum en radiothérapie présentés lors de cette soirée ?
L'étude PRODIGE 23 a étudié le rôle de la chimiothérapie néo-adjuvante par mFOLFIRINOX avant la chimio-radiothérapie préopératoire (preop CRT), suivie d'une chirurgie d'exérèse totale du mésorectum (TME) et d'une chimiothérapie adjuvante (CT) dans le cancer rectal localement avancé résécable. Il s'agit d'un essai clinique multicentrique randomisé de phase III. Les patients éligibles avaient des adénocarcinomes rectaux de stade cT3 ou cT4, M0, situés à moins de 15 cm du bord anal, âgés de 18 à 75 ans, et avec un OMS 1. La randomisation a été stratifiée par centre, stade T, status N, emplacement de la tumeur et extension extramurale de la graisse péri-anale. Le critère d'évaluation principal était la survie sans maladie à 3 ans (DFS). Les principaux critères d'évaluation secondaires étaient le taux de ypT0N0, la survie globale (OS) et la survie sans métastases (MFS). Les patients du bras A ont reçu une preop CRT (50 Gy, 2 Gy/fraction + capécitabine), suivi de la chirurgie, puis d'une CT adjuvante pendant 6 mois. Les patients du bras B ont reçu 6 cycles de FOLFIRINOX (oxaliplatine 85 mg/m, leucovorine 400 mg/m , irinotécan 180 mg/m J1, et 5-FU 2,4 g/m sur 46 h) tous les 14 jours, suivis de la même preop CRT, de la chirurgie, et de 3 mois de CT adjuvante.
L'essai OPRA est un essai de phase 2. Les patients atteints d'un cancer rectal de stade II/III ont été assignés de manière aléatoire pour recevoir une chimiothérapie d'induction suivie d'une chimio-radiothérapie ou une chimio-radiothérapie suivie d'une chimiothérapie de consolidation. Les patients qui ont obtenu une réponse complète ou quasi complète après la fin du traitement se sont vu proposer une approche "watch-andwait". Une exérèse totale du mésorectum (TME) était recommandée pour ceux qui n'avaient pas obtenu une réponse complète. Le critère d'évaluation principal était la survie sans maladie (DFS). Le critère d'évaluation secondaire était la survie sans TME.
RAPIDO est un essai de phase 3 multicentrique, ouvert, randomisé, contrôlé. Les patients étaient éligibles s'ils avaient plus de 18 ans, OMS 1 et un adénocarcinome rectal localement avancé nouvellement diagnostiqué par biopsie, classé à haut risque sur l'IRM pelvienne. Les patients assignés au groupe de traitement expérimental ont reçu une radiothérapie courte (5 °— 5 Gy sur un maximum de 8 jours), suivie de 6 cycles de chimiothérapie par CAPOX ou 9 cycles de FOLFOX, suivie d'une exérèse totale du mésorectum. Les patients assignés au groupe de traitement standard ont reçu 28 fractions quotidiennes de 1,8 Gy jusqu'à 50,4 Gy ou 25 fractions de 2,0 Gy jusqu'à 50,0 Gy (selon la discrétion de l'investigateur), avec capécitabine orale bi-quotidienne concomitante de 825 mg/m2, suivie d'une exérèse totale du mésorectum et, si stipulé par la politique hospitalière, une chimiothérapie adjuvante avec 8 cycles de CAPOX ou 12 cycles de FOLFOX. Le critère d'évaluation principal était l'échec de traitement lié à la récidive de la maladie à 3 ans.
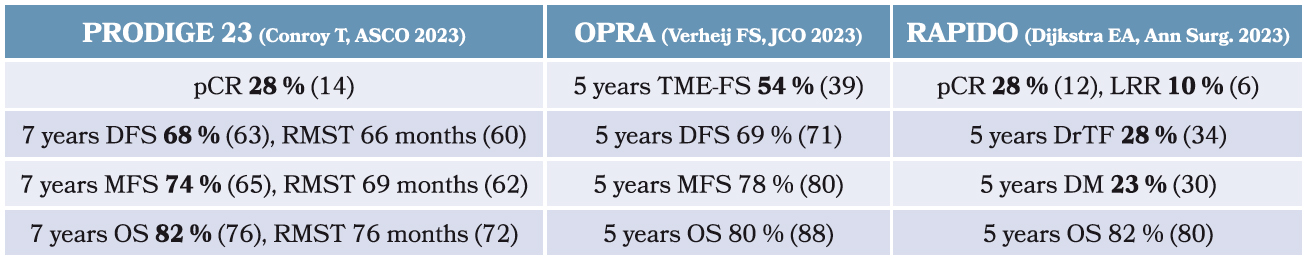
Tableau 1 : Synthèse des résultats des études PRODIGE 23, OPRA et RAPIDO Abbreviations : pathological complete response (pCR), disease-free survival (DFS), restricted median survival time (RMST), overall survival (OS), metastasis-free survival (MFS), locoregional recurrence (LRR), disease-related treatment failure (DrTF), distant metastasis rate (DM), total mesorectal excision free survival (TME-FS).
En conclusion de ces trois études, soulignons le doublement de la réponse pathologique complète dans les essais PRODIGE 23 et RAPIDO et la réduction de 15 % du nombre de TME à 5 ans avec le schéma chimio-radiothérapie puis chimiothérapie de consolidation dans l'essai OPRA.
Quel béné fice à la radiothérapie de contact ?
L'essai OPERA vise à évaluer si l'escalade de la dose avec un boost de radiothérapie endocavitaire à rayons X de contact (CXB) améliore la préservation d'organes par rapport à un boost de radiothérapie externe (EBRT). Il s'agit d'un essai européen de phase 3 multicentrique qui randomisé des patients avec un stade cT2-3a-b, cN0-1, M0 pour recevoir une radiothérapie préopératoire concomitante à la chimiothérapie (EBCRT) (45 Gy en 25 fractions sur 5 semaines avec de la capécitabine orale à 825 mg/m2) suivie d'une dose supplémentaire de radiothérapie (EBRT) (9 Gy en 5 fractions sur 5 jours) ou une EBCRT suivie d'une dose supplémentaire avec un boost de radiothérapie de contact (CXB) (90 Gy en 3 fractions sur 4 semaines).
Une exérèse locale ou une chirurgie d'exérèse totale du mésorectum (TME) a été proposée en cas de maladie résiduelle ou de reprise locale, selon la préférence du patient et du chirurgien. Cette étude est très positive avec 81 % de préservation d'organes dans le bras avec radiothérapie de contact vs 59 % dans le bras contrôle (Figure 3).
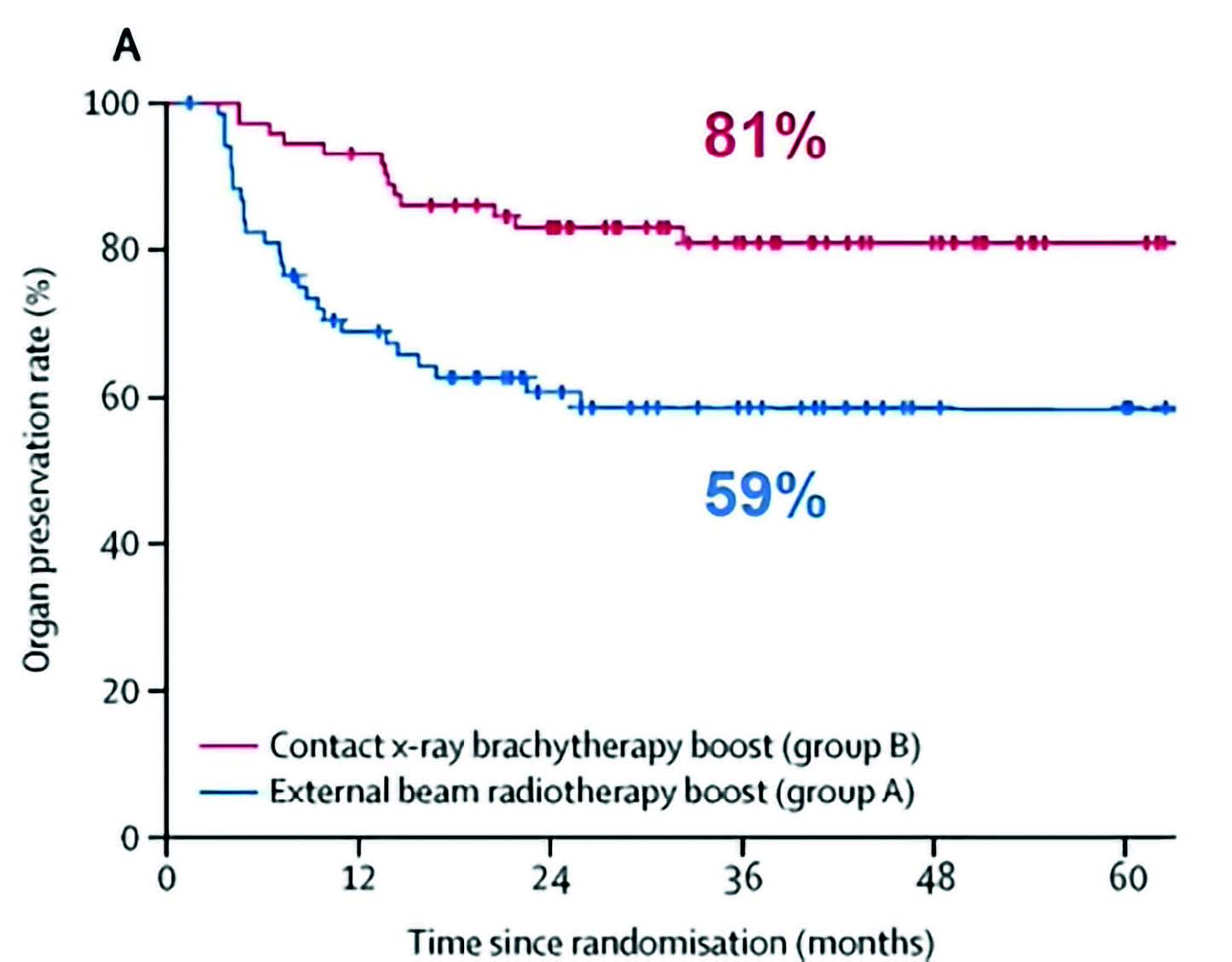
Figure 3 : Résultat principal de l'essai OPERA.
Pourquoi des gastro-entérologues endoscopistes ?
Le dépistage du cancer colorectal (CCR) est un problème de santé publique majeur. L'utilisation de la coloscopie chez les populations à risque a permis de diminuer son incidence et sa mortalité. Le rôle de l'endoscopiste ne se limite pas à détecter les lésions, il doit aussi être capable de les caractériser correctement afin de proposer la meilleure stratégie thérapeutique de résection.
Une résection de lésion en endoscopie bien guidée va ainsi éviter au patient une chirurgie parfois futile et morbide. Pour rappel, la colectomie est associée à des taux de 20 % de morbidité et 1 % de mortalité alors que les dissections sous-muqueuses en endoscopie n'entraînent que 0.5 % de reprise chirurgicale pour complication et 0 % de mortalité. Attention toutefois à rester humble et ne pas vouloir se substituer aux chirurgiens lorsque la lésion n'est objectivement pas résécable en endoscopie.
Quelles sont les différentes classifications permettant de prédire la nature d'une lésion et d'adapter la stratégie thérapeutique ?
Il existe de multiples classifications pour aider à la caractérisation des lésions rencontrées en endoscopie.
Tout d'abord, il est primordial de commencer l'examen en lumière blanche et à distance de la muqueuse afin d'évaluer la taille, la couleur, la présence d'ulcération ou non d'un polype. Cet examen permet de classer la lésion selon la classification de PARIS (Figure 4) et ainsi estimer le risque que la lésion contient du cancer T1. Pour rappel, cette classification doit apparaître obligatoirement sur un CR d'endoscopie. Pour les lésions à invasion latérale (LST), une classification spécifique doit être utilisée (Figure 5).
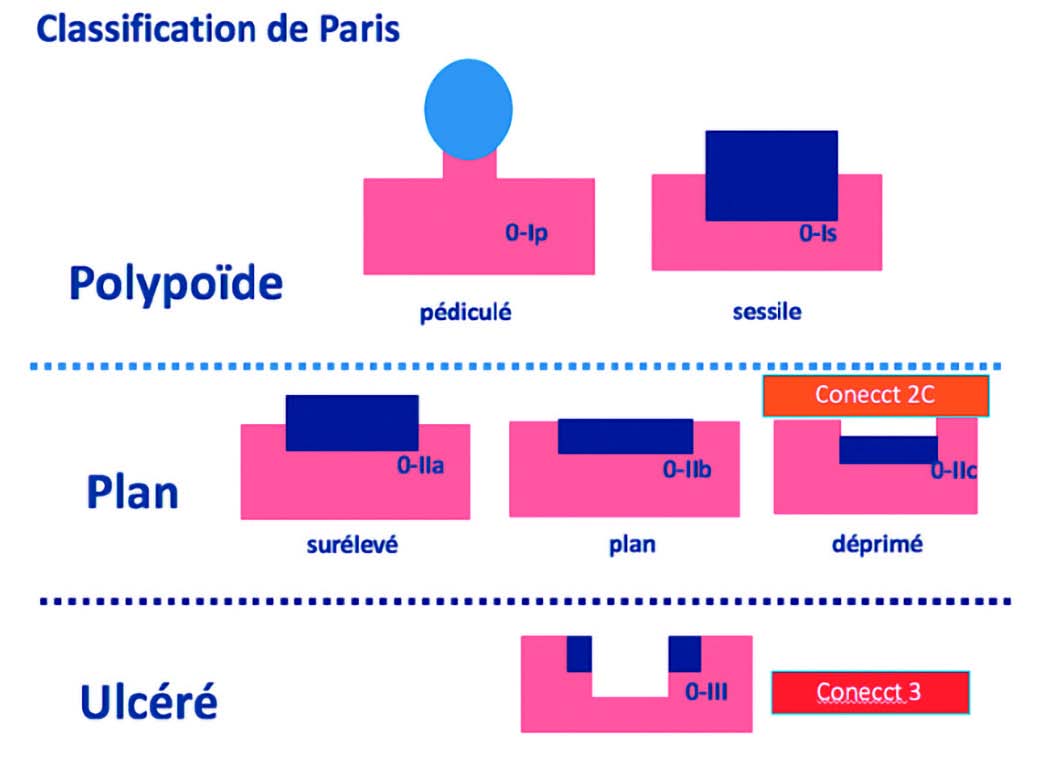
Figure 4 : Classification de PARIS.
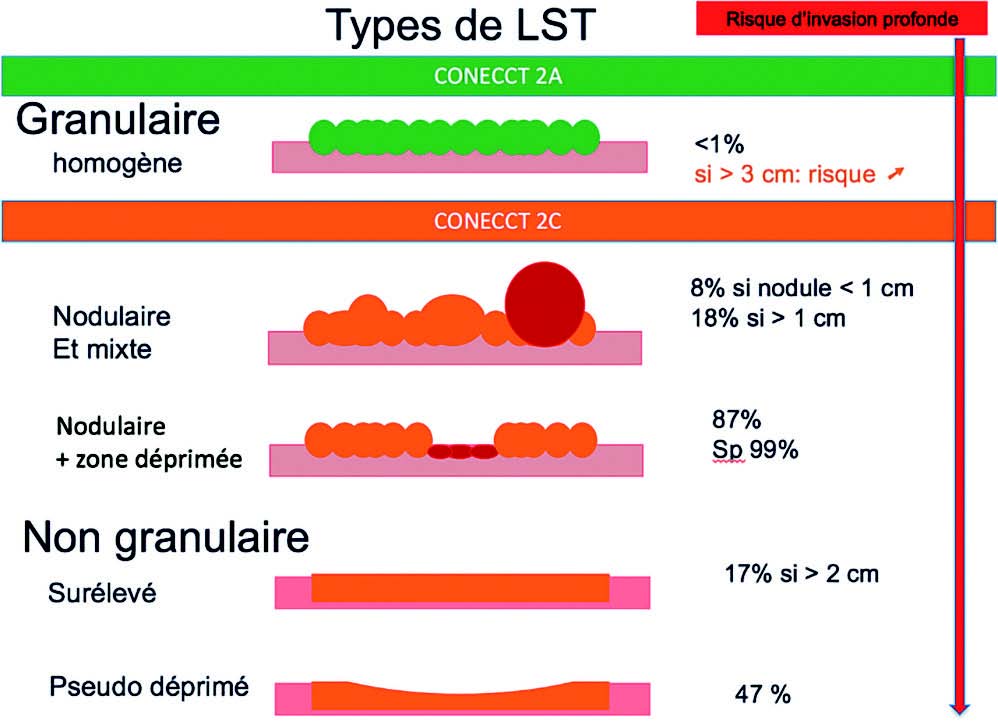
Figure 5 : Classification macroscopique des LST.
Certains « Red sign » doivent faireexaminer de manière plus précise lalésion : la présence d'une zone déprimée,une coloration suspecte (rouge en lumière blanche, plus claire ou verte en chromo-endoscopie virtuelle NBI : narrow band imaging), une zone démarquée ou bien un aspect en « peau de poulet » autour de la lésion. Dans ce cas, un examen centré sur la zone d'intérêt, à l'aide de coloration virtuelle, doit être réalisé (idéalement en underwater pour une meilleure exploration). Cela va permettre d'analyser, notamment, l'architecture des cryptes et des vaisseaux (utilisée dans les classification KUDO et SANO).
La contraction de toutes ces classifications et leurs implications thérapeutiques est très bien résumée dans la nouvelle classification CONECCT (Figure 6).
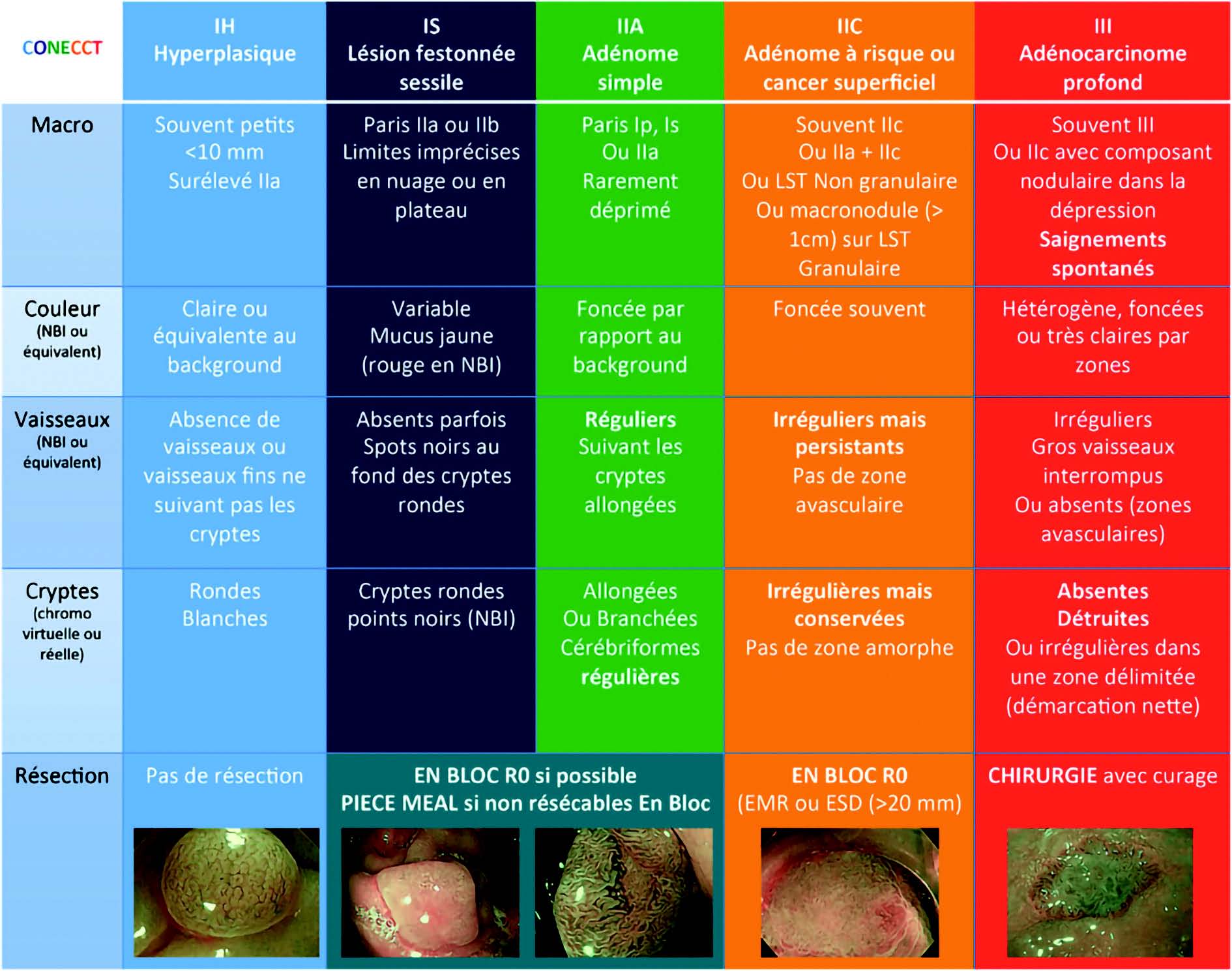
Figure 6 : Classification CONECCT.
En résumé, quelles résections pour quelles lésions ?
Devant une lésion bénigne sans risque de dégénérescence (un polype hyperplastique du rectum par exemple), l'abstention est le meilleur traitement.
Les lésions inférieures à 10mm étant majoritairement bénignes, leur résection doit être réalisée à l'aide d'une anse froide.
En cas de lésion supérieure à20mm, il existe plusieurs options. La mucosectomie piece-meal est plus simple de réalisation et facile d'accès mais, en cas de lésion à risque, elle donnera de moins bons critères carcinologiques (pas de marge mesurable, tumeur dégradée, perte d'information).
La dissection sous-muqueuse en monobloc permet d'obtenir le R0 et offre ainsi de meilleurs critères carcinologiques.
Une lésion suspecte d'avoir une invasion profonde nécessitera l'intervention des chirurgiens pour une colectomie avec curage ganglionnaire.
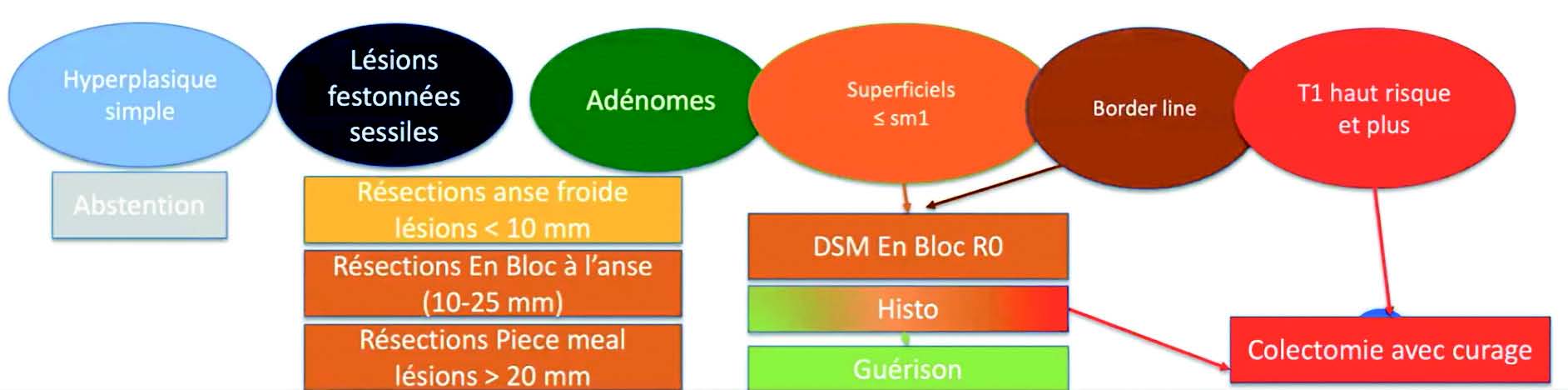
Figure 7 : Types de résection adaptées aux lésions coliques.
Quel est l'intérêt d'une bonne résection pour l'anatomopathologie (et donc pour le patient) ?
Il paraît évident que la priorité de la résection est de permettre de retirer l'ensemble du cancer avec des marges de sécurité (R0).
Néanmoins, il est important de garder en tête, lors de la lecture d'un compte-rendu d'anatomopathologie, que la pièce n'est pas analysée dans son intégralité.
• Lorsqu'elle provient d'une endoscopie, les coupes sont réalisées tous les 2 mm et l'analyse est faite sur environ 8 m sur chaque coupe, soit au 0.4 % du volume tumoral exploré.
• Lorsqu'elle vient d'une colectomie, les coupes sont réalisées tous les 5mm, pour une analyse également d'environ 8 m sur chaque coupe, soit 0.1 % du volume tumoral exploré.
Cette potentielle perte n'est pas sans conséquence. Un embole manqué multiplie le risque de métastase ganglionnaire par 10. Il est multiplié par 6 en cas de budding manqué. En revanche, il semblerait qu'une mesure imprécise du degré d'invasion sous-muqueux ne soit pas associée à un fort surrisque métastatique.
Les facteurs de risques de rechute métastatique ganglionnaire sont : la présence d'emboles, de budding ou d'un contingent indifférencié, et dans une moindre mesure une invasion sm supérieure à 1000 m.

Margaux DELHOMME
AFIHGE
Inès DALMON
Montpellier
Paul MATTE
AERIO




