Patient-Reported Outcomes in OlympiA: A Phase III, Randomized, PlaceboControlled Trial of Adjuvant Olaparib in g BRCA1/2 Mutations and High-Risk Human Epidermal Growth Factor Receptor 2-Negative Early Breast Cancer
Patricia Ganz and al, JCO février 2024
Mots-clés
Early breast cancer, BRCA1/2 mutation, PARP inhibitor, Patient-reported outcomes (PROs), Quality of life
Les mutations BRCA 1 et 2 concernent environ 5 % des patientes suivies pour un cancer du sein. Il s'agit principalement de cancers triples négatifs, avec des mécanismes carcinogènes en lien avec un déficit de la recombinaison homologue (1). Les inhibiteurs de PARP (poly-ADP-ribose-polymérase), dont fait partie l'Olaparib, exploitent le principe de la létalité synthétique pour tuer sélectivement les cellules tumorales (2). L'essai OlympiA s'est intéressé à l'utilisation de l'Olaparib en situation adjuvante pendant 1 an après chimiothérapie chirurgie +/- radiothérapie et hormonothérapie, chez des patientes BRCA mutées HER2 non amplifiées. Les résultats de cette étude parus en 2022 dans le Journal of Clinical Oncology rapportaient un bénéfice en survie sans progression et en survie globale après chimiothérapie (néo)adjuvante dans le cadre de cancers triples négatifs à haut risque de récidive (3). Des études observationnelles avaient par le passé constaté que la chimiothérapie pouvait être source de fatigue après traitement pour un cancer du sein chez 25 à 50 % des patientes (4). L'objectif principal de l'étude est d'évaluer les résultats rapportés par les patients (PROs) dans l'essai OlympiA.
Matériel et méthodes
Il s'agit d'une étude de phase III, contrôlée, randomisée contre placebo. Les 1538 patientes incluses sont celles de l'étude OlympiA c'est-à-dire des patientes BRCA mutées suivie pour un cancer du sein localisé à haut risque de récidive, sous Olaparib ou placebo adjuvant pendant 1 an. Seules ont été incluses les patientes ayant rempli tous les questionnaires.
Le critère d'évaluation principal était la fatigue, mesurée à l'aide de l'échelle d'évaluation fonctionnelle de la fatigue liée au traitement des maladies chroniques (FACIT-Fatigue).
Les critères d'évaluation secondaires, évalués à l'aide du questionnaire EORTC QLQ-C30 comprenaient les nausées et vomissements (NV), la diarrhée et plusieurs domaines fonctionnels.
Les questionnaires devaient être remplis avant la randomisation puis pendant le traitement (c'est-à-dire à 6 et 12ème mois) et à distance (le 18 et 24ème mois).
Les résultats étaient analysés sous forme de différence de score entre les groupes, avec un score cliniquement significatif défini par une différentielle de 3 points. Les résultats étaient stratifiés selon la séquence thérapeutique, après traitement néo-adjuvante (NACT) et adjuvante (ACT).
Résultats
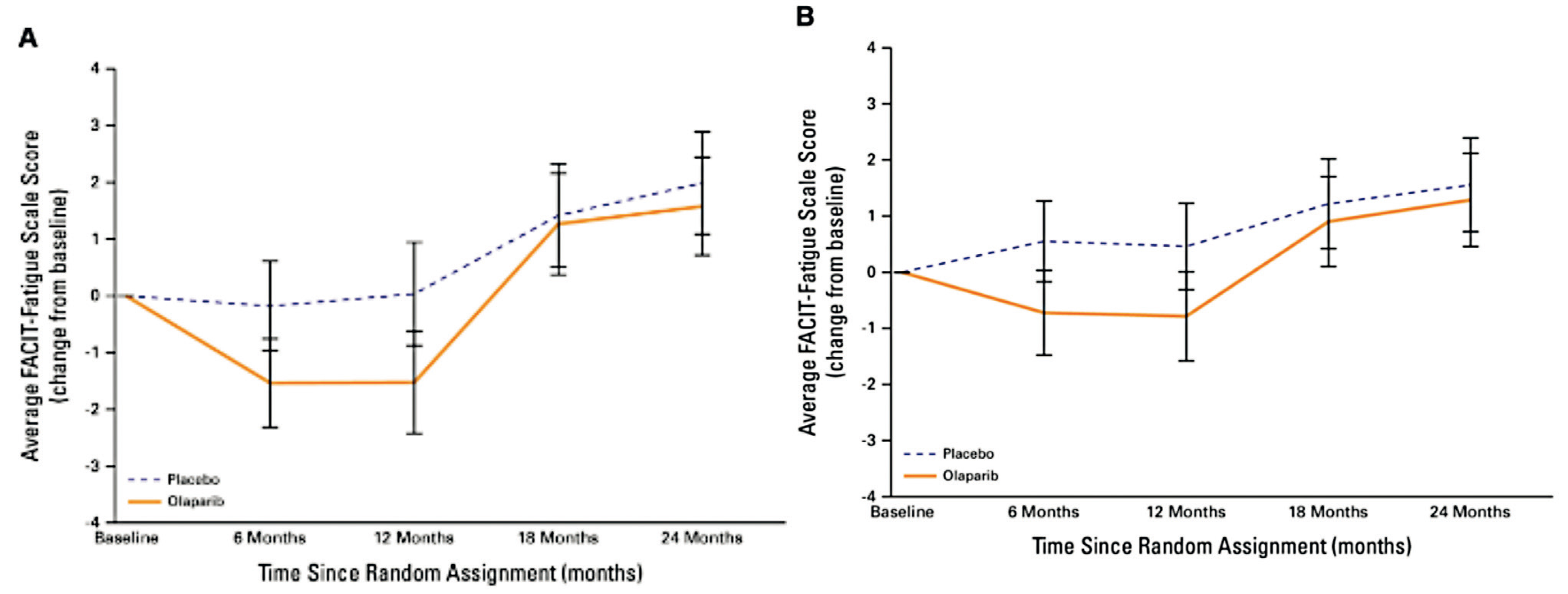
La gravité de la fatigue était sur le plan statistique significativement plus élevée chez les patientes traitées par Olaparib que par placebo à 6 mois avec une différence de –1,3 en situation néo-adjuvante et adjuvante ([IC à 95 %, –2,4 à –0,2] ; P = 0,022 et [–2,3 à –0,2] ; P = 0,01 respectivement). Les résultats étaient similaires à 12 mois (NACT : –1,6 [–2,8 à –0,3] ; P = 0,017 ; ACT : –1,3 [–2,4 à –0,2] ; P = 0,025). La différence de 3 points n'étant pas atteinte, il n'y avait pas de différence cliniquement significative.
Aucune différence significative n'a été observée dans la gravité de la fatigue entre les groupes de traitement à 18 et 24 mois.
La gravité des nausées / vomissements était plus importante chez les patients traités par Olaparib que chez les patients traités par placebo à 6 mois (NACT : 6,0 [IC à 95 %, 4,1 à 8,0] ; ACT : 5,3 [IC à 95 %, 3,4 à 7,2]) et à 12 mois (NACT : 6,4 [IC à 95 %, 4,4 à 8,3] ; ACT : 4,5 [IC à 95 %, 2,8 à 6,1])
Les scores de qualité de vie globale, le fonctionnement physique et émotionnel et les douleurs des patientes traitées par Olaparib étaient comparables à ceux du groupe placebo.
Discussion
Cette étude comparative avec groupe placebo a permis de cibler spécifiquement les symptômes imputables directement à l'Olaparib. Elle a mis en évidence une différence significative quantitativement en termes de fatigue, mais qui n'a pas été jugée quantitativement suffisante par les auteurs.
Un biais des études observationnelles de qualité de vie en situation adjuvante, sont que les effets secondaires de la chimiothérapie et notamment la fatigue peuvent persister à distance de l'arrêt des traitements.
Une des limites de cette étude concerne les données manquantes au cours du suivi. Les taux d'adhésion au questionnaire variaient de 97 % lors de l'évaluation à 6 mois à 69 % lors de l'évaluation à 24 mois.
L'étude a trouvé une différence de fatigue qui n'a pas été jugée cliniquement significative entre les groupes. De plus, les niveaux moyens de fatigue n'ont pas changé entre le début du traitement et à 12 mois dans le groupe placebo, ce qui reflète probablement une récupération plus lente après des traitements plus intensifs dans cette population à haut risque.
Les auteurs rapportent également davantage de nausées et vomissements avec l'Olaparib, effet indésirable bien connu de ce traitement. Il n'y avait pas de différence significative des scores de qualité de vie globale.
Conclusion
L'étude OlympiA démontre que l'utilisation d'Olaparib en tant que traitement adjuvant chez les patientes atteints de cancer du sein avec mutation BRCA1/2, négatif pour HER2, maintiennent une qualité de vie globale comparable à celle des patients recevant un placebo. Bien que des symptômes tels que la fatigue et les nausées soient légèrement augmentés, ils n'affectent pas de manière significative le fonctionnement physique ou émotionnel des patientes. Ces résultats soutiennent l'utilisation d'Olaparib comme une option thérapeutique bien tolérée, qui ne compromet pas la qualité de vie des patients.
Take Home Messages
- Gestion des symptômes : Les symptômes comme la fatigue et les nausées, évaluées par les patients, sont plus fréquents lors du traitement avec les inhibiteurs de PARP.
- Bonne tolérance et maintien de la qualité de vie : La majorité des patients ont pu suivre et terminer le traitement d'un an, et les échelles de qualité de vie étaient similaires dans les 2 bras, indiquant une bonne tolérance globale à l'Olaparib.

Raphaëlle SAVARINO
Interne en Gynécologie Médicale
6ème semestre
Paris

Dr Paul GOUGIS
Département d'Oncologie Médicale
Hôpital Pitié-Salpêtrière
Références
1. Davies H, Glodzik D, Morganella S, et al. HRDetect is a predictor of BRCA1 and BRCA2 deficiency based on mutational signatures. Nat Med 2017 ;23 :517-525.
2. Tutt AN, Lord CJ, McCabe N, et al. Exploiting the DNA repair defect in BRCA mutant cells in the design of new therapeutic strategies against cancer. Cold Spring Harb Symp Quant Biol 2005 ;70 :139-148.
3. Andrew NJ Tutt MB, Ch.B and all, Adjuvant Olaparib for Patients with BRCA1 or BRCA2 Mutated Breast Cancer. N Engl J Med 2021 DOI : 10.1056/NEJMoa2105215.
4. Bower JE, Ganz PA, Desmond KA, et al. Fatigue in breast cancer survivors: incidence, correlates, and impact on quality of life. J Clin Oncol 18 :743-753, 2000.

