
Réponse : A B C
Le bilan initial de diarrhée aiguë doit comprendre des coprocultures avec PCR multiplex permettant d'identifier un large panel de bactéries et de virus impliqués dans les iléocolites infectieuses (les plus fréquentes : Campylobacter spp, Salmonella enterica non typhi, Yersinia spp, E.coli producteur de Shiga-toxine et Shigella spp[1]). Les résultats sont rendus plus rapidement que la culture.
Par ailleurs, il faut rechercher systématiquement une infection à Clostridium difficile (ICD) toxinogène même en l'absence d'antibiothérapie récente. En effet, dans 30 % des cas de colite à C. difficile communautaire, aucun facteur de risque ou de prise d'antibiotique n'est identifié [2]. Le diagnostic d'ICD repose sur l'association d'un tableau clinique évocateur et d'une microbiologie en faveur : la glutamate déshydrogénase GDH est une enzyme spécifique de Clostridium difficile (CD) et son identification signe la présence de CD toxinogène ou non. Il faut donc coupler ce test immuno-enzymatique à des examens permettant de rechercher la production effective in vivo des toxines A et B (par technique ELISA).
En l'absence d'immunodépression, il n'y a pas d'indication à une recherche de colite à CMV.
En l'absence de retour de voyage d'une zone d'endémie parasitaire, il n'y a pas d'indication à réaliser un examen parasitologique des selles.
Enfin, il faut mentionner la nécessité en cas de rectite isolée, la nécessité de rechercher des infections sexuellement transmissibles (gonocoque, chlamydia, syphilis, herpès) par l'interrogatoire et écouvillon rectal.
Réponse : B
Devant un tableau clinique bruyant d'iléocolite infectieuse, il y a une indication à débuter une antibiothérapie probabiliste après prélèvements de selles, un traitement symptomatique seul ne suffit pas.
La première cause d'iléocolite infectieuse est Campylobacter jejuni ; l'émergence de résistance aux fl uoroquinolones de cette bactérie justifie de prescrire en première intention l'azithromycine en vérifiant l'absence de contre-indications (allongement de l'intervalle QT notamment). En cas d'identification de Yersinia spp. ou d'évolution défavorable sous azithromycine, une antibiothérapie par ofloxacine sera prescrite. En effet, Yersinia spp. est résistante naturellement aux macrolides. L'association intraveineuse ceftriaxone-métronidazole est réservée aux patients présentant des critères de gravité nécessitant une hospitalisation.
Réponse : D E
Les p-ANCA sont détectés chez 65 % des malades atteints de RCH et 10 % des patients atteints d'une maladie de Crohn [3] [4] ; en raison de leur faible performance diagnostique, la recherche de p-ANCA et d'ASCA n'est pas recommandée [5].
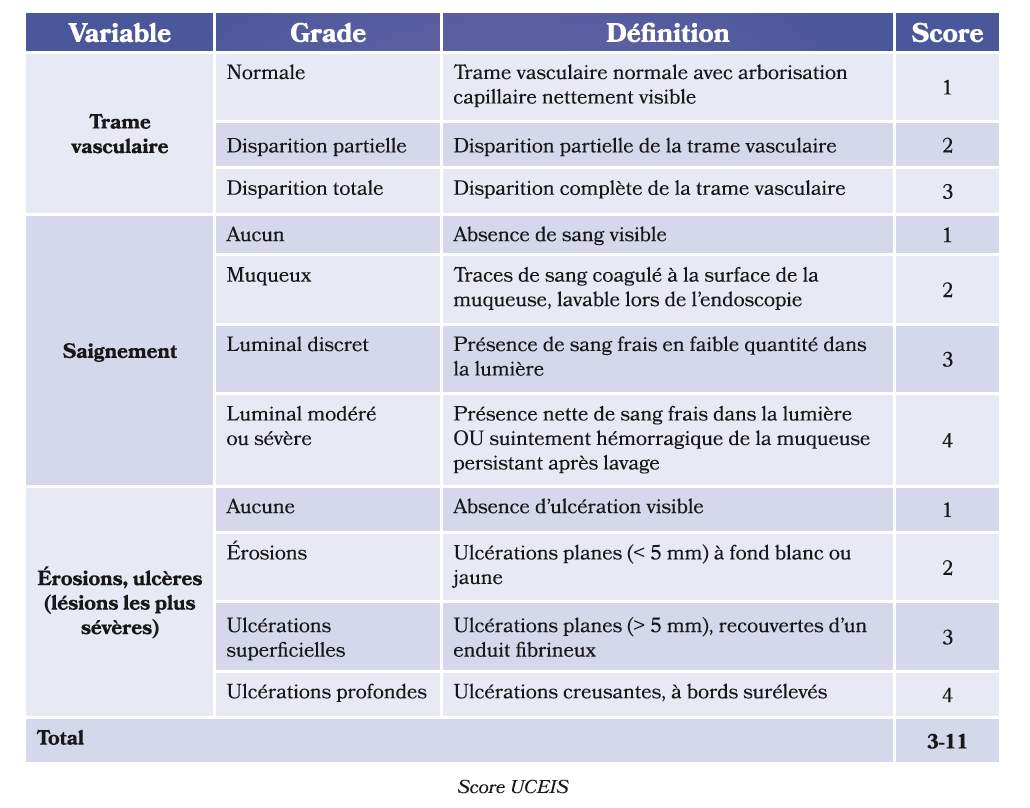
Les 2 scores endoscopiques les plus utilisés sont : Le score endoscopique UCEIS : Il prend en compte la trame vasculaire, le saignement et la présence d'érosions/ulcérations [6].
Le score Mayo :
• Normale : 0
• Anomalies légères (érythème, diminution de la vascularisation, légère fragilité) : 1
• Anomalies modérés (érythème franc, vascularisation non visible, fragilité, érosions) : 2
• Anomalies sévères (saignement spontané, ulcérations) : 3
Le score Mayp est le plus utilisé en pratique quotidienne car le calcul de ce score est simple mais le score UCEIS est le seul score validé. La principale limite du score Mayo est sa faible reproductibilité liée à certains items subjectifs comme la friabilité muqueuse et la difficulté à distinguer les lésions d'intensité légère des lésions modérées (sous-score endoscopique MAYO à 1 versus un score MAYO à 2 par exemple).
On peut retrouver une iléite de reflux chez 20 % des patients atteints de RCH pancolique (E3 de la classification de Montréal).
L'inflammation péri-appendiculaire et l'épargne rectale sont associées à un surrisque de cholangite sclérosante primitive [7].
Réponse : C D
La plasmocytose basale, c'est-à-dire la présence de plasmocytes à la base de la lamina propria ou en dessous des cryptes, est le signe histologique le plus précoce et le plus évocateur de la RCH tandis que la désorganisation architecturale survient plus tardivement. L'atrophie cryptique apparait de façon plus tardive également.
En cas de poussée, l'analyse anatomopathologique met en évidence un infiltrat constitué de polynucléaires neutrophiles et parfois d'éosinophiles. Il y a également des érosions et des ulcérations et une perte de la mucosécrétion, mais cette dernière n'est pas spécifique de la RCH[8] [9] [10].
Il est recommandé d'utiliser l'indice de Nancy (ou indice histopathologique de Robarts, plus complexe à calculer) pour évaluer le degré d'activité histologique de la RCH notamment en période de rémission endoscopique et clinique avec discussion d'un allègement thérapeutique [5]. La persistance de signes inflammatoires histologiques sera un argument en défaveur de cette stratégie. En effet, il a été démontré un risque de récidive plus élevé en cas de persistance d'inflammation histologique[11].
Réponse : C
Le traitement de première intention de la RCH active légère à modérée repose sur les 5-ASA en privilégiant l'association 5-ASA oral (4 g/j) et topique (1 g/j) avec une prise unique journalière afin de favoriser l'observance. En l'absence de réponse clinique au bout de 2 semaines de traitement ou de rémission clinique au bout de 8 semaines, et/ou en cas d'intolérance aux 5-ASA, il faut introduire une corticothérapie systémique mais seulement après avoir éliminé un défaut d'observance ou une autre cause[5].
Réponse : A C D
La calprotectine fécale est une protéine majoritaire du cytoplasme des polynucléaires neutrophiles. Elle est particulièrement résistante aux endoprotéases bactériennes et reste stable plusieurs jours à température ambiante, ce qui en fait un biomarqueur fi able des processus inflammatoires digestifs.
De nombreuses études ont démontré que son dosage permet de prédire plusieurs éléments cliniques :
• Le caractère organique ou non de symptômes digestifs non spécifiques.
• Le risque de rechute sous traitement, après une chirurgie ou une désescalade thérapeutique.
Elle est également corrélée à la cicatrisation muqueuse, aussi bien endoscopique que transmurale.
Bien que la calprotectine fécale ne soit pas spécifique des maladies inflammatoires chroniques de l'intestin toute inflammation digestive, haute ou basse, pouvant en augmenter le taux elle reste un outil essentiel pour guider la prise en charge.
Un taux inférieur à 50 µg/g de selles possède une forte valeur prédictive négative, permettant d'écarter une cause inflammatoire aux diarrhées.
À l'inverse, un taux supérieur à 250 µg/g oriente fortement vers une maladie inflammatoire en poussée[12].
Réponse : B
Le diagnostic positif de colite aiguë grave CAG repose sur les critères de Truelove-Witts[13].
La prise en charge repose sur une rééquilibration hydro-électrolytique, la prévention de la maladie thrombo-embolique veineuse, et un support nutritionnel adapté (nutrition entérale ou parentérale) et une corticothérapie intraveineuse (régime de Truelove). Par ailleurs, la prise en charge de la colite aiguë grave nécessite une discussion médicochirurgicale quotidienne. Il faut envisager une colectomie de sauvetage à chaque étape en cas d'échec du traitement médical.
Une antibiothérapie n'est prescrite qu'en cas de doute sur une cause infectieuse surajoutée.
La corticothérapie par voie intraveineuse (0.8 mg/kg de méthylprednisolone) [14] est débutée sans attendre. Une réévaluation à J3 selon les critères d'Oxford permet de prédire l'échec : une fréquence des évacuations supérieure à 8/jour ou supérieure à 3 associées à une CRP supérieure à 45mg/L prédit le risque de colectomie dans 85 % des cas [15].
En l'absence de réponse, un traitement de 2e ligne doit être proposé par ciclosporine ou infliximab, en poursuivant la corticothérapie.
La recherche par PCR CMV dans les selles n'est pas l'examen à privilégier. Le diagnostic de réactivation du cytomégalovirus (CMV) se fait par [16] :
• La recherche d'une réplication virale sanguine (Polymerase Chain Reaction (PCR) ou Antigénémie pp65).
• La PCR CMV sur les biopsies coliques.
• L'examen anatomopathologique par immunohistochimie et recherche d'inclusions virales (effet cytopathogène du virus).
En cas de surinfection à CMV, la prise en charge repose sur un traitement initial par ganciclovir intraveineux 5 mg/kg deux fois par jour pendant 5 à 10 jours, suivi de valganciclovir 900 mg par jour jusqu'à la fi n d'un traitement de 2 à 3 semaines.

8 Réponse : A B D E
On considère qu'à terme, 20 à 30 % des patients atteints d'une RCH étendue seront opérés.
Le traitement chirurgical classique de la rectocolite hémorragique est représenté par la coloprotectomie totale avec anastomose iléoanale [17]. Du fait du caractère complexe de la proctectomie en conditions inflammatoires au cours de la colite aiguë grave, il est proposé dans un premier temps une colectomie subtotale avec double stomie : iléostomie et sigmoïdostomie. La mortalité de cette chirurgie est inférieure à 1 % actuellement [18].
Le second temps chirurgical consiste en une proctectomie complémentaire avec réalisation d'une anastomose iléoanale avec réservoir en J. Selon les pratiques de centre et facteurs de risque du patient, l'anastomose iléoanale peut être protégée par une iléostomie de décharge qui est fermée dans un troisième temps chirurgical. En dehors de cette procédure, un faible nombre de patients est opéré avec réalisation d'une iléostomie terminale notamment dans des contextes de fonction sphinctérienne ne permettant pas la remise en continuité. Une anastomose iléorectale peut également être proposée au cas par cas notamment chez le sujet âgé après discussion collégiale et selon l'expertise du centre.
Le sepsis pelvien et la fistule anastomotique sont deux complications particulièrement morbides de l'anastomose iléoanale avec un impact majeur sur le résultat fonctionnel et nécessitant parfois la réalisation d'un démontage du réservoir avec iléostomie définitive.
Bibliographie
1. VAN C, CAUTEREN DV, STRAT YL, SOMMEN C, BRUYAND M, TOURDJMAN M, et al. Estimation de la morbidité et de la mortalité liées aux infections d'origine alimentaire en France métropolitaine, 2008-2013. Estim Morb Mortal Liées Aux Infect Orig Aliment En Fr Métropolitaine.
2. Lessa FC, Mu Y, Bamberg WM, Beldavs ZG, Dumyati GK, Dunn JR, et al. Burden of Clostridium diffi cile infection in the United States. N Engl J Med 2015; https://doi.org/10.1056/NEJMoa1408913., 372:825–34.
3. RiisL, Vind I, Vermeire S, et al. The prevalence of genetic and serologic markers in an unselected European population-based cohort of IBD patients. Infl amm Bowel Dis 2007; 24-32., 13 :
4. Joossens S, Daperno M, Shums Z, et al. Interassay and interobserver variability in the detection of antineutrophil cytoplasmic antibodies in patients with ulcerative colitis. Clin Chem 2004; 1422-5., 50 :
5. Amiot A, Viennot S, Uzzan M, Riviere P, Le Cosquer G, Yzet C, Biron A, Gilletta C, Abitbol V, Vuitton L, Nachury M, Simon M, Remy AJ, Nahon S, Faure P, Guillo L, Wils P, Brixi H, Bourrier A, Serrero M, Caillo L, Bouguen G, Laharie D. Recommandations de pratique pour le diagnostic et la prise en charge de la rectocolite hémorragique (version longue). Hépato-Gastro et Oncologie Digestive 2022 ; 29 : e297-e351. doi : 10.1684/hpg.2022.2336TravisSPL,
6. Schnell D, Krzeski P, et al. Reliability and initial validation of the ulcerative colitis endoscopic index of severity. Gastroenterology 2013; 98795., 145 :
7. Rajwal SR, Puntis JWL, McClean P, et al. Endoscopic rectal sparing in children with untreated ulcerative colitis. J Pediatr Gastroenterol Nutr 2004; 66-9., 38 :
8. Langner C, Magro F, Driessen A,et al.The histopathological approach to infl ammatory bowel disease: a practice guide.VirchowsArch2014; 464:511-27.
9. Magro F, Langner C, Driessen A, et al. European consensus on the histopathology of infl ammatory bowel disease. J Crohns Colitis2013; 7:827-51.
10. Magro F, Doherty G, Peyrin-Biroulet L, et al. ECCO position paper: harmonization of the approach to ulcerative colitis histopathology. J Crohns Colitis 2020; 1503-11., 14 :
11. D'Amico F, Guillo L, Baumann C, et al. Histological disease activity measured by the Nancy indexis associated with long-termoutcomes in patients with ulcerative colitis. J Crohns Colitis 2021 ; 15(10) : 1631-40.
12. https://www.fmcgastro.org/texte-postu/postu-2019-paris/quand-et-comment-utiliser-la-calprotectine-fecaleau-cours-des-mici/
13. Truelove SC, Witts LJ. Cortisone in ulcerative colitis. Br Med J 1955; 1041-8., 2 :
14. Turner D, Walsh CM, Steinhart AH, et al. Response to corticosteroids in severe ulcerative colitis: a systematic review of the literature and a metaregression. Clin Gastroenterol Hepatol 2007; 103-10., 5 :
15. Travis SP, Farrant JM, Ricketts C, et al. Predicting outcome in severe ulcerative colitis. Gut 1996; 905-10., 38 :
16. Zidar N, Ferkolj I, Tepeš K, et al. Diagnosing cytomegalovirus in patients with inflammatory bowel disease – by immunohistochemistry or polymerase chain reaction? Virchows Arch 2015; 533-9., 466 :
17. Hahnloser D, Pemberton JH, Wolff BG, Larson DR, Crownhart BS, Dozois RR. The eff ect of ageing on function and quality of life in ileal pouch patients. A single cohort experience of 409 patients with chronic ulcerative colitis. Ann Surg 2004; 615-623., 240:
18. Alves A, Panis Y, Bouhnik Y, Maylin V, Lavergne-Slove A, Valleur P. Subtotal colectomy for severe acute colitis: a twenty-year experience from a tertiary care center. J Am Coll Surg 2003; 379-385., 197:

