CAS CLINIQUE
Patient âgé de 57 ans porteur d’une cardiopathie ischémique stentée à FEVG altérée (30 %) présentant des tableaux d’oedèmes pulmonaires aigus à répétition. Réalisation d’une coronarographie retrouvant une occlusion de la coronaire droite, une resténose significative du tronc commun gauche et de la circonflexe et une sténose significative de l’interventriculaire gauche. La discussion médico-chirurgicale retient l’intérêt de la réalisation d’un pontage aorto-coronarien. Le patient rentre alors à domicile en attente de la chirurgie.
A domicile, le patient appelle le SAMU pour une douleur thoracique intense avec à l’ECG des modifications dynamiques du segment ST sans sus-décalage dans le territoire antérieur étendu, indiquant à une coronarographie en urgence. La coronarographie met en évidence une lésion thrombotique sub-occlusive au niveau du tronc commun avec nécessité d’angioplastie en urgence.
Choix particulier pour sécuriser cette procédure d’angioplastie à haut risque ?
Devant ce tableau de SCA avec sténose sub-occlusive du tronc commun chez un patient tri-tronculaire avec dysfonction VG sévère, décision par l’équipe de mise en place préventive d’une assistance ventriculaire gauche par Impella™ CP par voie fémorale avant revascularisation per cutanée avec implantation d’un stent sur le tronc commun vers la circonflexe proximale. Lors de la procédure, on note plusieurs épisodes de dissociations électro-mécaniques de quelques secondes n’ayant pas entraîné d’arrêt circulatoire.
Complications au décours de la mise en place de l’assistance En post-procédure, apparition d’un bloc atrio-ventriculaire (BAV) complet persistant, probablement lésionnel. Mise en place dans ce contexte d’un défibrillateur triple chambre. L’évolution sera également compliquée d’un abcès au niveau du scarpa droit post-Impella ™ ayant bénéficié d’un drainage chirurgical et d’une antibiothérapie.
Le patient aura également nécessité un pontage ilio-fémoral droit dans le cadre d’un choc hémorragique sur érosion de l’artère fémorale commune droite.
Malgré ces complications, le patient a finalement retrouvé un état hémodynamiquement stable avec une cardiopathie ischémique à FEVG 30 % et depuis une nette régression de sa symptomatologie et notamment des OAP flash.
Focus sur l’impella
Qu’est-ce que l’Impella™ ?
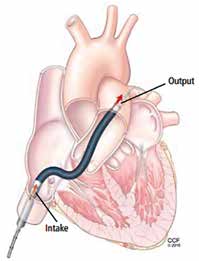
L’Impella™ (Abiomed, Danvers, MA, USA) est une assistance circulatoire percutanée de courte durée (au maximum 2 à 4 semaines), en plein développement, qui est apparue au début des années 2000 (1ère pose en France en 2006) et qui fait partie de la catégorie des LVADs (left ventricular assist device) (Figure 1).
Son principe de fonctionnement est celui d’une vis d’Archimède montée dans un cathéter placé à travers la valve aortique qui aspire le sang dans le ventricule gauche (VG) et le renvoie dans l’aorte ascendante.
Ce dispositif peut assurer un débit continu non-pulsatile de 2.5 L/min (Impella™ 2.5, diamètre 12Fr), de 3.5 L/min (Impella™ C.P, diamètre 14Fr) ou de 5.0 L/min (Impella™ 5.0, diamètre 23Fr) entre le VG et l’aorte. Les Impella™ 2.5 et CP permettent ainsi d’augmenter le débit cardiaque, de décharger le VG (et donc de diminuer les besoins en O2) tout en augmentant les apports en O2 via une augmentation de la perfusion coronaire, mais seule l’Impella™ 5.0 fournit un débit systémique adéquat. Un modèle existe également pour le coeur droit (Impella™ RP), entre ventricule droit et artère pulmonaire1 (Figure 2).
La vitesse de rotation de la vis est de 12’000 à 25’000 tours/min ; celle-ci est refroidie en permanence par une perfusion de glucose additionnée d’héparine en continu. L’implantation peut se réaliser par voie percutanée (voie fémorale ou plus rarement axillaire) ou par implantation chirurgicale (voie transapicale ou transaortique).
Quelles sont les indications de mise sous Impella™ ?
3 indications sont actuellement retenues :
- Angioplastie à haut risque (comme le cas présenté ci-dessus) avec patient pluri-tronculaire, score SYNTAX > 22, FEVG < 35 %, comorbidités sévères de type insuffisance rénale chronique, instabilité hémodynamique...) (figure 3).
- Choc cardiogénique sur défaillance aigue du VG.
- Décharge VG sur ECMO veino-artérielle (en cas d’oedème aigu pulmonaire par exemple).
D’autres indications sont actuellement en cours d’exploration : procédure à risque de TAVI ou d’ablation de tachycardie ventriculaire, choc cardiogénique droit, etc.
Ainsi l’utilisation de l’Impella™ en pré-angioplastie dans un contexte de choc cardiogénique a montré une réduction significative de la mortalité par rapport à son utilisation en post-angioplastie2.
Quelles sont les contre-indications de l’Impella™ ?
A noter certaines situations sont des contre-indications à la mise sous Impella™ :
- Cardiomyopathie hypertrophique obstructive.
- Dissection aortique - Anévrysme de l’aorte ascendante.
- Insuffisance aortique sévère.
- Prothèse mécanique aortique.
- Thrombus intra-ventriculaire gauche.
Quelles sont les mesures à respecter chez un patient sous Impella™ ?
La surveillance sous Impella™ suit la règle des “3 P“ :
- Pansement : À surveiller.
- Purge : Pression à contrôler (cassette de purge avec une solution d’héparine).
- Position : Surveillance du bon positionnement de l’Impella™ par radiographie du thorax et ETT +/- ETO (son extrémité doit être située à 3.5 cm de l’anneau aortique).
Des alarmes peuvent ainsi avertir d’un volume sanguin inadéquat au niveau de la pompe en lien avec une migration de l’Impella™ vers l’apex du ventricule gauche, une hypovolémie en lien avec une hémorragie une déshydratation ou une dysfonction ventriculaire droite.
Exemple de surveillance de l’Impella™
A) Visualisation du montage.
B) CAS 1 : courbe rouge de positionnement qui est de type aortique et la courbe verte de courant moteur qui est pulsatile.
C) CAS 2 : courbe rouge témoigne d’un positionnement de l’Impella™ trop en amont dans la cavité ventriculaire gauche avec un flux moteur devenu plat sur la courbe verte.
D) CAS 3 : courbe rouge montre un flux aortique mais le flux moteur est plat : soit l’Impella™ est placée en position aortique soit cela témoigne d’un volume sanguin inadéquat (choc réfractaire, hypovolémie, sepsis …).
L’ETO est très utile pour en contrôler l’adéquation : lors d’insertion fémorale, l’extrémité distale doit se trouver à 4 cm en-dessous de l’anneau aortique, à distance des muscles papillaires comme vous pouvez le voir sur les figures 4 et 5.
Figures 4
Figures 5
Le sevrage se fera par la suite progressivement.
Attention, il est également à noter que le massage cardiaque externe ne peut se faire chez un patient sous Impella™.
Quelles sont les complications de la mise sous Impella™ ? (figure 6)
Le taux de mortalité chez les patients bénéficiant d’une Impella est d’environ 4 % à 8 %, avec une nette augmentation des décès en cas de pose tardive de l’Impella ™3.
La pose d’une Impella™ entraine environ 8 % de complications7.
Parmi celles-ci, les plus fréquentes sont :
- Hématome (28.6 %),
- Lésion vasculaire (pseudo-anévrysme, FAV…) (17.5 %) ,
- Ischémie de membre (9.8 %),
- Hémorragie majeure (8.5 %),
- Hémolyse (7.5 %),
- Tamponnade (1.7 %).
Références
- Anderson MB, et al. Benefits of a novel percutaneous ventricular assist device for right heart failure: The prospective RECOVER RIGHT study of the Impella RP device. The Journal of Heart and Lung Transplantation. déc 2015;34(12):1549 60.
- Miller PE, et al. Advanced Percutaneous Mechanical Circulatory Support Devices for Cardiogenic Shock: Critical Care Medicine. nov 2017;45(11):1922 9.
- Lazkani M, et al. A retrospective analysis of Impella use in all-comers: 1-year outcomes. Journal of Interventional Cardiology. déc 2017;30(6):577 83.
- Shishehbor MH, et al. Cardiogenic shock: From ECMO to Impella and beyond. Cleveland Clinic Journal of Medicine. 1 avr 2017;84(4):287 95.
- Burzotta F, et al. Impella ventricular support in clinical practice: Collaborative viewpoint from a European expert user group. International Journal of Cardiology. déc 2015;201:684 91.
- Chera HH, et al. Overview of Impella and mechanical devices in cardiogenic shock. Expert Review of Medical Devices. 3 avr 2018;15(4):293 9.
- Lauten A, et al. Percutaneous Left-Ventricular Support With the Impella-2.5–Assist Device in Acute Cardiogenic Shock: Results of the Impella–EUROSHOCK-Registry. Circulation: Heart Failure. janv 2013;6(1):23 30.
- Thiele H, et al. Percutaneous short-term active mechanical support devices in cardiogenic shock: a systematic review and collaborative meta-analysis of randomized trials. European Heart Journal. 14 déc 2017;38(47):3523 31.
- Nalluri N, et al. Utilization of the Impella for hemodynamic support during percutaneous intervention and cardiogenic shock: an insight. Expert Review of Medical Devices. 3 oct 2017;14(10):789 804.
Article paru dans la revue “Collèges des Cardiologues en Formation” / CCF N°7

