
Prise en charge des adénocarcinomes bronchiques avec addiction oncogénique : place des inhibiteurs de tyrosine kinase (ITK)
Le cancer du poumon est un des cancers les plus répandus dans le monde. En 2023 en France, on dénombrait 52 777 nouveaux cas. À ce jour, on note une augmentation de l'incidence chez la femme de 4,3 % par an entre 2010 et 2023 dont 19 339 nouveaux cas par an. L'incidence est stable chez l'homme, soit 33 438 nouveaux cas en 2023. Ce cancer est la première cause de mortalité par cancer dans les deux sexes et se place en 2e position en termes d'incidence chez l'homme et en 3e chez la femme. La mortalité aussi élevée s'explique par un diagnostic souvent tardif (1). En effet, le cancer du poumon n'a pas de symptôme caractéristique, ce qui explique que 57,6 % des cancers du poumon soient découverts à un stade métastatique d'emblée. Tout stade confondu la survie à 5 ans est de 6 % chez l'homme et de 4 % chez la femme. De plus, bien que des essais cliniques soient en cours, il n'existe à ce jour pas de stratégie de dépistage validée en France. Il existe plusieurs types de cancer du poumon. Le cancer du poumon non à petites cellules (CBNPC) qui représente plus de 80 % des cancers. Dans cette catégorie, l'adénocarcinome est le plus fréquent, soit 51,9 % des cas. Le cancer du poumon à petites cellules (CBPC) représente lui 12,6 % des cancers du poumon. Le facteur de risque principal du cancer du poumon reste le tabagisme, responsable de 8 cancers sur 10. Les autres facteurs de risque sont les expositions professionnelles (amiante, benzène…) et environnementales (amiante, diesel, radon, hydrocarbures polycyclique…) ainsi que le cannabis ou les rayonnements ionisants dont l'exposition antérieure à une radiothérapie. Bien que la plupart des adénocarcinomes soient liés au tabac, il existe des cas d'adénocarcinome sans exposition tabagique ni autre exposition causale. Ces cas sont souvent découverts chez des sujets jeunes et à un stade métastatique. Le diagnostic repose sur l‘histologie, l'analyse immunohistochimique et la biologie moléculaire.
Certaines mutations ciblables sont accessibles à des thérapeutiques spécifiques dont les inhibiteurs de tyrosine kinase (ITK) qui sont le propos de notre article. En cas de mise en évidence de mutation EGFR, de réarrangements ALK et ROS1 des ITK spécifiques sont indiqués dès première ligne. La présence d'addiction oncogénique ciblable est facteur de meilleur pronostic.
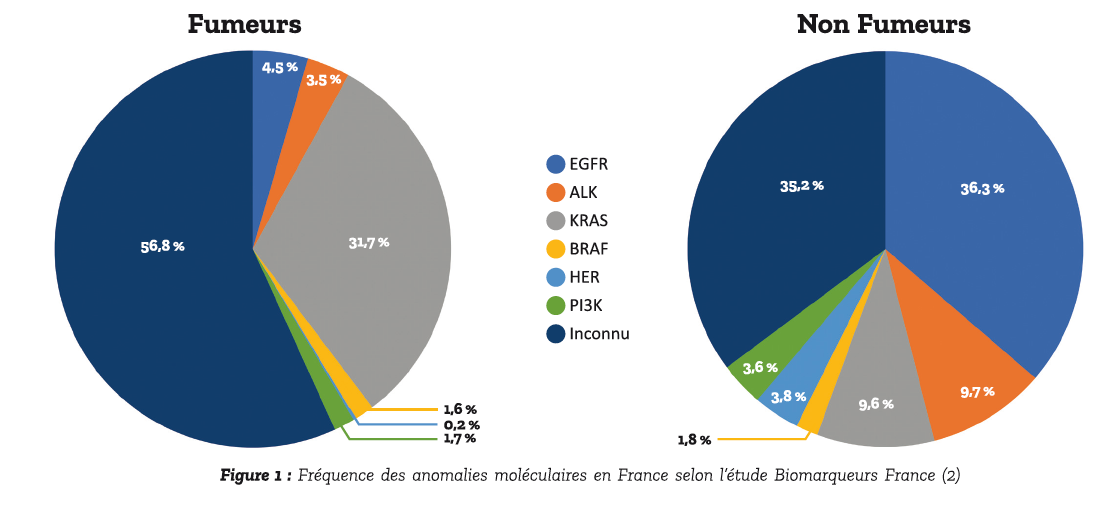
La répartition des mutations dans les adénocarcinomes en 2013 chez les fumeurs et non-fumeurs est détaillée dans la figure 1. On remarque une prédominance de mutation KRAS chez les fumeurs et EGFR et ALK chez les non-fumeurs. À noter que dans la cohorte de Tan et al. on retrouve une prévalence de 2,6 % pour les réarrangements ROS1 (3). Nous allons détailler dans cet article les indications des ITK dans les adénocarcinomes bronchiques métastatiques avec addiction oncogénique activables.
Mutations EGFR
Au diagnostic d'un adénocarcinome métastatique muté EGFR, le traitement de référence actuel repose sur l'OSIMERTINIB. L'essai FLAURA avait montré des résultats probants en faveur de l'OSIMERTINIB en première ligne : survie sans progression de 18,9 mois dans le bras OSIMERTINIB versus 10,2 mois dans le bras ITK de 1ère génération (ERLOTINIB ou GEFITINIB) (4). À ce jour, 2 essais cliniques de phase 3 ouvrent de nouvelles pistes :
• FLAURA 2 compare OSIMERTINIB seul contre une association OSIMERTINIB/chimiothérapie à base de sels de platines et PEMETREXED. Cette étude montrait une amélioration de la survie sans progression en faveur du bras combinaison (25,5 mois versus 16,7 mois pour le bras OSIMERTINIB seul) au dépend d'une moins bonne tolérance (5) (6). À ce jour, il n'y a pas d'AMM pour cette association en France.
• MARIPOSA compare AMIVANTAMAB et LAZERTINIB versus LAZERTINIB seul versus OSIMERTINIB seul. On retrouve une survie sans progression supérieure dans le groupe AMIVANTAMAB et LAZERTINIB (23,7 mois versus 1,6 mois dans le groupe OSIMERTINIB). Le bras LAZERTINIB seul a des résultats superposables au bras OSIMERTINIB. À noter que dans le groupe de l'association, les évènements thromboemboliques étaient plus nombreux (37 %) et nécessitaient une anticoagulation préventive (7). Cette association n'a à ce jour pas d'AMM.
En cas de progression tumorale malgré un traitement de première ligne bien conduit, on réalise une nouvelle biopsie à la recherche d'une nouvelle mutation, appelée mutation secondaire.
Chez le patient traité en première ligne par OSIMERTINIB ou chimiothérapie, la réalisation d'un nouveau prélèvement tissulaire permet de mettre en évidence des transformations histologiques ou l'apparition de nouvelles altérations EGFR ou dans d'autres cibles (MET, KRAS, etc.).
En l'absence de mécanisme de résistance ciblable, il est recommandé d'utiliser une chimiothérapie à base de sels de platines. L'étude MARIPOSA -2 compare en 2e ligne après anti EGFR, la chimiothérapie à l'association AMIVANTAMAB LAZERTINIB chimiothérapie versus AMIVANTAMAB chimiothérapie versus chimiothérapie seule dans les carcinomes bronchiques non à petites cellules muté EGFR (délétion exon 19 ou mutation L858R) métastatiques au niveau cérébral. Cette étude retrouve des résultats encourageants en faveur des combinaisons par doublet ou triplet (8). L'association AMIVANTAMAB chimiothérapie (CARBOPLATINE et PEMETREXED) montre une survie sans progression de 6,3 mois versus 4,2 mois dans le bras chimiothérapie seule. Le triplet retrouve une survie sans progression de 8,3 mois. Cette efficacité significative se retrouve également sur les survies sans progression intracrâniennes. Cependant le bras triplet révèle des effets indésirables plus fréquent. Grâce à ces données, le doublet AMIVANTAMAB chimiothérapie est désormais disponible dans le cadre d'un accès précoce, dans cette indication.
Certaines anomalies, comme l'insertion de l'exon 20, confèrent une résistance aux ITK habituels dont l'OSIMERTINIB. L'association AMIVANTAMAB, PEMTREXED et CARBOPLATINE est à proposer en première ligne dans la cadre d'un accès précoce. Cette association deviendra très probablement le traitement de référence des insertions de l'exon 20 devant les résultats encourageants de l'étude PAPILLON (survie sans progression à 11,4 mois dans le groupe combiné versus 6,7 mois dans le groupe chimiothérapie seule) (9). Ainsi, l'association AMIVANTAMAB PEMETREXED CARBOPLATINE dispose d'un accès précoce.
En cas de mutations rares de l'EGFR (G719X, L861Q et S768) il est recommandé d'administrer de l'AFATINIB. Ce même ITK peut être administré en cas de mutations combinées (10).
Réarrangement ALK
L'ALECTINIB et le BRIGATINIB ont montré des résultats supérieurs au CRIZOTINIB. Le LORLATINIB a été comparé en 1e ligne au CRIZOTINIB dans l'essai de phase 3 CROWN. Cette étude retrouve une survie sans progression de 60 % à 5 ans dans le bras LORLATINIB contre 8 % dans le bras CRIZOTINIB, ainsi qu'une survie sans progression médiane non atteinte avec le LORLATINIB tandis qu'on la retrouve à 9,1 mois dans le bras CRIZOTINIB. Cette étude met également en évidence une meilleure médiane de survie sans progression en cas de métastases cérébrales avec le LORLATINIB (11). Cette constatation est intéressante puisque les carcinomes pulmonaires à réarrangement ALK se caractérisent par une fréquence plus importante de métastases cérébrales. En effet, 30 % des patients porteurs d'un réarrangement ALK auront des métastases cérébrales et 60 % au cours de leur évolution (12). C'est donc pour cela que le LORLATINIB doit être considéré comme le standard thérapeutique en première ligne des CBNPC avancés avec réarrangement ALK. Le BRIGATINIB et le CRIZOTINIB restent des options en cas de contre-indication ou d'intolérance au LORLATINIB.
À ce jour, on n'observe pas d'émergence de mutation secondaire sous LORLATINIB en première ligne. Si toutefois, lors d'une progression, une mutation secondaire est retrouvée, l'ITK doit être adapté à la mutation retrouvée. Si aucune mutation secondaire n'est retrouvée on proposera de la chimiothérapie après une première ligne par LORLATINIB. Cependant en cas d‘arrêt du LORLATINIB pour cause de toxicités on peut administrer un autre ITK anti ALK (BRIGATINIB ou ALECTINIB). En cas d'échec des ITK, il est recommandé d'utiliser un doublet de chimiothérapie à base de sels de platine avec PEMETREXED +/- BEVACIZUMAB, le tout sans immunothérapie (10).
Réarrangement ROS1
À ce jour, il est recommandé d'utiliser du CRIZOTINIB en première intention. Chez les patients traités par CRIZOTINIB en progression, le REPOCRETINIB est accessible en accès compassionnel. Cette molécule deviendra le standard dans cette indication dès qu'elle sera accessible (10).
Mutations BRAF V600E
Pour ces mutations on n'utilise pas en première ligne un ITK. On préfèrera inclure les patients dans un essai clinique ou réaliser une chimiothérapie +/- associé à une immunothérapie.
En seconde ligne ou plus après l'échec de chimiothérapie +/- immunothérapie, l'association DABRAFENIB et TRAMETINIB est indiquée. Cette association a montré son efficacité en première et en seconde ligne de traitement, et est désormais disponible en France (10).
Fusion de NTRK
L'inclusion dans un essai clinique est à privilégier en première intention. En cas de traitement de première ligne inefficace, le REPOTRECTINIB est accessible en accès compassionnel (10).
Mutations exon 14 de met
Le traitement de première ligne est un doublet à base de platine associé ou non à une immunothérapie. En cas d'échec, le CRIZOTINIB est possible dans le cadre d'une prescription compassionnelle (10).
Mutations RET
Il semblerait que ce réarrangement soit présent dans 1 à 2 % des CBNPC, principalement chez des sujets de sexe féminin, d'âge jeune (inférieure à 60 ans) et sans impact évident du statut tabagique. Le SELPERCATINIB est un inhibiteur de RET qui a été comparé à la chimiothérapie plus ou moins associé à l'immunothérapie dans le cadre de l'essai LIBRETTO-431. Cette étude montre des résultats très encourageants en faveur du SELPERCATINIB : survie sans progression à 24,8 mois versus 11,2 mois pour le bras contrôle (13). Cette molécule dispose d'une AMM en monothérapie en première ligne dans les CBNPC mutés RET (accès précoce post AMM). À noter qu'après l'utilisation d'immunothérapie, ce traitement semble présenter un surrisque de réactions d'hypersensibilité. Par ailleurs, le chylothorax et l'ascite chyleuse sont également décrit dans les effets indésirables (10).
Mutation G12C KRAS
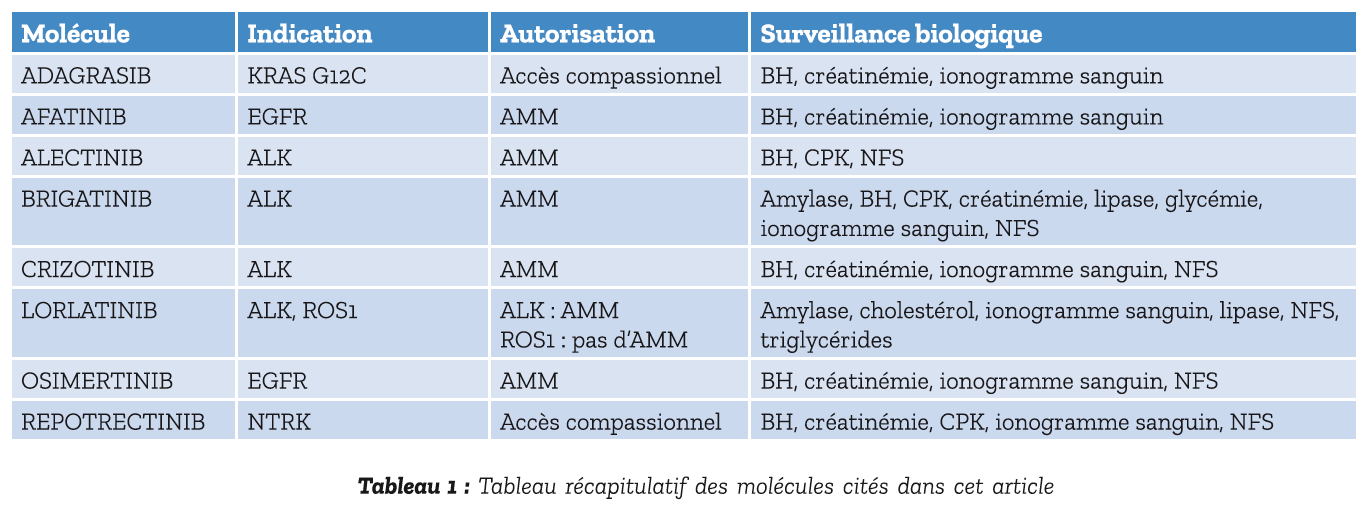
À ce jour les patients doivent être orientés vers des essais cliniques dés la première ligne. L'ADAGRASIB, accessible en accès compassionnel chez les patients ayant échappé à une seconde ligne par DOCETAXEL ou inéligible à un traitement par DOCETAXEL en deuxième ligne. Ce traitement a comme avantage une bonne pénétration intracrânienne permettant une bonne efficacité sur les métastases cérébrales (taux de réponse sur les métastases cérébrales de 40 % dans l'étude KRYSTAL-1 (14)). Cette molécule devrait obtenir une autorisation accès précoce d'ici fin 2024 (10). Un résumé des molécules sus-citées avec leurs indications, leur accès et leur surveillance biologique est inscrit dans le tableau 1.
Bilan pré thérapeutique
Ces traitements ayant préférentiellement une élimination hépatique, un contrôle du bilan hépatique sera nécessaire avant l'initiation. Il faudra également faire attention à la prise d'autres traitements pouvant être à l'origine d'interactions médicamenteuses.
Chaque molécule a un suivi biologique et clinique spécifique (Tableau 1). Les différentes toxicités gradées selon la classification CTCAE 5.0 et les bilans pré-thérapeutiques à réaliser en fonction de chaque ITK sont inscrits dans le référentiel AURA (https://referentiels-aristot.com/).
La prise d'ITK nécessite une éducation thérapeutique préalable concernant les modes de prise du traitement, le régime alimentaire (éviter le pamplemousse) et l'automédication. Il faudra également limiter l'exposition solaire et le tabagisme.
Toxicités fréquentes
Les thérapies ciblant l'EGFR à savoir l'OSIMERTINIB peuvent entraîner des lésions cutanées. La première lésion retrouvée est la folliculite qui nécessite un traitement préventif par émolliant. Le traitement curatif est la DOXYCYCLINE en topique local pour les grades les plus bas selon la classification CTCAE 5. Sont également décrits des paronychies, des diarrhées, des nausées, une hématotoxicité, une cytolyse ou encore un allongement du QT (15).
Conclusion
Les ITK sont des traitements en plein essor et en perpétuelle évolution, ouvrant de nouvelles perspectives dans le cadre des carcinome bronchiques non à petites cellules métastatiques avec addiction oncogénique ciblable. En tant qu'onco-pneumologue il est donc indispensable et nécessaire de s'informer régulièrement sur les avancés thérapeutiques.

Coraline CHEUVART
Interne de pneumologie
Clermont-Ferrand
Avec l'aide du Dr Brigitte MONANGE
Relecture
Dr Patrick MERLE
Sources
1 Le cancer du poumon - Les cancers les plus fréquents [Internet]. [cité 27 nov 2024]. Disponible sur : https://www.e-cancer.fr/ Professionnels-de-sante/Les-chiffres-du-cancer-en-France/Epidemiologie-des-cancers/Les-cancers-les-plus-frequents/ Cancer-du-poumon.
2 Biomarqueurs (BM) France : Résultats de la détection systématique des mutations EGFR, HER2, KRAS, BRAF, PI3KCA et de l'évaluation de la fusion génique EML4-ALK sur les 10 000 premiers patients atteints de cancer du poumon non à petites cellules (CPNPC) (pts). | Journal of Clinical Oncology [Internet]. [cité 27 nov 2024]. Disponible sur : https://ascopubs.org/doi/abs/10.1200/jco.2013.31.15_suppl.8000.
3 Tan AC, Tan DS. Targeted Therapies for Lung Cancer Patients With Oncogenic Driver Molecular Alterations. JCO. 20 févr 2022;40(6):611-25.
4 Soria JC, Ohe Y, Vansteenkiste J, Reungwetwattana T, Chewaskulyong B, Lee KH, et al. Osimertinib in Untreated EGFRMutated Advanced Non-Small-Cell Lung Cancer. N Engl J Med. 11 janv 2018;378(2):113-25.
5 Planchard D, Jänne PA, Cheng Y, Yang JCH, Yanagitani N, Kim SW, et al. Osimertinib with or without Chemotherapy in EGFR-Mutated Advanced NSCLC. N Engl J Med. 23 nov 2023;389(21):1935-48.
6 Planchard D, Jänne PA, Cheng Y, Lee CK, Laktionov K, Yang TY, et al. LBA68 FLAURA2: Safety and CNS outcomes of fi rst-line (1L) osimertinib (osi) ± chemotherapy (CTx) in EGFRm advanced NSCLC. Annals of Oncology. 1 oct 2023;34:S1311-2.
7 ESMO 2023: Amivantamab plus lazertinib vs osimertinib as fi rst-line treatment in patients with EGFR-mutated, advanced non-small cell lung cancer (NSCLC): Primary results from MARIPOSA, a phase III, global, randomized, controlled trial [Internet]. [cité 27 nov 2024]. Disponible sur : https://clin.larvol.com/abstract-detail/ESMO%202023/67815973.
8 Passaro A, Wang J, Wang Y, Lee SH, Melosky B, Shih JY, et al. Amivantamab plus chemotherapy with and without lazertinib in EGFR-mutant advanced NSCLC after disease progression on osimertinib: primary results from the phase III MARIPOSA-2 study. Ann Oncol. janv 2024;35(1):77-90.
9 Zhou C, Tang KJ, Cho BC, Liu B, Paz-Ares L, Cheng S, et al. Amivantamab plus Chemotherapy in NSCLC with EGFR Exon 20 Insertions. N Engl J Med. 30 nov 2023;389(22):2039-51.
10 Texte intégral sur le référentiel – AURA [Internet]. [cité 27 nov 2024]. Disponible sur : https://referentiels-aristot.com/129-cancer-bronchique-non-petites-cellules/texte-integral-sur-le-referentiel/
11 Shaw AT, Bauer TM, de Marinis F, Felip E, Goto Y, Liu G, et al. First-Line Lorlatinib or Crizotinib in Advanced ALKPositive Lung Cancer. N Engl J Med. 19 nov 2020;383(21):2018-29.
12 Nishino M, Soejima K, Mitsudomi T. Brain metastases in oncogene-driven non-small cell lung cancer. Transl Lung Cancer Res. nov 2019;8(Suppl 3):S298-307.
13 Zhou C, Solomon B, Loong HH, Park K, Pérol M, Arriola E, et al. First-Line Selpercatinib or Chemotherapy and Pembrolizumab in RET Fusion-Positive NSCLC. N Engl J Med. 16 nov 2023;389(20):1839-50.
14 Jänne PA, Riely GJ, Gadgeel SM, Heist RS, Ou SHI, Pacheco JM, et al. Adagrasib in Non-Small-Cell Lung Cancer Harboring a KRASG12C Mutation. N Engl J Med. 14 juill 2022;387(2):120-31.
15 Gestion des eff ets indésirables des thérapies ciblées - Société de Pneumologie de Langue Française [Internet]. [cité 27 nov 2024]. Disponible sur: https://splf.fr/gestion-des-eff ets-indesirables-des-therapies-ciblees/

