Malgré les résultats très enthousiasmant des CAR T-cells (ide-cel, cilta-cel)1, 2 et anticorps bispécifiques (BsAbs) (teclistamab, elranatamab, talquetamab)3, 4, 5 dans le myélome multiple en rechute réfractaire, la rechute de la maladie est inéluctable à l'heure actuelle. Ainsi, il est très important aujourd'hui d'axer nos recherches sur la compréhension des mécanismes qui sous-tendent la rechute, et souvent aussi la résistance aux immunothérapies.
Les CAR-T cells et bispécifiques eux-mêmes
Une étude ancillaire de KARMMA a constaté que les patients ayant eu la réponse la plus longue à ide-cel, supérieure ou égale à 18 mois, étaient ceux avec l'expansion initiale d'ide-cel la plus forte dans le sang et dans la moelle6. Il semblerait que pour une bonne expansion initiale du CAR T-cell, la composition du produit de leukaphérèse joue un rôle central. En effet, les longs répondeurs avaient significativement plus de lymphocytes T de phénotype naïf et central mémoire, réputés avoir une meilleure capacité de prolifération et moindre prédisposition à l'exhaustion, et moins de lymphocytes T sénescents. Le ratio CD4/ CD8 semble également être un critère d'importance, les lymphocytes T CD4 permettant « d'optimiser » les T CD8 grâce à un effet synergique sur leur prolifération, survie, et cytotoxicité. Dans une étude de CAR anti-BCMA, un ratio CD4/CD8 élevé était associé à une profondeur de réponse et une expansion du CAR augmentées7.
Alors comment obtenir un produit de leukaphérèse riche en LyT naïfs et centraux mémoire, et avec un ratio CD4/CD8 élevé ? Une leukaphérèse précoce dans l'histoire de la maladie permettrait de satisfaire cette exigence, comme présenté dans une étude comparant les produits de leukaphérèse obtenus en post-induction versus en rechute réfractaire, sur les critères exposés précédemment8.
La même problématique se pose pour la réponse aux BsAbs, qui repose sur les lymphocytes T endogènes du patient. En effet, les patients répondeurs aux BsAbs sont ceux ayant obtenu la plus forte expansion clonale T en réponse à l'administration du médicament selon un article paru en 20239.Dans cette étude, il apparaît que les LT CD8 effecteurs CX3CR1 sont les sousgroupes de lymphocytes T responsables de l'expansion clonale. Et en effet, les patients répondeurs aux BsAbs se trouvaient avoir une proportion plus importante de LT CD8 CX3CR1 avant l'administration du bispécifique, tandis que chez les non répondeurs on retrouvait une abondance de LT CD8 de phénotype « exhausted ». Ainsi, le paysage lymphocytaire T préexistant est déterminant dans la réponse aux BsAbs.
Le plasmocyte tumoral
Le premier mécanisme de résistance à avoir été décrit est la perte biallélique du BCMA, présentée dans diverses études de petits effectifs sous CAR T et BsAbs anti-BCMA. Souvent il s'agit de l'évolution d'un sous-clone porteur d'une perte monoallélique de BCMA qui, sous pression thérapeutique, perd le 2e allèle pour devenir le clone majoritaire à la rechute10.
Ensuite, ont été décrites des mutations sur le domaine extracellulaire du BCMA survenues sous BsAbs, constituant des rechutes avec BCMA de surface toujours détectables. Il semblerait qu'une même mutation de BCMA affecte de manière hétérogène la liaison de différents BsAbs anti-BCMA11.
Le GPRC5D, autre cible des CAR T-cells et BsAbs, peut aussi être sujet à une perte biallélique par divers mécanismes (mutations, délétions) survenant sous CAR T ou sous BsAbs12, 13.
En fait, il semblerait que des délétions hétérozygotes préexistantes des cibles d'immunothérapies soient fréquentes, et que sous pression thérapeutique un 2e hit peut survenir pour aboutir à la perte complète de l'antigène 14.
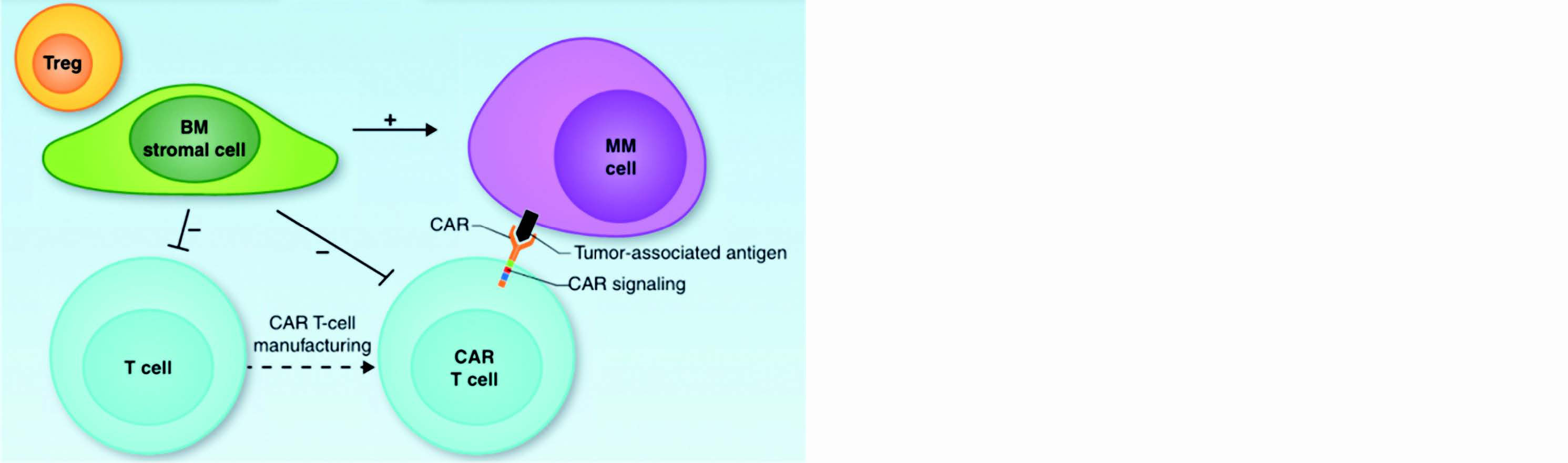
Le microenvironnement tumoral
Il se compose des cellules stromales, des cellules immunosuppressives myéloïdes et lymphoïdes, et de chimiokines/cytokines immunosuppressives. La lymphodéplétion joue un rôle majeur dans la préparation du microenvironnement à l'accueil du CAR-T, en partie grâce à la création d'un environnement cytokinique favorable à leur greffe, prolifération et persistance15.
Il est important de comprendre que le myélome est une maladie qui présente une forte hétérogénéité à la fois clonale et spatiale, exposée dans une étude analysant les moelles osseuses de patients en différents sites : chez un même patient, en fonction du site de prélèvement on ne retrouvait pas les mêmes sous-clones, ni la même composition de microenvironnement tumoral16. Il s'avère que certaines régions sont très riches en lymphocytes T, alors que d'autres régions en semblent complètement dépourvues. Alors que toutes ces thérapies reposent sur la cytotoxicité des lymphocytes T, on ne connaît encore que peu de choses de l'infiltration lymphocytaire T dans les lésions myélomateuses. Ainsi, on comprend aisément que si certaines régions sont dépourvues de lymphocytes T, ou protégées par un microenvironnement fortement immunosuppresseur, elles échapperont à l'immunothérapie pour fait le lit de la prochaine rechute.
Références
1. Rodriguez-Otero et al, NEJM 2023
2. San Miguel et al, NEJM 2023
3. Moreau et al, NEJM 2022
4. Lesokhin et al, Nature Medicine 2023
5. Chari et al, NEJM
6. Lin et al, Nat Med 2023
7. Cohen et al, J Clin Invest 2019
8. Dancy et al, Blood 2018
9. Friedrich et al, Cancer Cell 2023
10. Da Via et al, Nat Met 2021
11. Lee et al, Nat Med 2023
12. Mi et al, NEJM 2023
13. Lee et al, Nat Med 2023
14. Truger et al, Blood Adv 2021
15. Hirayama et al, Blood 2019
16. John et al, Nat Comm 2023

Sarah CAYLA
Interne en Hématologie clinique, actuellement en MD à l'Institut Imagine




