Vaginal reconstruction after Cancer treatment
Barbara Hersant 1 , Romain Bosc 1 ,Cyril Touboul2, Dana Sawan 1 , Simone La Padula 1 , Warren Noel 1 , Fabrice Narducci 3 , Eric Leblanc 3 , Jean Paul Meningaud 1
- Département de chirurgie plastique, reconstructrice, esthétique et maxillo-faciale de l’hôpital Henri Mondor, Créteil, France
2. Département de chirurgie gynécologique et gynéco-obstétrique du Centre Inter-communal de Créteil, France.
3. Département de chirurgie gynécologique du Centre Oscar Lambret, Lille, France.
Résumé
La reconstruction vaginale est un déchirurgical qui s’appuie sur la pluridisciplinarité. L’objectif est à la fois thérapeutique, fonctionnel et morphologique puisque la reconstruction permet, d’une part, le comblement de l’espace mort pelvien dans les cas d’exentération diminuant ainsi les complications post-opératoires (fistules, occlusion, infection), d’autre part, le maintien d’un schéma corporel morphologique et fonctionnel féminin proche de la normale.
Le choix de la technique de reconstruction dépend premièrement du caractère partiel ou total de la colpectomie et du caractère isolé ou associé de l’exérèse (exentération pelvienne).
Il dépend également du terrain, de la qualité des tissus adjacents (radiothérapie) et de la voie d’abord utilisée pour l’exérèse (voie cœlioscopique, vaginale, laparotomie). Parmi, les avancées dans le domaine de la reconstruction vaginale, on peut citer l’utilisation de lambeau perforants sur mesure prélevés en respectant les muscles rectus abdominis.
En effet, l’imagerie 3D en rendu volumique et en réalité augmentée des vaisseaux perforants des muscles grands droits permet de prélever des lambeaux cutanéo-graisseux aux dépends des vaisseaux épigastriques inférieurs (DIEP-SIEP) vascularisés sur une perforante tout en sauvegardant l’intégrité fonctionnelle de la paroi abdominale.
Les avancées reposent également sur l’évaluation de la abilité per-opératoire et la surveillance de ces lambeaux par angiographie au vert d’indocyanine permettant une évaluation de la vascularisation par fl uorescence.
Des nouvelles approches de reconstruction vaginale sont également en évaluation faisant appel à l’ingénierie tissulaire (Scaffold) et à la thérapie cellulaire par adjonction de cellules souches.
Mot clés
Reconstruction vaginale, lambeau, DIEP, chirurgie plastique, cancer.
Abstract
Vaginal reconstruction is a surgical challenge based on multidisciplinary. The objective is at the same time therapeutic, functional and morphological since the reconstruction allows, on the one hand, the lling of the pelvic dead space in cases of exenteration thus reducing post-operative complications (fistulas, occlusion, infection), and on the other hand, themaintenance of a morphological and functional female body pattern close to normal.
The choice of reconstruction technique depends rstly on the partial or total nature of the colpectomy and the isolated or associated nature of the excision (pelvic exenteration).It also depends on the quality of adjacent tissues (radiotherapy) and the approach used for excision (laparoscopic, vaginal, laparotomy).
Advances in vaginal reconstruction include the use of custom-tailored perforating fl apsharvested while preserving the rectus abdominis muscles.
In fact, 3D imaging in volume rendering and augmented reality of the perforating vessels of the upright muscles allows the removal of cutaneous fat fl aps at the expense of the lowerepigastric vessels (DIEP-SIEP) vascularized on a perforator while preserving the functional integrity of the abdominal wall.
The advances are also based on the evaluation of the intraoperative reliability and themonitoring of these fl aps by indocyanin green angiography allowing the evaluation ofvascularization by fluorescence.
New approaches of vaginal reconstruction are also being evaluated using tissue engineering (Scaffold) and stem cell by adding stem cells.
Keywords
Vaginal reconstruction, flap, DIEP, plastic surger, cancer
Introduction
Le vagin est une structure tubulaire musculo-muqueuse qui s’étend de la vulve à l’utérus dont les principales fonctions sont la reproduction et le plaisir sexuel activant les systèmes de récompense. La longueur est d’environ 7 cm à la paroi antérieure et de 9 cm à la paroi postérieure, et la largeur varie de 2,6 à 3,25 cm (1).
Les étiologies des pertes de substance vaginale après cancer sont multiples : carcinologiques notamment après résection d’un cancer du col ou du corps de l’utérus, du vagin, colorectal, et de l’ovaire (2) ; liées aux séquelles post-radiothérapie (sténose, fistule).
Les objectifs de la reconstruction sont anatomiques, fonctionnels, psychologiques et thérapeutiques. En effet, la reconstruction doit être la plus anatomique possible en tentant de respecter au moins 5 cm de profondeur et 2 doigts d’insertion pour la largeur. L’objectif fonctionnel est de maintenir un schéma corporel féminin proche de la normale permettant une vie sexuelle et une amélioration de la qualité de vie. La reconstruction vaginale peut avoir un impact thérapeutique puisqu’elle permet le comblement de l’espace mort pelvien dans les cas d’exentération, diminuant ainsi les complications post-opératoires (fistules, occlusion, infection). Cette reconstruction permet également de faciliter le suivi gynécologique par un examen clinique au speculum à chaque consultation.
La technique de reconstruction dépend premièrement du caractère partiel ou total de la colpectomie et du caractère isolé ou associé de l’exérèse (exentération pelvienne).
Le choix de la technique dépend également du terrain (antécédent chirurgicaux, tabagisme, état général) et de la voie d’abord utilisée pour l’exérèse (voie cœlioscopique, vaginale, laparotomie).
Embryologie de la formation du vagin
Les systèmes urogénitaux féminin et masculin ont pour origine le mésoblaste intermédiaire. Durant la 7 e semaine, le canal de Müller persiste et va être à l’origine des voies génitales féminines, sa partie distale forme le canal utéro-vaginal qui va donner l’utérus et la partie supérieure du vagin, le reste du vagin provient d’une prolifération du sinus uro-génital dénitif en regard du tubercule de Müller (3, 4). La partie caudale du sinus uro-génital va former les 2/3 inférieurs du vagin : Tout d’abord il y a une prolifération des tissus endodermique de la partie postérieure du sinus uro-génital, en regard du tubercule müllerien, formant au départ deux évaginations accolées sur la ligne médiane, les bulbes sino-vaginaux. Ces bulbes vont s’unir à l’extrémité inférieure du canal utéro-vaginal et forment une plaque vaginale. Les bulbes vont se tunneliser pour donner le vagin (vers le 5 e mois). Il y a alors une augmentation de la distance entre l’utérus et le sinus uro-génital cela va repousser le péritoine et former les culs de sac vaginaux. Il persiste une membrane, l’hymen, au niveau la partie la plus caudale du sinus uro-génital dénitif, qui va constituer le vestibule (glande vestibulaire, vulve) (3, 4).
La reconstruction vaginale par lambeau en cas d’exentération pelvienne
La chirurgie d’exentération pelvienne est une chirurgie peu fréquente qui consiste en la résection monobloc des organes pelviens : génitaux (ovaires, utérus, col et vagin), urinaires (urètre et vessie) et digestif (rectum et/ou anus). L’objectif est l’exérèse carcinologique et en fonction du cas, qu’elle soit totale ou partielle, emportant ou non le plancher pelvien voire le périnée (classication de Magrina) (5), l’exentération pelvienne est toujours une chirurgie mutilante.
on indication principale est le cancer épithélial utérin (col ou corps) étendu à la vessie et/ou au rectum (6).Elle peut aussi être envisagée dans certains cas de tumeurs de vulve, du vagin, mais aussi de vessie et plus rarement du rectum ou l’anus. Bien que parfois proposée d’emblée dans les formes localement évoluées de la maladie, l’importance de ce geste le réserve en règle aux cas de récidive locale. Dans tous les cas elle n’est envisagée qu’après un bilan complet excluant toute dissémination extra-pelvienne et avec la certitude « d’être en marge saine ». En effet, si l’exentération pelvienne pratiquée à titre curatif (exérèse in sano et sans dissémination à distance) offre des chances de survie de plus de 50 % à 5 ans. Plus rarement l’indication peut être posée devant des séquelles thérapeutiques importantes de la radiothérapie (stules vésico et/ou recto-vaginales, radio-induites), chez une patiente dont la maladie est par ailleurs contrôlée.
Cependant, cette large exérèse viscérale est pourvoyeuse d’une morbi-mortalité élevée (5, 6) en raison de la descente des anses intestinales dans un petit bassin plus ou moins vidé et dépéritonisé, avec des risques élevés de stules digestives, d’infection ou d’occlusion majorés par la radiothérapie antérieure...
Après le temps d’exérèse vient donc celui du comblement du pelvien et de la reconstruction des organes amputés. Ainsi, lorsque l’anus a pu être conservé, le rétablissement de la continuité est effectué (mais une stomie de protection temporaire est souvent réalisée). En ce qui concerne les organes urinaires, la dérivation continente type Miami (7, 8) qui consiste en la réalisation d’une néovessie parun lambeau colique avec transposition des uretères et l’évacuation des urines au niveau de l’ombilic est largement utilisée par les équipes françaises. Chaque fois que possible, le tablier de l’épiploon est descendu dans le pelvis, non tant pour le combler (car un volume important est nécessaire) que pour repéritoniser les parois pelviennes mises à nu, limitant ainsi le risque d’adhérences digestives et d’occlusion/stules.
Cette intervention est donc multidisciplinaire et peut nécessiter la présence d’un chirurgien gynécologue, viscéral, urologue et plasticien. Certains praticiens très spécialisés et expérimentés peuvent assurer le rôle de tous les intervenants. Il reste néanmoins préférable d’établir une collaboration entre spécialistes de manière que chaque praticien effectue son geste parfaitement dans le temps qu’il lui est consacré. Étant donné la morbidité importante de l’exentération pelvienne, la reconstruction vaginale doit apporter un bénéce et ne pas ajouter un risque supplémentaire. Il est donc évident qu’il faut privilégier une technique simple, rapide, able et apportant un tissu de bonne qualité. Les lambeaux libres sont à éviter, en raison de leur complexité au cours d’une chirurgie déjà longue, et en raison de la fragilité des anastomoses vasculaires en milieu irradié.
Les différentes techniques
Le DIEP (Deep Inferior Epigastric Perforator) vertical pédiculé
Cette technique de reconstruction est à présent une technique de premier choix (9). En effet, le VRAM muscle sparing (Vertical Rectus Abdominis Muscle) (Fig 1a) facile de dissection et rapide étaient très utilisé (5, 6). En effet, la palette cutanée de ce lambeau est adhérente au muscle grand droit contenant le pédicule vasculaire et les complications de paroi qu’il engendre (éventration, abcès de paroi) doit le faire reléguer en seconde position. En effet, On note 21 % d’éventration avec le VRAM versus moins de 3 % avec le DIEP (10, 11).
Un angioscanner avec repérage des perforantes (Fig 3) de l’artère épigastrique inférieure doit être demandé systématiquement en planification pré-opératoire du DIEP. Selon Xin Minqiang et al (12), le temps de dissection du lambeau DIEP avec planication est quasiment divisée par 2 et le taux d’échec du lambeau passe de 4.5 % avec imagerie versus 13.2 % sans imagerie préalable. Le coté du prélèvement doit être décidé avant l’intervention en concertation avec le chirurgien gynécologue, en fonction de la qualité des perforantes vues à l’angios-
Un angioscanner avec repérage des perforantes (Fig 3) de l’artère épigastrique inférieure doit être demandé systématiquement en planification pré-opératoire du DIEP. Selon Xin Minqiang et al (12), le temps de dissection du lambeau DIEP avec planication est quasiment divisée par 2 et le taux d’échec du lambeau passe de 4.5 % avec imagerie versus 13.2 % sans imagerie préalable. Le coté du prélèvement doit être décidé avant l’intervention en concertation avec le chirurgien gynécologue, en fonction de la qualité des perforantes vues à l’angioscanner et de la localisation des futures dérivations (colostomie, Miami) (13). La réalité augmentée sur lunettes intelligentes est une piste de recherche chirurgicale dans le domaine de la planication des DIEP (14) qui permet au chirurgien de visualiser des objets virtuels en trois dimensions pendant l’intervention chirurgicale, superposés en temps réel à l’anatomie du patient. Ceci permet de conserver la vision du champ chirurgical et de disposer des informations planifiées de guidage opératoire sans qu’il soit nécessaire d’utiliser un guide chirurgical physique (g 4).
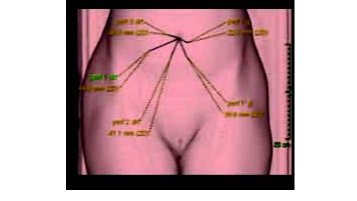
Figure 1a Illustration des différents lambeaux pour la reconstruction vaginale totale en position anatomique (en cours) : À droite, le VRAM muscle sparing (Vertical Rectus Abdominis Muscle) ; à gauche, le DIEP (Deep Inferior Epigastric Perforator) vertical pédiculé
Figure 1b Illustration des différents lambeaux pour la reconstruction vaginale totale en position gynécologique : Lambeaux de gracilis, lambeaux perforants pudendaux
Le chirurgien plasticien doit être présent au début de l’intervention pour repérer les perforantes au doppler, faire le dessin du lambeau et vérier que lors de la laparotomie médiane, les perforantes ne sont pas abîmées. La palette est unilatérale et verticale (Fig 2 et 3). On réalise une incision selon le dessin préétabli puis on lève le lambeau en sus aponévrotique jusqu’à la visualisation des perforantes qui seront disséquées à travers le muscle grand droit jusqu’à la bifurcation entre les vaisseaux épigastriques inférieurs profonds et les vaisseaux iliaques externes (Fig 5). Le chirurgien est muni d e loupes grossissement minimum X2. Le vert d’indocyanine peut être utilisé pour évaluer la viabilité du lambeau avant modelage et transposition (Fig 6). Le lambeau est ensuite conformé avant transposition. On peut le modeler en colimaçon ou en parachute, dans ce cas le dôme du néo-vagin correspond à la zone de plicature du lambeau. Puis le lambeau est transposé délicatement dans le pelvis. Le lambeau est alors suturé à la vulve (Fig 7). Le néovagin est souple et les dilatations ne sont en général pas nécessaires.
Figure 2 Dessin de la palette cutanée du DIEP vertical pédiculé
Figure 3 Reconstruction par angioscanner pour le repérage des perforantes de l’artère épigastrique inférieure.
Figure 4 Repérage des perforantes des vaisseaux épigastriques profonds inférieurs en réalité augmentée.
Figure 5 Lambeau DIEP pédiculé
Figure 6 Utilisation du vert d’indocyanine pour évaluer la viabilité du lambeau avnt transposition
Figure 7 Néovagin, suture du DIEP à la vulve
Dans notre expérience personnelle de reconstruction de vagin ou vagin et périnée par DIEP pédiculé, soit 17 cas, nous n’avons jamais eu de cas de nécrose du lambeau. Ce succès est lié à la préparation pré-opératoire radiologique permettant de trouver les vaisseaux perforants cutanés d’intérêt, à l’utilisation du vert d’indocyanine pour vérier in situ la viabilité du lambeau avant transposition (permettant de réséquer d’emblée les zones à risque de souffrance vasculaire) et enfin à la liberté du pédicule vasculaire du lambeau dans la cavité abdominale qui contrairement au lambeau musculaire de grand droit (VRAM) n’est pas comprimé ou twisté par le corps musculaire. Dans cette technique par DIEP pédiculé, un artifice permettant de libérer totalement le pédicule vasculaire et d’éviter la coudure de celui-ci est de fendre en n d’intervention le péritoine pour laisser se placer naturellement le pédicule et de refermer celui-ci par des points séparés autour.
Le VRAM bien que de dissection plus facile est plus à risque de nécrose veineuse par compression du pédicule par le muscle grand droit dans la cavité. Un dogme subsiste en chirurgie carcinologique : un lambeau musculaire serait plus intéressant en cas de radiothérapie préalable. Cependant, on sait que lorsque qu’un muscle est détourné de sa fonction, une fonte musculaire de celui-ci est inévitable en quelques mois. Dans notre expérience de 17 cas de DIEP, nous avons eu deux cas de désunion quasi-totale du lambeau sans souffrance de celui, avec reprise chirurgicale pour suture. Pour éviter cette complication, il faut d’une part un drainage en aspiration entre la cavité périnéale et le néo vagin et des lavages réguliers, d’autre part, il faut effectuer des gros points séparés d’amarrage de Vicryl. En effet, c’est une zone humide avec des sécrétions importantes. Dans notre expérience, nous avons eu un cas d’éventration abdominale suite à une prise d’un double DIEP pour une reconstruction complexe.
Epiplooplastie et greffe de peau (technique de Wheeless)
Cette technique ancienne consiste à pédiculer un lambeau d’épiploon sur l’artère gastro-épiploïque droite et à le transposer dans la cavité pelvienne ou il est modelé sur un conformateur tubulaire. Une greffe de peau mince en let est réalisée d’emblée ou secondairement vers J10 (15). Cette procédure n’est pas selon nous, la technique de premier choix car elle nécessite un épiploon bon volume (peu fréquent chez des patientes souvent « consumées » par leur maladie), le risque de sténose vaginale élevé car la perméabilité doit être maintenue par application régulière d’un mandrin (16). Elle peut être utilisée, d’exentération partielle (antérieure) chez une patiente obèse, ou de sacrice isolé du vagin et de l’utérus.
Entéro-colpoplastie
Le sigmoïde, le cæcum ou l’iléon peuvent être utilisés pour reconstruire le vagin. Bien que le calibre et la abilité de cessubstituts soient intéressants, les secrétions et les contractions qu’ils occasionnent, n’en font pas une technique de premier choix (2).
Lambeau musculo-cutané de Gracilis bilatéral
Il s’agit du premier lambeau décrit pour la reconstruction vaginale (17-19). Sa qualité (en dehors du terrain irradié) et son épaisseur en font un lambeau de choix notamment lorsque l’abdomen s’avère être un mauvais site donneur (chirurgie antérieure, mauvaise qualité des perforantes à l’angioscanner). Le prélèvement est cependant difcile car la difficulté réside dans le repérage du muscle gracilis, la palette cutanée devant être centrée sur celui-ci. L’axe du lambeau se situe entre l’épine pubienne et le centre du condyle médial du genou. Dans un premier temps, on réalise une incision à la racine de la cuisse sur cet axe pour vérier que le pédicule vasculaire issu de l’artère circonfl exe médiale issue de l’artère fémorale profonde se situe bien dans les 10 premiers centimètres. Si le pédicule proximal du muscle est au-delà, alors le point de pivot du lambeau est trop bas pour permettre une transposition correcte dans le pelvis. Ensuite, on réalise une incision sur l’axe du lambeau en regard du condyle médial pour trouver le tendon du Gracilis (en général, celui-ci est sous le corps charnu du muscle Sartorius). Une fois que le muscle gracilis est repéré, la palette cutanée, centrée sur les 2/3 proximaux, est alors incisée et levée avec le muscle, de distal en proximal. Il est nécessaire de faire des points de suture entre l’aponévrose musculaire et la palette cutanée, car il est facile de décrocher la palette cutanée du muscle Gracilis (Fig 1b).
On réalise ensuite un tunnel sous-cutané à la racine de la cuisse, de manière à transposer les 2 lambeaux qu’on suture l’un à l’autre sur la ligne médiane. Les risques sont le sérome de la zone donneuse (un drainage est systématiquement mis en place), la nécrose de la palette cutanée survient dans 15 % des cas, mais le support musculaire permet une ré-épithélialisation dans un second temps, ou une couverture par greffe de peau qui sera réalisée plus à distance. La patiente doit donc être prévenue qu’elle aura possiblement des cicatrices supplémentaires à la face interne des cuisses, en plus de la cicatrice de laparotomie.
Le lambeau musculo-cutané glutéal inférieur bilatéral
Il s’agit d’un lambeau musculo-cutané de la face postérieure proximale de la cuisse (20). Ce lambeau est peu intéressant pour la reconstruction vaginale totale pour plusieurs raisons. D’une part, le point de pivot de ce lambeau est à distance de l’antre vaginal. C’est donc un lambeau plutôt indiqué pour la couverture périnéale (20). Nous ne retiendrons pas cette technique en première intention.
Lambeau cutané Pudendal interne bilatéral (lambeau dit en pétale de lotus, de transposition génito-crural, Gluteal fold perforator)
Il existe différents types de lambeaux cutanés vascularisés par les perforantes de l’artère pudendale interne (21). On peut repérer les perforantes majeures en utilisant le doppler dans la zone triangulaire située entre l’anus, le vagin et la tubérosité ischiatique. Il s’agira du point de pivot du lambeau. Il existe donc différents dessins de cette palette (Fig 1b) : vertical, parallèle au sillon génito-crural, horizontal, ou suivant le sillon sous-fessier. La levée du lambeau se fait de distal en proximal, en prélevant la peau et la graisse et en s’épaississant en arrivant vers les perforantes, de manière à toutes les englober dans le prélèvement. La dissection des perforantes peut engager la viabilité du lambeau surtout en territoire irradié. Pour reconstruire un vagin en totalité, il faudra alors effectuer un prélèvement bilatéral et une suture médiane des lambeaux après transposition à travers un tunnel sous-cutané. Ces lambeaux ne sont pas à envisager en première intention mais uniquement si le prélèvement abdominal n’est pas possible. En effet, le taux de nécrose (22) est élevé en raison du terrain irradié ou en cas de ligature de l’artère iliaque interne lors de l’exentération.
La reconstruction vaginale isolée
En cas de reconstruction totale isolée du vagin (agénésie congénitale, néoplasie intra-épithéliale vaginale), les techniques de choix sont la vaginoplastie, après création d’un espace recto-vésical, par greffe de peau totale (23) par transposition de péritoine (Technique de Davydov Modifiée) ou par lambeau d’épiploon greffé (Technique de Wheeless). Les lambeaux digestifs sont également utilisés mais pourvoyeurs de sécrétions abondantes. Le lambeau recto-sigmoïdien modié (24) semble prometteur pour la reconstruction vaginale isolée. Les intérêts sont la trophicité, la fonctionnalité et la qualité esthétique de ce lambeau. Il existe une morbidité cependant du site donneur et les secrétions peuvent être diminuées grâce à la dénervation après clampage du pédicule du lambeau. En effet, l’ischémie reperfusion intestinale permet de diminuer les cellules caliciformes et donc des sécrétions. Les dilatations sont nécessaires dans ces cas. Les lambeaux pédiculés évoqués ci-dessus en cas d’exentérations peuvent être également utilisés en reconstruction isolée.
Suites opératoires
La mise en place d’un drainage permet des lavages quotidiens.
La surveillance du lambeau à l’aide du spéculum (± sous anesthésie générale) doit être régulière. En effet, la nécrose du lambeau est un risque majeur de stule et entraîne une sténose du néo vagin. À la suite des lavages, une dilatation par un mandrin est réalisée quotidiennement et un retour à la vie sexuelle est préconisé dès l’obtention de la cicatrisation du néovagin.
La qualité de vie sexuelle après reconstruction vaginale
Selon Ratliff et al. (25), 52 % des femmes ne retrouvent pas de sexualité après une chirurgie d’exentération même après reconstruction. Cependant plus de 70 % d’entre elles se disaient satisfaites d’avoir un néovagin fonctionnel.
L’arrêt total de la vie sexuelle est proportionnel à l’âge de la patiente et au faible niveau socio-économique (2). Également, le développement d’un syndrome dépressif et la prise médicamenteuse peut être un frein à une reprise d’activité sexuelle. Les traitements tels que la chimiothérapie ou la ménopause induite par l’ovariectomie diminuent également la libido. Les cicatrices, la colostomie et la dérivation urinaire sont également des freins à une sexualité épanouie.
Conclusion
La reconstruction vaginale après exentération pelvienne permet la diminution des complications post-opératoires, infectieuses ou digestives, en assurant un comblement pelvien adéquat. Elle améliore donc le pronostic de cette intervention lourde et mutilante. D’autre part, la reconstruction vaginale permet à ces patientes souvent affaiblies sur le plan psychologique de maintenir un schéma corporel féminin proche de la normale et de pouvoir, si elles le souhaitent, poursuivre une activité sexuelle. Les progrès en planification pré-opératoire (reconstruction 3D et Réalité augmentée) semblent améliorer la chirurgie de reconstruction par lambeaux perforants. Le vert d’indocyanine est également un outil performant pour évaluer la viabilité de ces lambeaux. La reconstruction vaginale isolée donne des résultats satisfaisants. Des nouvelles approches de reconstruction vaginale sont également en évaluation faisant appel à l’ingénierie tissulaire (Scaffold) et à la thérapie cellulaire par adjonction de cellules souches (24, 25).
Références
Sedlis A, Robboy SJ. Diseases of the vagina. In: Kurman, ed. Blausteins’s Pathology of the Female Genital Tract. New York: Springer, 1987:98–140.).
• Weichman KE, Matros E, Disa JJ. Reconstruction of Peripelvic Oncologic Defects. Plast Reconstr Surg. 2017 Oct;140(4):601e-612e.
• YinY, Ma L. Development of the mamalian female reproductive tract. J Biochem (Tokyo) 2005;137:677-83. 4-Josso N, Racine C, DiClemente N, Rey R, Xavier F. The role of antimullerian hormone in gonadal development. Mol Cell Endocrinol 1998;145:3-7.
• Ferron G, Martel P, Querleu D. Reconstruction vaginale après exentération pelvienne : quand la proposer et quelle technique ? Bull Cancer 2003 ;90(5) :435-40
• G. Ferron, C. Pomel, Martinez A, Narducci F, LambaudieE, Marchal F, Rouanet P, Querleu D. Exentération pelvienne : actualités et perspectives. Gynécologie Obstétrique & Fertilite 2012; 40 :43–47.
• Boyd SD, Feinberg SM, Skinner DG, Lieskovsky G, Baron D, Richardson J. Quality of life survey of urinary diversion patients: comparison of ileal conduits versuscontinent Kock ileal reservoirs. J Urol 1987;138(6):1386–9.
• Houvenaeghel G, Moutardier V, Karsenty G, Bladou F, Lelong B, Buttarelli M, et al. Major complications of urinary diversion after pelvic exenteration for gynecologic malignancies: a 23-year mono-institutional experience in 124 patients. Gynecol Oncol 2004;92(2):680–3.
• Ferron et al.Vaginal reconstruction with pedicled vertical deep inferior epigastric perforator fl ap (diep) after pelvic exenteration. A consecutive case series. Gynecologic Oncology 2015;38 :603–608.
• Qiu SS, Jurado M, Hontanilla B. Comparison of TRAM versus DIEP fl ap in total vaginal reconstruction after pelvic exenteration. Plast Reconstr Surg. 2013 Dec;132(6):1020e-7e.
• Knox AD, Ho AL, Leung L, Tashakkor AY, Lennox PA, Van Laeken N, Macadam SA. Comparison of Outcomes following Autologous Breast Reconstruction Using the DIEP and Pedicled TRAM Flaps: A 12-Year Clinical Retrospective Study and Literature Review. Plast Reconstr Surg. 2016 Jul;138(1):16-28.
• Minqiang X, Lanhua M, Jie L, Dali M, Jinguo L. The value of multidetector-row CT angiography for pre-operative planning of breast reconstruction with deep inferior epigastric arterial perforator flaps. Br J Radiol. 2010 Jan;83(985):40-3.
• Bosc R, Fitoussi A, Pigneur F, Tacher V, Hersant B, Meningaud JP. [Identification of perforating vessels by augmented reality: Application for the deep inferior epigastric perforator flap]. Ann Chir Plast Esthet. 2017 Aug;62(4):336-339.
• Bosc R, Fitoussi A, Pigneur F, Tacher V, Hersant B, Meningaud JP. Identication of perforating vessels by augmented reality: Application for the deep inferior epigastric perforator flap.2Ann Chir Plast Esthet. 2017 Aug;62(4):336-339.
• Kusiak JF, Rosenblum NG. Neovaginal reconstruction after exenteration using an omental fl ap and split-thickness skin graft. Plast Reconstr Surg 1996 ;4 :775-81.
• Beemer W, Hopkins MP, Morley GW. Vaginal reconstruction in gynecologic oncology. Obstet Gynecol 1988 ;72 :911-4.
• McCraw JB, Massey FM, Shanklin KD, Horton CE. Vaginal reconstruction with gracilis myocutaneous fl aps. Plast Reconstr Surg 1976;58:176-83.
• Soper JT, Rodriguez G, Berchuck A, Clarke-Pearson DL. Long and short gracilis myocutaneous fl pas for vulvovaginal reconstruction after radical pelvic surgery : comparison of flap specific complications. Gynecol Oncol 1995 ;56 :271-5.
• Ratliff CR, Gershenson DM, Morris M, Burke TW, Levenback C, Schover LR, et al. Sexual adjustment of patients undergoing gracilis myocutaneous flap vaginal reconstruction in conjunction with pelvic exenteration. Cancer 1996;78 :2229-35
• Loree Tr, Hempling RE, Eltabbakh GH, Recio FO, Piver MS. The inferior gluteal fl ap in the difficult vulvar and perineal reconstruction. Gynecol Oncol 1997 ;66 :429-34.
• Toft G, Larsen J. Neo-vaginal construction with subcutaneously based gluteal-fold fl aps: a case report. Eur J Plast Surg (2006) 29: 35–37.
• Gleeson NC, Baile W, Roberts WS, Hoffman MS, Fiorica JV, Finan MA, Cavanagh D. Pudendal thigh fasciocutaneous fl aps for vaginal reconstruction in gynecologic oncology. Gynecol Oncol. 1994 Sep;54(3):269-74
• Klingele CJ, Gebhart JB, Croak AJ, DiMarco CS, Lesnick TG, Lee RA. McIndoe procedure for vaginal agenesis: long-term outcome and effect on quality of life. Am J Obstet Gynecol 2003;189:1569-72.,
• Özkan Ö, Özkan Ö, Çinpolat A, Do�an NU, Bekta� G, Dolay K, Gürkan A, Arıcı C, Do�an S. Vaginal reconstruction with the modied rectosigmoid colon: surgicaltechnique, long-term results and sexual outcomes. J Plast Surg Hand Surg. 2018Mar 8:1-7.
• Ratliff CR, Gershenson DM, Morris M, Burke TW, Levenback C, Schover LR, Mitchell MF, Atkinson EN, Wharton JT. Sexual adjustment of patients undergoing gracilis myocutaneous fl ap vaginal reconstruction in conjunction with pelvic exenteration. Cancer. 1996 Nov 15;78(10):2229-35.
• Seyed-Forootan K, Karimi H, Seyed-Forootan NS. Autologous Fibroblast-Seeded Amnion for Reconstruction of Neo-vagina in Male-to-Female Reassignment Surgery. Aesthetic Plast Surg. 2018 Apr;42(2):491-497.
• Raya-Rivera AM, Esquiliano D, Fierro-Pastrana R, López-Bayghen E, Valencia P, Ordorica-Flores R, Soker S, Yoo JJ, Atala A. Tissue-engineered autologous vaginal organs in patients: a pilot cohort study. Lancet. 2014 Jul 26;384(9940):329-36.
Article paru dans la revue “ Les Jeunes Chirurgiens” / CNJC n°1

