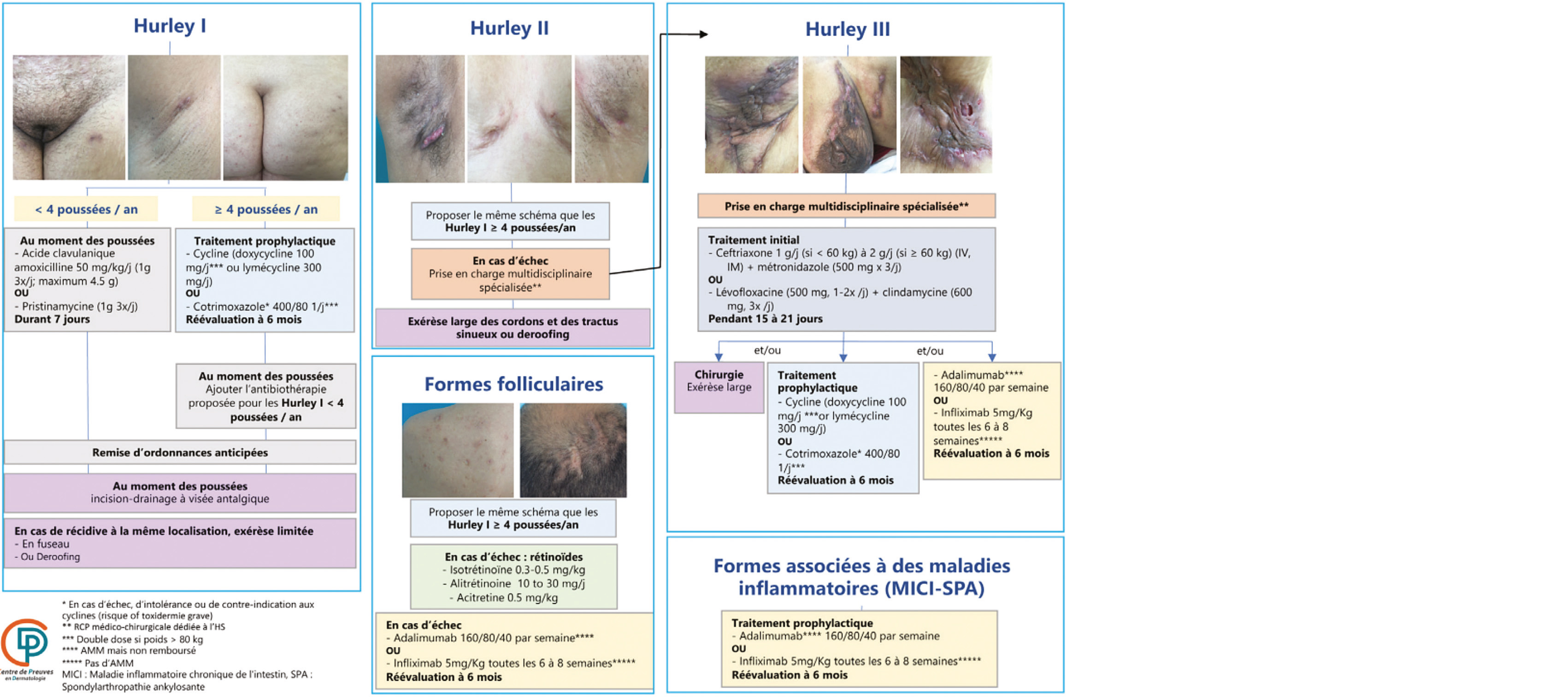
1. Recommandations françaises pour la prise en charge de l'hidradénite suppurée
European S2k guidelines for hidradenitis suppurativa/acne inversa part 2 : Treatment. J Eur Acad Dermatol Venereol. 2024 Dec 19. doi: 10.1111/jdv.20472. Epub ahead of print. PMID: 39699926.
CHLOÉ CHALLAMEL, Toulou se ; LISA MAUDET, Nancy
Liens d'intérêt : aucun
Résumé
L'hidradénite suppurée (HS) est une maladie chronique nécessitant une prise en charge multidisciplinaire de long terme afin de prendre en compte la douleur, l'impact psychologique, les traitements médicaux et chirurgicaux et la préservation de l'écologie microbienne.
Le diagnostic d'HS repose sur un faisceau d'arguments cliniques, associant :
• Des lésions typiques : nodules et abcès douloureux évoluant vers la suppuration, la fistulisation ou la formation de cicatrices ;
• Dans des localisations typiques : aisselles, plis inguinaux, région périanale ou périnéale, seins et plis sous mammaires, pli inter-fessier, pubis ;
• Une évolution typique des lésions : chronique et récidivante, avec au moins 2 poussées en 6 mois.
Les recommandations présentées constituent une mise-à-jour des recommandations européennes de 2015. Réalisées conformément à la méthode DELPHI, elles visent à améliorer la prise en charge des patients atteints d'HS classés en deux groupes selon s'ils présentent ou non une Forme inflammatoire de la maladie. Les scores recommandés pour apprécier la sévérité de l'atteinte clinique sont l'IHS4 et l'IHS4-55.
2. Le remibrutinib dans l'urticaire chroniǫue spontanée
Metz M, Giménez-Arnau A, Hide M, Lebwohl M, Mosnaim G, Saini S, Sussman G, Szalewski R, Haemmerle S, Lheritier K, Martzloff ED, Seko N, Wang P, Zharkov A, Maurer M; REMIX-1 and REMIX-2 Investigators; REMIX-1 Investigators; REMIX-2 Investigators. Remibrutinib in Chronic Spontaneous Urticaria. N Engl J Med. 2025 Mar 6;392(10):984-994. doi: 10.1056/NEJMoa2408792. PMID: 40043237.
Sarah MILESI, Toulouse
Liens d'intérêt : aucun
Résumé
L'urticaire chronique spontanée (UCS) est caractérisée par la survenue d'un prurit, de papules migratrices et/ou d'un angioœdème de façon répétée pendant plus de 6 semaines, sans facteur déclenchant identifiable.
Les antihistaminiques H1 de 2ème génération constituent la première ligne thérapeutique de l'UCS, mais plus de 50 % des patients conservent des symptômes malgré l'augmentation des anti-H1 à la posologie maximale de quatre comprimés par jour. Selon les guidelines internationales, l'omalizumab, anticorps monoclonal anti-IgE, constitue actuellement le seul traitement validé après l'échec des antihistaminiques.
Le remibrutinib est un inhibiteur hautement sélectif de la tyrosine kinase de Bruton permettant de bloquer la dégranulation mastocytaire en aval du récepteur à l'IgE (FcεRI).
L'article présente les résultats de deux essais de phase 3 (REMIX-1 et REMIX-2) évaluant l'efficacité (score UAS7) du remibrutinib contre placebo à 12 semaines chez les patients présentant une UCS résistante aux anti-H1 de 2ème génération. Dans ces deux essais de design identique multicentriques en double aveugle, les patients étaient randomisés en 2:1 à recevoir le remibrutinib à la dose de 25 mg deux fois par jour per os en association à un traitement antihistaminique de fond, ou le placebo associé aux antihistaminiques. 925 patients ont été inclus dont 470 dans REMIX-1 et 455 dans REMIX-2 et suivis pour une période prédéfinie de 24 semaines.
Les résultats montrent une diminution significativement plus importante du score UAS7 à 12 semaines chez les patients recevant le remibrutinib, dans REMIX 1 (-20,0 + 0,7 vs – 13,8 + 1, p < 0,001) et REMIX 2 (-19,4 + 0,7 vs -11,7 + 0,9, p < 0,001). L'effet était observé dès la première semaine de suivi et se maintenait dans le temps jusqu'à la semaine 24.
Les taux d'événements indésirables étaient similaires entre les groupes remibrutinib (64,9 %) et placebo (64,7 %). La majorité d'entre eux étaient légers ou modérés. À noter la fréquence significativement plus élevée de pétéchies dans le groupe traité (3,8 %) que dans le groupe placebo (0,3 %). Ces dernières étaient transitoires et n'ont entraîné l'arrêt du traitement que chez un seul patient. Les rares effets indésirables sévères rapportés (3,3 % dans le groupe remibrutinib vs 2,3 % dans le groupe placebo) n'ont pas été considérés comme imputables au traitement.
Commentaire
Le remibrutinib pourrait représenter une alternative thérapeutique attractive, en amont ou en parallèle des anti-IgE, notamment pour les patients nécessitant des thérapeutiques orales. Les données à long terme manquent toutefois pour confirmer le maintien de l'efficacité au-delà de 24 semaines, ainsi que des données d'efficacité comparative à la molécule de référence actuelle que constitue l'omalizumab. Des études sont actuellement en cours quant à l'efficacité du remibrutinib dans l'urticaire inductible.
Innovation
1. Caractérisation sur modèle murin d'un axe corps-cerveau transitant par le nerf vague et permettant de moduler les réponses immunitaires innées
Jin H, Li M, Jeong E, Castro-Martinez F, Zuker CS. A body-brain circuit that regulates body inflammatory responses. Nature. 2024 Jun;630(8017):695-703. doi: 10.1038/s41586-024-07469-y. Epub 2024 May 1. PMID: 38692285; PMCID: PMC11186780.
Arno Wahler, Paris
Liens d'intérêt : aucun
Résumé
La modulation de la réponse immunitaire par des mécanismes neurologiques centraux est une voie de recherche prometteuse offrant d'importantes perspectives thérapeutiques. Dans cette étude sur modèle murin, les auteurs ont mis en évidence deux populations neuronales distinctes qui réagissent aux cytokines pro- et anti-inflammatoires libérées lors de l'activation du système immunitaire inné. Cette réponse est médiée par le nerf vague jusqu'au noyau caudal du tractus solitaire (cNST) dans le tronc cérébral, déclenchant une modulation centrale de l'inflammation encore mal caractérisée.
Identification de l'axe corps-cerveau transitant par le nerf vague
Les auteurs ont d'abord identifié des neurones vagaux spécifiques, activés par des signaux inflammatoires périphériques et transmettant l'information au cNST. L'injection de lipopolysaccharide (LPS) entraîne l'activation de neurones dans le cNST, mais cet effet ne résulte pas d'un contact direct entre le LPS et ces neurones, suggérant un relais via le nerf vague.
Rôle du cNST et modulation de l'inflammation
L'inhibition du cNST induit une inflammation périphérique excessive, caractérisée par une forte augmentation des cytokines pro-inflammatoires et une réduction des cytokines anti-inflammatoires. À l'inverse, son activation module la réponse inflammatoire en réduisant les cytokines pro-inflammatoires et en augmentant celles dont l'effet est anti-inflammatoire.
Identification des populations neuronales spécifiques du cNST
Le séquençage d'ARN monocellulaire a permis d'identifier les neurones glutamatergiques du cNST comme responsables de la suppression de l'inflammation. Grâce à une imagerie in vivo ciblée, les auteurs ont également mis en évidence des sous-populations spécifiques de neurones vagaux réactifs aux cytokines inflammatoires. Certaines sont activées par l'interleukine (IL) 10 et favorisent la réponse anti-inflammatoire, tandis que d'autres répondent aux cytokines pro-inflammatoires (IL-6, IL-1β, tumor necrosis factor) et participent à l'atténuation de la réponse inflammatoire excessive. Ainsi, deux voies neuronales distinctes assurent la transmission des signaux inflammatoires et anti-inflammatoires entre la périphérie et le cNST, régulant ainsi la réponse immunitaire.
Restauration de l'équilibre immunitaire
Les auteurs ont exploré le potentiel thérapeutique de l'activation de ce circuit dans deux modèles pathologiques. Premièrement, ils ont montré que son activation améliore la survie de souris exposées à une dose létale de LPS. Deuxièmement, chez des souris atteintes de colite ulcéreuse, l'activation de ce circuit réduit l'inflammation et améliore la survie.
Conclusion et perspectives thérapeutiques
Ce travail sur modèle murin met en évidence un circuit corps-cerveau transitant via le nerf vague et jouant un rôle clé dans la régulation de l'inflammation. Sa modulation pourrait ouvrir de nouvelles perspectives thérapeutiques pour le traitement des maladies inflammatoires et autoimmunes.
Commentaire
Grâce à une approche combinant neurophysiologie et manipulation génétique sélective sur modèle murin in vivo, les auteurs mettent en évidence le rôle clé de la modulation centrale dans les processus immunitaires innés. Ils identifient des populations neuronales spécifiques à certaines cytokines au sein du nerf vague ainsi que des populations de neurones centraux dans le noyau caudal du tractus solitaire, ouvrant la voie à une meilleure caractérisation des mécanismes modulant leurs effets respectifs. Des questions demeurent, notamment concernant la manière dont les signaux descendants influencent les réponses cytokiniques des cellules périphériques. Inscrit dans la continuité des recherches sur l'interaction entre système nerveux central et immunité périphérique, ce travail pourrait ouvrir des perspectives thérapeutiques pour les maladies impliquant une réponse immunitaire altérée.
2. Développement d'analyses moléculaires pour proposer des traitements personnalisés des dermatoses inflammatoires
Seremet T, Di Domizio J, Girardin A, et al. Immune modules to guide diagnosis and personalized treatment of inflammatory skin diseases. Nat Commun. 2024 Dec 18;15:10688. doi:10.1038/ s41467-024-40739-w.
Clément Svabek, Lille
Liens d'intérêt : aucun
Résumé
Ces dernières années, les biothérapies ciblées ont transformé la prise en charge des dermatoses inflammatoires chroniques- riasis, eczéma, lupus cutané, lichen plan. Chacune de ces pathologies est associée à une voie immunitaire spécifique. Si ces traitements sont souvent efficaces, une partie des patients n'y répond pas, ce qui peut faire suspecter une erreur diagnostique ou un mauvais ciblage thérapeutique.
Pour améliorer la précision dia- gnostique et guider le choix du traitement, les auteurs ont développé une cartographie moléculaire à partir de l'analyse de l'expression de 600 gènes impliqués dans l'immunité sur des biopsies cutanées de 264 patients. Un sous-groupe de cas « sentinelles » — patients présentant des tableaux cliniques et histologiques typiques — a permis d'identifier sept « modules immunitaires ». Il s'agit de groupes de gènes dont l'activation simultanée reflète une voie inflammatoire bien définie : Th1, Th2, Th17, IFN de type I, neutrophilique, macrophagique ou éosinophilique.
L'analyse des profils d'expression a permis de regrouper les maladies selon leur module immunitaire do- minant en s'appuyant sur des méthodes de classification visuelle des profils moléculaires pour détecter des signatures homogènes au sein de chaque entité. Ces signatures semblent rester stables quel que soit le site de prélèvement ou le moment du recueil.
La performance diagnostique de cette méthode était nettement supérieure aux examens histopathologiques classiques (indice Fowlkes- Mallows de 0,95 contre 0,74), ce qui est particulièrement intéressant pour les cas complexes comme les érythrodermies ou les éruptions in- déterminées, où elle permet d'orienter le diagnostic (psoriasis, dermatite atopique, toxidermie, etc.) avec une précision parfaite (FM = 1,00).
Chez 80 patients recevant une biothérapie ciblée, les biopsies pré-thérapeutiques ont révélé que les répondeurs présentaient systématiquement un module dominant correspondant à la cible du traitement (ex. Th2 pour le dupilumab). À l'inverse, les non-répondeurs avaient souvent un profil immunitaire non concordant avec la thérapie reçue. Chez plusieurs d'entre eux, un ajustement du traitement basé sur le module identifié a permis une réponse clinique complète. À noter que l'on retrouvait aussi des cas de basculement de profil immunitaire sous traitement (ex. passage du profil Th2 au profil Th1), suggérant un mécanisme d'échappement thérapeutique.
Cette stratégie prometteuse de médecine de précision appliquée à la dermatologie pourrait être intégrée à la pratique clinique après automatisation et simplification du procédé. Elle nécessitera également le développement de méthodes de prélèvement moins invasives que la biopsie, et l'élargissement du panel génique analysé pour affiner certains profils.
Commentaire
Bien que la médecine de précision soit déjà développée en oncodermatologie, cette étude ouvre la voie à une approche plus personnalisée dans le champ des dermatoses inflammatoires. Un suivi longitudinal des modules immunitaires chez un même patient pourrait permettre de détecter précocement un échappement thérapeutique et d'adapter le traitement en temps réel. Il serait également intéressant d'évaluer le rapport coût-efficacité de cette approche, qui pourrait permettre à terme de limiter les échecs thérapeutiques et d'optimiser les dépenses associées.
Cependant, le coût encore élevé de cette technologie restreint pour l'instant sa diffusion en dehors des centres spécialisés. De plus, le délai nécessaire pour obtenir et interpréter les résultats reste difficilement compatible avec certaines situations cliniques urgentes. Enfin, le panel actuel de 600 gènes pourrait ne pas suffire pour couvrir toute la diversité des profils inflammatoires.
Cette approche mérite d'être affinée, afin d'être intégrée de manière pragmatique à la prise en charge des dermatoses inflammatoires.

Originalité
1. Réduction du risǫue de marche atopiǫue chez les enfants atteints de dermatite atopiǫue traités par dupilumab
T-L Lin, Y-H Fan, K-S Fan and al., Reduced atopic march risk in pediatric atopic dermatitis patients prescribed dupilumab versus conventional immunomodulatory therapy: A population-based cohort study, Am Acad Dermatol. 2024 Sep;91:466-473
Marion Testard, Nancy
Liens d'intérêt : aucun
Résumé
La dermatite atopique (DA) est une dermatose inflammatoire associée à l'asthme et à la rhinite allergique (RA). On parle de “marche atopique” lorsque ces deux comorbidités font suite à la DA. Elles concernent deux tiers des patients atopiques, plus fréquemment dans les formes sévères de DA. Le dupilumab (DUPI) est un anticorps monoclonal ciblant le récepteur des interleukines 4 et 13, ayant fait la preuve de son efficacité dans le traitement de la DA. L'objectif de l'étude est d'étudier l'impact du DUPI versus un traitement conventionnel (CONV) sur la marche atopique et d'identifier d'éventuelles variations en fonction de l'âge. Cette étude de cohorte rétrospective a inclus des patients de moins de 18 ans traités pour une DA, ayant reçu soit le dupilumab soit un traitement conventionnel (corticoïdes systémiques, méthotrexate, azathioprine, ciclosporine). Les patients précédemment traités par un autre traitement immunomodulateur que le dupilumab ou ayant un antécédent d'asthme ou de RA ont été exclus. Les deux cohortes étaient appariées selon un ratio de 1:1 en fonction de l'âge, du sexe, de l'origine ethnique, des comorbidités, des bilans biologiques et des traitements antérieurs. L'événement d'intérêt principal était l'apparition d'un asthme ou d'une RA au cours des 3 ans de suivi. Des analyses en sous groupe ont été réalisées selon le groupe d'âge (moins de 6 ans, 6 à 12 ans et plus de 12 ans).
Les deux cohortes comprenaient 2192 enfants, d'âge moyen de 9 ans et de 7 ans respectivement à l'inclusion. L'incidence cumulée de progression de la maladie atopique dans le groupe DUPI était significativement plus faible (20,09 % ; IC 95 %, 16,84 %-23,88 %) que dans le groupe CONV (27,22 % ; IC 95 %, 23,41 %-31,52 %). En analysant l'asthme et la RA pris isolément, l'incidence cumulée sur 3 ans dans le groupe DUPI était significativement diminuée tant pour l'asthme (9,43 % ; IC 95 %, 7,10 %-12,46 % vs 14,64 % ;IC 95%, 11,70 %-18,23 % ; P = .001) que pour la RA (13,57 % ; IC 95 %, 10,93 %-16,78 % vs 20,52 % ; IC 95 %, 17,03 %-24,62 % ; P = .003) par rapport au groupe CONV. Dans le groupe DUPI, il a été mis en évi- dence une réduction significative de la progression de la maladie atopique (HR 0,679, IC 95% 0,554-0,831) et d'asthme (HR 0,600, IC 95 % 0,446-0,808), ceci quel que soit le groupe d'âge. Les enfants ayant un asthme ou une RA avaient également significativement moins de symptômes et de traitements dans le groupe DUPI par rapport au groupe CONV.
Ces résultats suggèrent que le traitement des enfants ayant une DA par dupilumab permettrait de diminuer significativement le risque de développer une marche atopique, un asthme ou une RA.
Commentaire
Le dupilumab influence les mécanismes de la marche atopique en ciblant l'IL-4 et l'IL-13, en réduisant la production d'IgE et en agissant sur l'immunité de type 2. Dans cette étude, les plus jeunes enfants traités par dupilumab ont eu davantage de bénéfices : la réduction de la progression de la marche atopique était plus importante dans le sous- groupe des moins de 6 ans. Il est à souligner que les groupes à l'étude ont été appariés sur de nombreux critères cliniques et démographiques afin de diminuer l'impact du caractère observationnel et rétrospectif, principale limite méthodologique de cette étude.

