Un homme de 45 ans, non tabagique, sans antécédent médico-chirurgical notable est adressé pour douleur thoracique à type d'angor d'effort typique lors de la pratique d'une activité physique inhabituelle chez ce patient.
L'ECG post critique est sans particularité et les examens biologiques prescrits sont normau (troponines US notamment). De même, l'ETT est normal.
Il est décidé de ne pas aller en salle de cathétérisme, mais de réaliser un scanner cardiaque synchronisé à l'ECG dont voici quelques coupes.
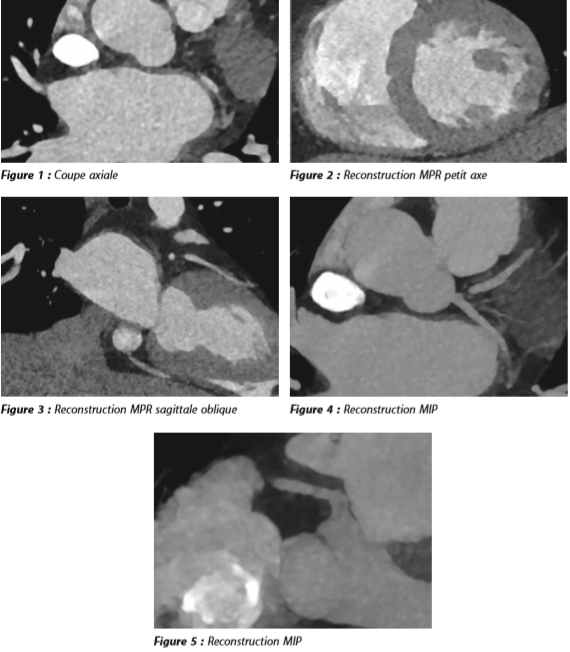
Quel est votre diagnostic ?
Hotcase Radeos solution page 25
Une patiente de 15 ans, vivant dans l'est de la France, à la campagne, est adressée en échographie pédiatrique du CHU de Besançon pour mise en évidence lors d'une échographie abdomino-pelvienne réalisée en externe d'un épanchement péritonéal avec lésions péritonéales pelviennes kystiques d'allure tumorale et hypertrophie de l'ovaire droit. Ses symptômes sont des douleurs abdominales diffuses et modérées, évoluant depuis 6 mois et ayant notamment débutées 1 mois après un traumatisme abdominal de l'hypochondre droit. La patiente est en excellent état général.
Une IRM pelvienne est ensuite demandée, que vous réalisiez.
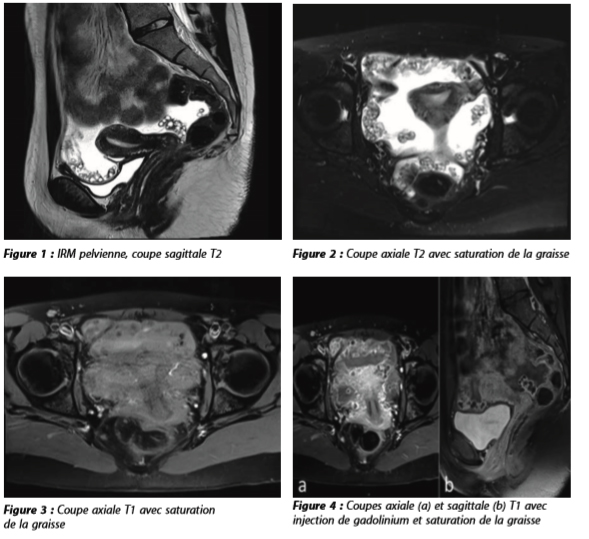
Interprétez l'IRM : vous suspectez un diagnostic. Quel examen d'imagerie complémentaire faites-vous ?
Solution Hotcase Radeos publié page 21
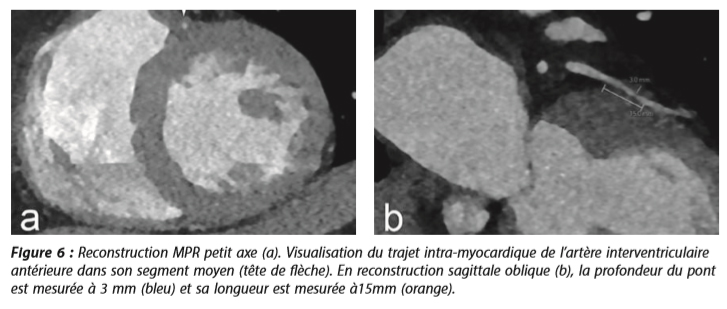
Pont myocardique profond de l'artère coronaire interventriculaire antérieure dans sa portion moyenne.
Les images montrent la présence d'une plage de tissu de densité myocardique engainant de manière circonférentielle la portion moyenne de l'IVA (fig. 6a). La coupe sagittale dévoile bien la course intra-myocardique de l'IVA sur environ 15 mm et d'une profondeur de 3mm (fig. 6b), par opposition au trajet épicardique normal de la coronaire droite et du tronc commun gauche. Cette anomalie correspond donc à ce que l'on appelle un pont myocardique qui est susceptible d'expliquer l'épisode angineux. Par ailleurs, le coroscanner n'a pas révélé de coronaropathie.
Décrit pour la première fois par Reyman en 1737, le « myocardial bridge » est défini comme étant un recouvrement segmentaire d'une artère coronaire par une bande myocardique dans son trajet naturel épicardique. Considéré chez l'humain comme une variante anatomique plutôt qu'une anomalie congénitale, il semble être un vestige génétique de l'évolution naturelle embryologique (la formation des coronaires se fait à partir du muscle cardiaque, fusionnant dans un second temps au niveau de la racine de l'aorte sous forme de deux artères. L'orientation des vaisseaux vers l'aorte serait secondaire à la présence de cardiomyocytes dans la racine de l'aorte). Hautement prévalent, il représente l'anomalie coronaire la plus fréquente chez l'humain.
Dans la grande majorité des cas, il reste asymptomatique et est de fait de découverte souvent fortuite, notamment depuis le développement du coroscanner. Rarement, il est responsable d'une compression systolique entraînant une symptomatologie ischémique myocardique. Pour rappel, la perfusion coronaire se fait en diastole, du fait du relâchement du myocarde (fig. 7).
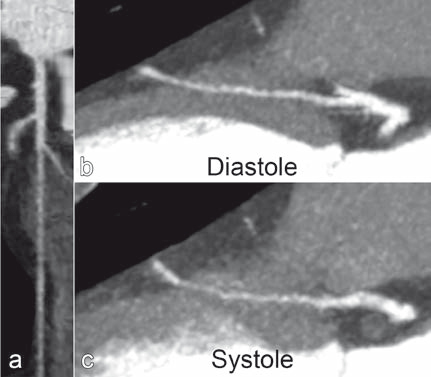
Figure 7 : Visualisation du pont myocardique sur la reconstruction curviligne dans l'axe du vaisseau (a). En diastole (b), le myocarde relâché ne sténose pas de l'artère coronaire, alors qu'il la sténose en systole (c).
Rappelons que le pont myocardique, bien que hautement prévalent dans la population générale, n'est que rarement symptomatique. Il faudrait une obstruction systolique >70 % pour qu'il devienne symptomatique. L'âge moyen d'apparition des symptômes se situe aux alentours de 46 ans. Les exceptionnelles manifestations cliniques peuvent varier de l'angor de repos jusqu'au syndrome coronarien aigu, avec notamment des infarctus antérieurs étendus chez les jeunes sujets, du fait de la localisation préférentielle des ponts myocardiques sur l'IVA et l'absence de collatéralisation chez cette population, la présence des ponts pouvant provoquer des dysfonctionnements ventriculaires par un mécanisme de sidération myocardique (stunning). Des troubles du rythme et de conduction ont également été décrits en association avec le pont myocardique et peuvent avoir comme manifestation une syncope, voire amener à une mort subite. Le traitement médicamenteux demeure le traitement de référence chez les patients ayant des ponts myocardiques symptomatiques. En cas de symptômes réfractaires et d'ischémie avérée, le traitement chirurgical représente l'alternative thérapeutique la plus efficace et durable. L'angioplastie par stent actif pourrait représenter une alternative thérapeutique chez les patients non opérables ou opposés à une opération, malgré un risque élevé de resténose et de fracture du stent.
En conclusion, le pont myocardique est l'anomalie coronaire la plus fréquente chez l'humain.
Il est très rarement symptomatique. Sur un coroscanner, il faut préciser (fig. 8) :
• le segment artériel concerné ;
• la longueur du pont ;
• et la profondeur, c'est-à-dire l'épaisseur de myocarde entre la paroi artérielle la plus superficielle et la graisse épicardique.
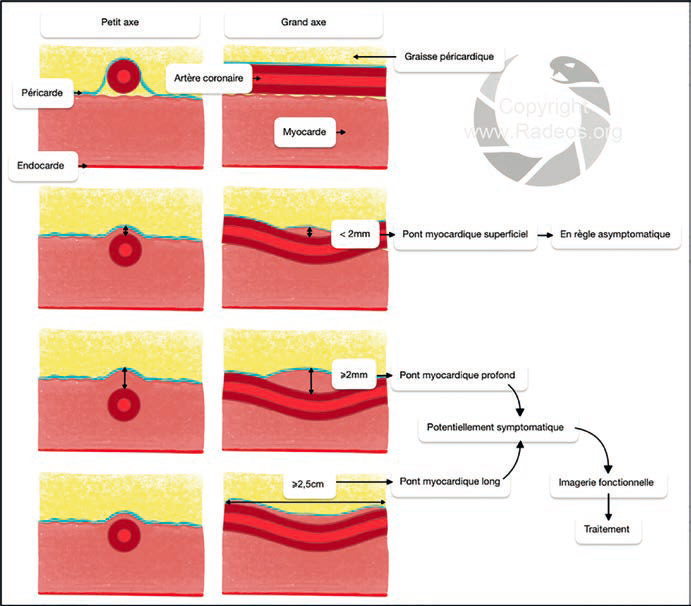
Figure 8 : Représentation schématique d'une artère coronaire normale dans son trajet naturel épicardique, et définitions du pont myocardique superficiel, profond et long.
La physiopathologie du pont myocardique symptomatique est complexe. Elle fait intervenir plusieurs mécanismes d'adaptations cellulaires dues aux modifications du flux coronarien. L'ischémie doit être avérée pour conclure à sa responsabilité dans les symptômes et surtout avant d'envisager un traitement invasif.
Pr Damien MANDRY
CHRU Nancy,
Pôle imagerie

Lyès HAMMOUDI
4ème semestre
CHRU Nancy,
Pôle imagerie

Dr Marion LENOIR
Praticien Hospitalier
CHU Besançon, imagerie pédiatrique et prénatale

Dr Jeanne BARILLON
Docteur Junior
CHU Besançon, imagerie pédiatrique et prénatale

