Rationnel
La curiethérapie interstitielle de peau est la technique de curie historique de référence pour les cancers cutanés hors mélanome, avec d'excellents résultats en termes de contrôle local, de toxicité et de résultats cosmétiques. L'adaptation de la technique avec fils d'Iridium en PDR puis en HDR permet des résultats comparables [1].
Toutefois elle présente l'inconvénient, pour des personnes âgées, de nécessiter une hospitalisation (avec 2 séances par jour, même en HDR) qui favorise les syndromes de glissement. Ces patients ont également souvent un traitement anticoagulant, ce qui nécessite un relai d'autant plus délicat qu'ils ont parfois une insuffisance rénale compliquant l'utilisation des HBPM.
La curiethérapie de surface est une technique non invasive qui consiste à appliquer à la peau le matériel de vecteur par l'intermédiaire d'un support tel, par exemple, un bolus. Elle permet de réaliser le traitement en ambulatoire et sans modifier le traitement anticoagulant. Selon le référentiel GEC ESTRO, elle est réservée aux lésions de moins de 5 mm d'épaisseur [2]. Le matériel vecteur doit être positionné de façon à respecter le système de Paris, de manière reproductible, avec un bolus d'au moins 5 mm entre la peau et les vecteurs et en limitant au maximum l'interposition d'air [3]. Elle nécessite également une vigilance sur la dose délivrée à la surface de la peau qui est plus élevée qu'en curie interstitielle.
Ces applications sont réalisables assez facilement sur des surfaces planes et régulières (cuir chevelu, membre) en utilisant du matériel industriel (applicateur de Leipzig® par exemple) ou en adaptant des vecteurs souples sur des bolus de radiothérapie [4].
Se pose le problème des surfaces complexes et/ou concaves, par exemple pour les localisations de la face. Une solution peut être la réalisation d'un matériel vecteur personnalisé via une imprimante 3D. Une solution plus personnalisée, avec un coût relativement faible, devrait permettre de réduire ces gaps d'air trop souvent présents avec les systèmes commerciaux et les bolus. Ce point fait actuellement l'objet d'une étude à l'ICL pour juger de la pertinence de ces nouveaux systèmes à disposition.
Aspect physique
La réalisation de ce support imprimé en 3D nécessite la réalisation d'un premier scanner pour la confection du matériel vecteur. À l'aide des images obtenues, les contours externes du patient seront utilisés pour modéliser le « bolus » représentant le support de vecteur. Le système de planification de traitement de Curiethérapie permet ensuite de déterminer l'emplacement des vecteurs dans le support pour traiter au mieux la tumeur. Les vecteurs sont positionnés à environ 5 mm de la peau du patient. Après le placement des vecteurs, une dosimétrie prévisionnelle est calculée. Lorsque la dosimétrie prévisionnelle est validée par le curiethérapeute et le physicien, les volumes et le plan sont envoyés vers un logiciel de CAO (Conception Assistée par Ordinateur) pour la conception du support. Des vides sont créés dans le support au niveau des emplacements de vecteurs. Ce support est ensuite imprimé. L'imprimante 3D permet de créer les volumes pleins avec le matériau PLA (acide poly lactique) et les volumes vides avec le matériau BVOH (copolymère d'alcool vinylique au buténédiol) qui est hydrosoluble. Une fois le support imprimé, les vecteurs sont insérés dans celui-ci.
Un scanner avec le support en place est réalisé à nouveau. Il permet ainsi de calculer la dosimétrie finale et définir les temps d'arrêt pour chaque position de la source.
La figure 1 montre le matériel vecteur réalisé pour une curiethérapie nasale par l'équipe de Poznan [5]
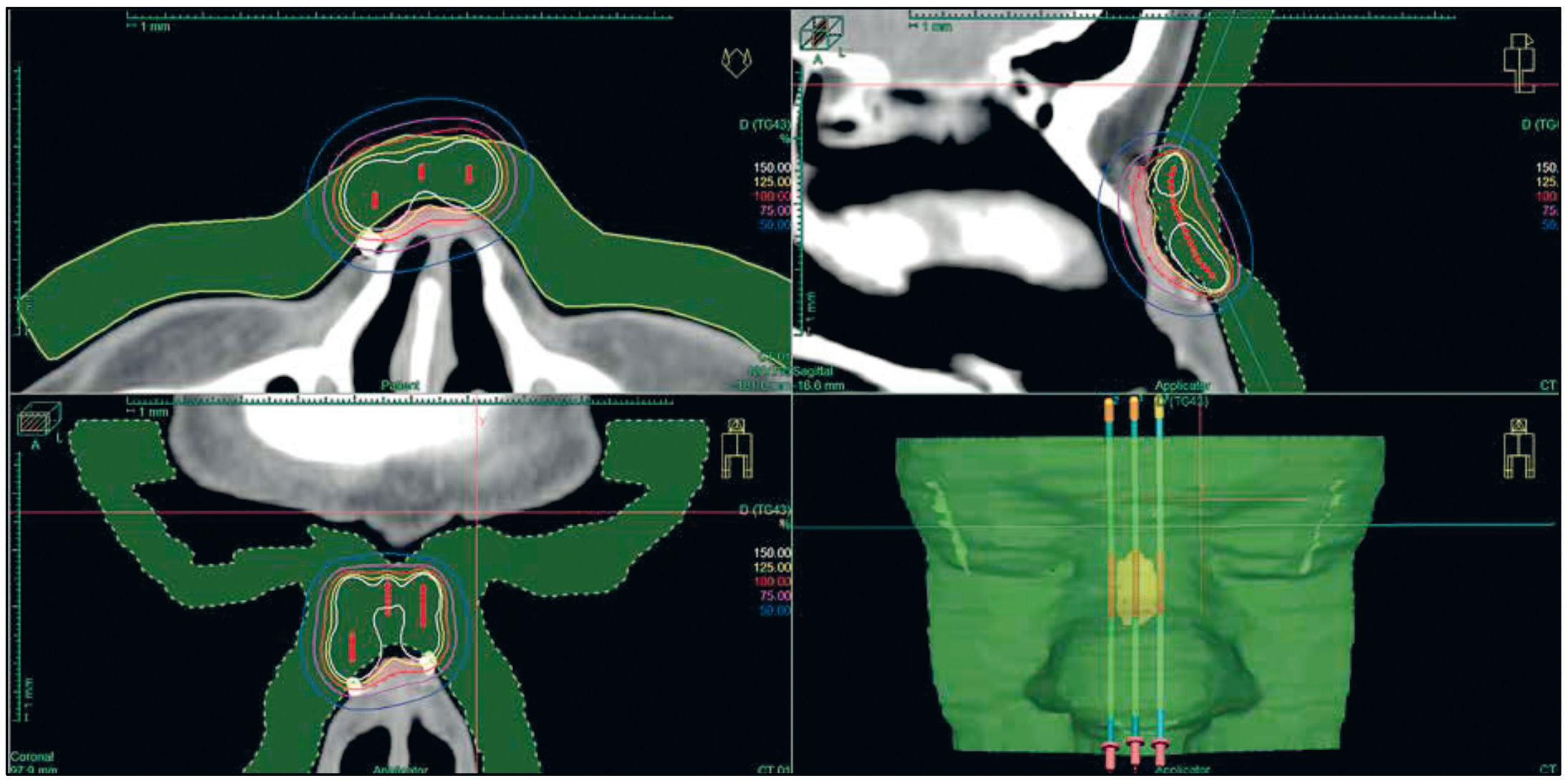
Cette technique innovante est très prometteuse en termes de qualité de traitement et de confort du patient.
Cependant, pour ce nouveau système à l'étude, il faut garder à l'esprit que ce type de dispositif semble être soumis à la nouvelle réglementation UE 2017/745 relative aux dispositifs médicaux (DM) et nécessite possiblement des démarches spécifiques auprès de l'ANSM.

Dr Sophie RENARD
Institut de Cancérologie de Lorraine

Emilie MEKNACI
Institut de Cancérologie de Lorraine
Références
1. Renard S, Salleron J, Py JF, Cuenin M, Buchheit I, Marchesi V, et al. High-dose-rate brachytherapy for facial skin cancer: Outcome and toxicity assessment for 71 cases. Brachytherapy. 2021; 20: 624–630. Doi:10.1016/j.brachy.2021.01.009.
2. Guinot JL, Rembielak A, Pérez-Calatayud J, Rodríguez-Villalba S, Skowronek J, Tagliaferri L, et al. GEC-ESTRO ACROP recommendations in skin brachytherapy. Radiother Oncol. 2018. doi:10.1016/j.radonc.2018.01.013.
3. Gonzalez-Perez V, Rembielak A, Guinot JL, Jaberi R, Lancellotta V, Walter R, et al. H&N and Skin (HNS) GEC-ESTRO Working Group critical review of recommendations regarding prescription depth, bolus thickness and maximum dose in skin superficial brachytherapy with flaps and customized molds. Radiother Oncol. 2022;175: 122–132. doi:10.1016/j.radonc.2022.08.022.
4. Jumeau R, Renard-Oldrini S, Courrech F, Buchheit I, Oldrini G, Vogin G, et al. High dose rate brachytherapy with customized applicators for malignant facial skin lesions. Cancer/Radiothérapie. 2016. doi:10.1016/j.canrad.2016.03.008.
5. Bielęda G, Chicheł A, Boehlke M, Zwierzchowski G, Chyrek A, Burchardt W, et al. 3D printing of individual skin brachytherapy applicator: Design, manufacturing, and early clinical results. J Contemp Brachytherapy. 2022; 14: 205–214. doi:10.5114/jcb.2022.114353.

