
Introduction
L'insuffisance aortique (IA) est une valvulopathie fréquente avec une prévalence estimée à 1,6 % de la population générale pour l'IA moyenne ou sévère (1). Dans sa forme chronique, largement la plus fréquente, elle reste longtemps asymptomatique et souvent bien tolérée mais grève le pronostic lorsqu'elle devient symptomatique (2). L'évaluation précise de sa sévérité et l'orientation au bon moment vers une prise en charge chirurgicale sont donc essentielles.
L'échocardiographie est la pierre angulaire de l'évaluation de l'IA. Néanmoins, dans certains cas, l'évaluation échocardiographique peut être difficile sur le plan du mécanisme ou de la quantification. De plus, l'association possible d'une dilatation aortique, pouvant motiver un geste chirurgical supplémentaire nécessite elle aussi une mesure précise des diamètres de l'aorte ascendante, parfois difficile en échocardiographie.
Dans ce contexte, l'imagerie multimodale s'avère être un outil précieux en pratique quotidienne pour l'évaluation de l'IA.
Évaluation de l'étiologie et du mécanisme de l'atteinte valvulaire
L'IA aiguë est généralement liée à une endocardite, une dissection aortique ou plus rarement un traumatisme thoracique (3).
L'IA chronique peut être d'origine dégénérative (le plus souvent), rhumatismale (surtout dans les pays en voie de développement) ou congénitale, secondaire à une bicuspidie ou plus arement à un syndrome de Laubry Pezzi (4). Sur le plan du mécanisme, une classification analogue à la classification de Carpentier pour l'insuffisance mitrale peut être utilisée (Figure 1) :
• Type 1 : Mouvement « normal » des sigmoïdes associé ou non à une dilatation de la racine aortique.
• Type 2 : Mouvement excessif lié à un prolapsus partiel ou complet (jet excentré).
• Type 3 : Restriction de mouvement des sigmoïdes lié à une calcification ou à une infiltration des cuspides.
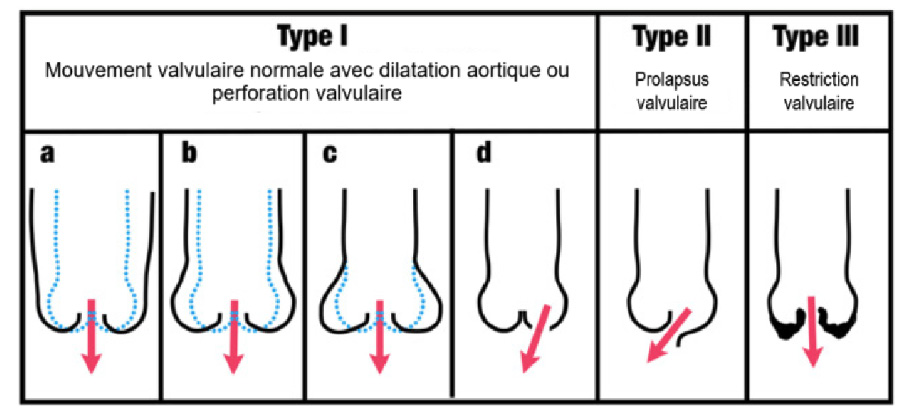
Figure 1. Classification des mécanismes de régurgitations valvulaires aortiques
L'évaluation du mécanisme et de l'étiologie se fait le plus souvent par échocardiographie transthoracique (ETT).
L'échocardiographie transoesophagienne (ETO) peut être nécessaire en cas de mécanisme complexe ou de mauvaise fenêtre ultrasonore.
L'imagerie en coupe, que ce soit le scanner ou l'IRM, peut également être utile pour préciser le caractère bi ou tricuspide de la valve, la présence de calcifications (surtout en scanner) ou d'images d'addition comme une masse ou une végétation ainsi qu'analyser le jeu valvulaire, la présence d'un prolapsus ou d'une perforation.
En cas d'insuffisance aortique sur prothèse, l'ETO permettra de localiser la fuite, plus facilement avec l'utilisation de sondes tridimensionnelles. Le scanner est également utile grâce à son excellente résolution spatiale permettant l'analyse des cusps de la prothèse et l'évaluation de lésions para-prothétiques (abcès, pseudo anévrysmes) (5) (Figure 2), la recherche de thrombus ainsi que l'analyse du mouvement des cusps en séquences ciné (6).
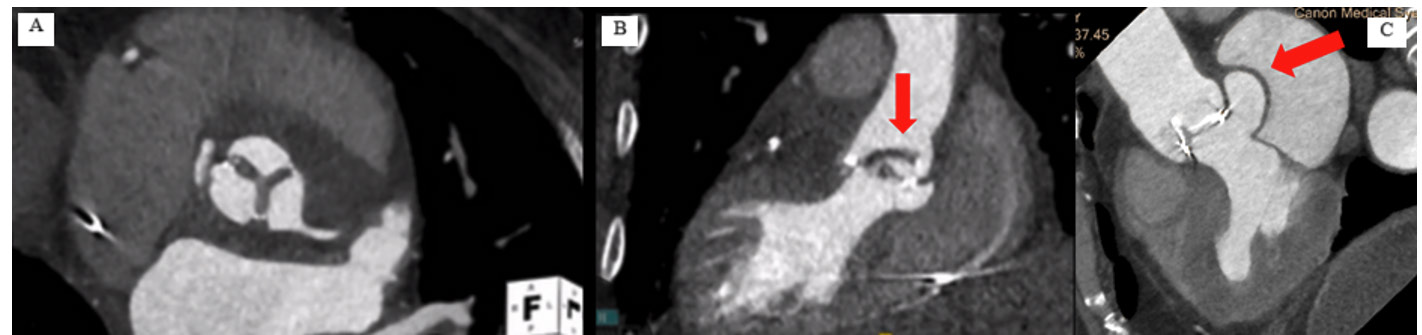
Figure 2. Endocardite infectieuse sur bioprothèse aortique avec épaississement des 3 cusps (A) et volumineuse végétation (B). Endocardite infectieuse sur bioprothèse aortique avec désinsertion de la partie postérieure de la prothèse responsable d'une fuite péri-prothétique très sévère (flèche) (C).
Évaluation de la sévérité
L'évaluation de l'IA se fait en utilisant une approche multiparamétrique. Elle associe une étude qualitative de la valve et du flux d'insuffisance en Doppler couleur ainsi que la mesure de paramètres quantitatifs et semi quantitatifs (tableau 1) (7).
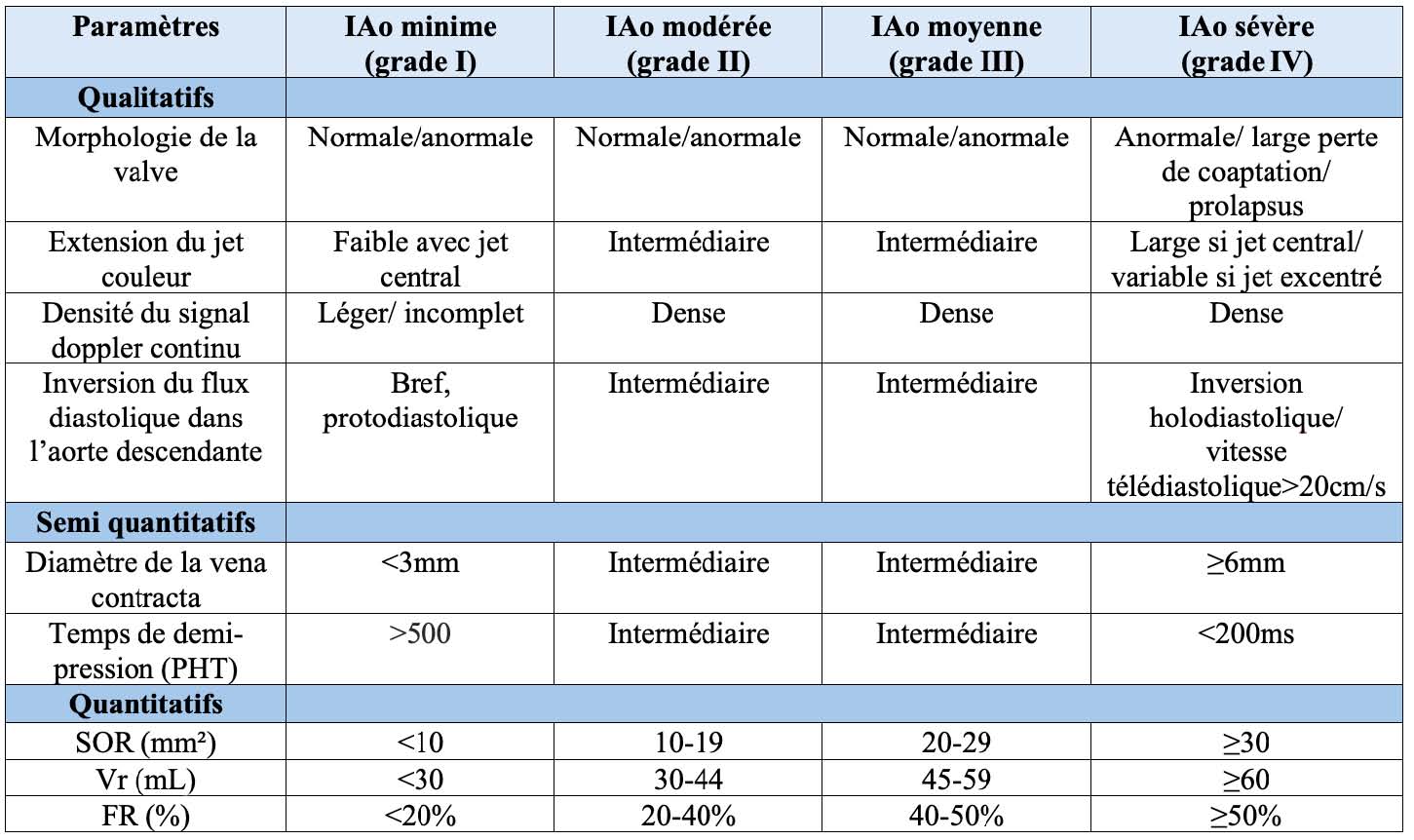
L'ETT ± complétée d'une ETO sera généralement suffisante pour identifier une IA minime ou une IA sévère grâce aux critères morphologiques et semi-quantitatifs. Les critères quantitatifs (surface de l'orifice régurgitant [SOR], volume régurgité [VR] et fraction de régurgitation [FR]) permettent de grader l'IA en 4 grades. Lorsque ces paramètres ne sont pas évaluables de façon fiable, il est parfois difficile de faire la part des choses en cas d'IA jugée modérée ou moyenne par les méthodes semi-quantitatives.
L'IRM cardiaque est alors un examen de choix pour confirmer le caractère modéré de la régurgitation et ne pas passer à côté d'une fuite plus sévère, surtout quand le ventricule gauche (VG) est dilaté. En effet, une IA chronique sévère est associée à une dilatation du VG et il ne faut pas hésiter à prescrire une imagerie complémentaire en cas de discordance entre l'évaluation échographique de l'IA et la taille du VG (IA jugée sévère avec un petit VG ou IA jugée modérée avec un VG dilaté) ou entre les symptômes et l'évaluation de l'IA (8). L'IRM est également très utile pour évaluer la sévérité d'une fuite paraprothétique dont la quantification est difficile en échocardiographie (9).
L'IRM est plus performante et reproductible que l'échocardiographie (10). L'évaluation de la fuite aortique ne nécessite pas d'injection de gadolinium et consiste en une mesure directe du volume régurgité en utilisant une cartographie des vitesses juste au-dessus de la valve aortique (imagerie en contraste de phase 2D) dans un plan perpendiculaire à la direction du flux sanguin. Une fois le plan de coupe obtenu, l'opérateur place une zone d'intérêt arrondie sur l'aorte et un post-traitement dédié analyse le flux sanguin à travers le plan aortique en générant une courbe de flux, qui permet de calculer le volume aortique antérograde (volume d'éjection systolique aortique), le volume régurgitant aortique et la fraction de régurgitation (volume régurgité/volume antérograde) (Figure 3).
Il faudra porter une attention particulière au choix de la vitesse d'encodage (placée habituellement à 250 cm/s en cas d'IA) qui devra être augmentée en cas de sténose associée.
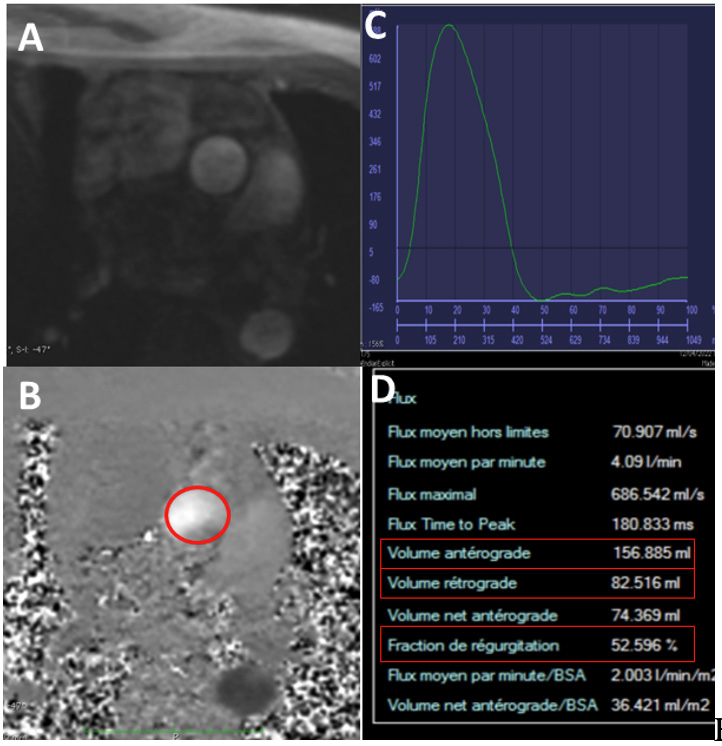
Figure 3.
A : Plan de coupe juste au-dessus de la valve.
B : Séquence en contraste de phase, le cercle rouge représente la zone d'intérêt tracée par l'opérateur.
C : Courbe de flux à travers le plan aortique. Tout ce qui est sous la ligne bleue représente la fuite aortique.
D : Quantification IRM de la fuite aortique avec un volume antérograde à 157ml, un volume rétrograde à 82 ml et une fraction de régurgitation à 82/157=52 %.
Cette mesure est reproductible et fiable si le flux est laminaire, mais est gênée en présence d'un flux complexe, notamment si la valve est anormale (bicuspidie), en présence d'une dilatation de la racine de l'aorte ou devant une arythmie (11). Les seuils retenus dans les recommandations sont transposés de l'échographie pour la quantification de la sévérité (Tableau 2), mais plusieurs études orientent vers une FR > 35 % et un VR > 45/50 mL pour définir une fuite sévère ou comme seuil prédictif de chirurgie (12).
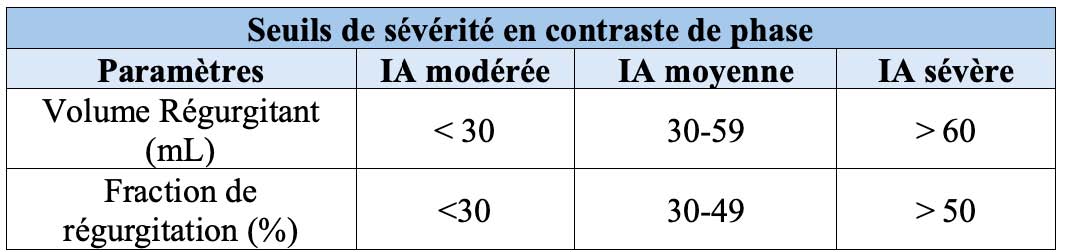
Tableau 2. Seuils de sévérité de l'IA en IRM (contraste de phase) (7)
L'évaluation des flux par la technique du 4D flow serait plus fiable que la technique 2D en cas de flux complexe ou turbulent (13) mais peu de centres l'utilisent en routine clinique car elle nécessite des logiciels dédiés non proposés par les grands constructeurs et nécessite des acquisitions plus longues.
Il est aussi possible d'évaluer le reflux dans l'aorte descendante. Une mesure > 10 mL/s serait fortement sensible et spécifique (14) d'une fuite sévère et serait associée un pronostic altéré (15).
Évaluation du retentissement
Le retentissement de l'IA est apprécié en échocardiographie en première intention avec évaluation du degré de dilatation du VG (mesure des diamètres et des volumes), d'hypertrophie ventriculaire gauche et l'estimation de la pression artérielle pulmonaire systolique à partir de l'enregistrement Doppler d'une fuite tricuspide. Le Strain global longitudinal est également intéressant pour stratifier le risque de mortalité chez les patients asymptomatiques avec un seuil aux alentours de -15 % (16).
Si l'IRM reste le gold standard pour la mesure des volumes VG et de la FEVG, les critères opératoires retenus chez les patients asymptomatiques ont été établis à partir des données échographiques (Tableau 3) (17). Néanmoins, la mesure des volumes en ETT 3D ou en IRM peut toutefois permettre de conforter la décision opératoire, la dilatation ventriculaire mesurée à l'IRM étant corrélée étroitement au pronostique (18). L'ETT 3D est quasiment aussi performante que l'IRM cardiaque pour l'évaluation des volumes et de la FEVG mais l'IRM présente un avantage majeur qui est la capacité de caractérisation tissulaire. En effet, l'IRM permet la recherche de fibrose focale (par la présence de rehaussement tardif intramyocardique ou sous épicardique) ou diffuse (par la mesure du T1 natif et du volume extra-cellulaire) dont la présence / l'augmentation est associée à une surmortalité (19) (Figure 4).
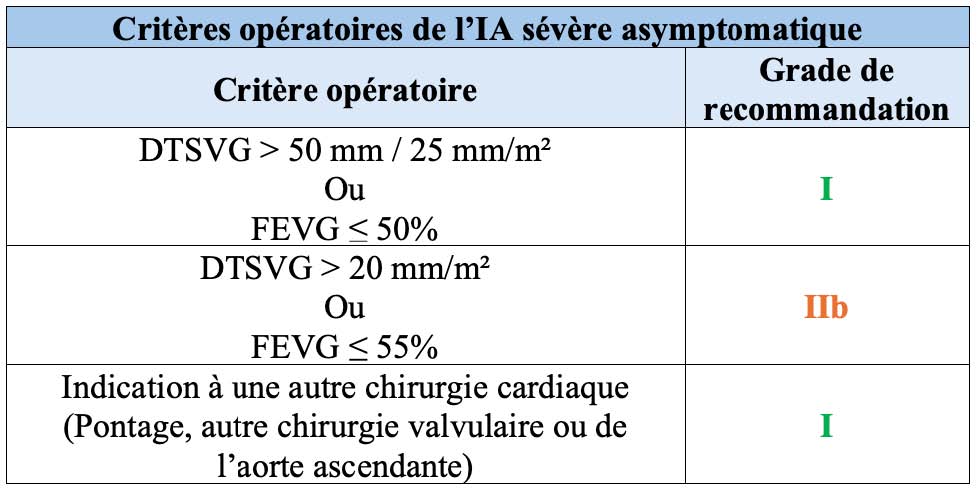
Tableau 3. Critères opératoires de l'IA sévère asymptomatique (ESC 2021) (17)
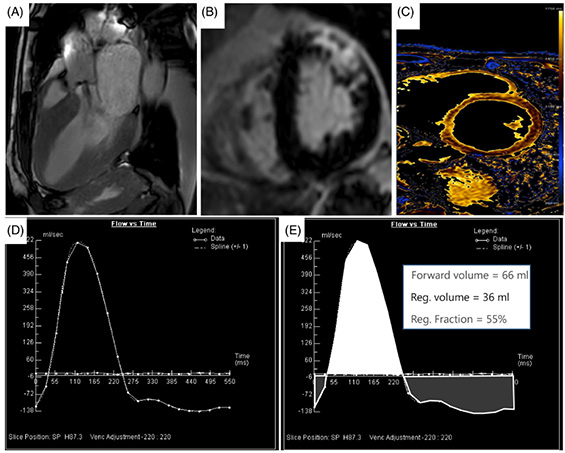
Figure 4. IRM d'une insuffisance aortique en vue 3 cavités (A), présence de rehaussement tardif au niveau de la paroi antérieure et antéro-latérale du ventricule gauche témoin de fibrose localisée (B), T1 mapping permettant l'évaluation de la fibrose diffuse (C) et courbes des flux antérogrades et rétrogrades au niveau de la valve aortique.
Évaluation de l'aorte
L'insuffisance aortique est fréquemment associée à une dilatation de l'aorte thoracique ascendante. Elle peut être idiopathique dans la maladie annulo-ectasiante, ou associée à une bicuspidie, ou encore correspondre à une pathologie du tissu élastique comme dans la maladie de Marfan.
Les diamètres aortiques doivent être mesurés systématiquement au cours de l'échocardiographie. Ils sont mesurés à différents niveaux : en systole pour l'anneau aortique puis en diastole pour les sinus de Valsalva, la jonction sinotubulaire, l'aorte tubulaire, la crosse aortique et l'isthme (la recherche d'une coarctation de l'isthme associée est systématique). Les mesures s'effectuent en échocardiographie de bord d'attaque à bord d'attaque.
L'imagerie en coupe permet une mesure plus précise des diamètres aortiques, le caractère asymétrique de l'aorte pouvant parfois entraîner une sous-estimation de celui-ci en échocardiographie. L'IRM et le scanner peuvent être tous les deux utilisés (20). L'IRM a l'avantage de ne pas être irradiante. On utilisera des séquences SSFP (Steadystate free precession) permettant une bonne différenciation entre les compartiments liquidiens et les tissus alentours et ainsi visualiser correctement la lumière aortique. Le scanner synchronisé au rythme cardiaque est irradiant mais permet des mesures plus précises que l'IRM du fait de son excellente résolution spatiale. Il faudra utiliser le mode double oblique pour s'aligner parfaitement avec l'aorte dans tous les plans. Les mesures sont réalisées en petit axe de fond de cusp à commissure ou de fond de cusp à fond de cusp (plus grand diamètres) (Figure 4). Le scanner permet également d'étudier l'anatomie de la valve aortique et de rechercher des lésions coronaires pour les patients éligibles à une intervention (Figure 5).
Il est actuellement recommandé de réaliser un remplacement de l'aorte ascendante en cas d'indication primaire de chirurgie valvulaire aortique lorsque le diamètre aortique est > 45 mm (17).
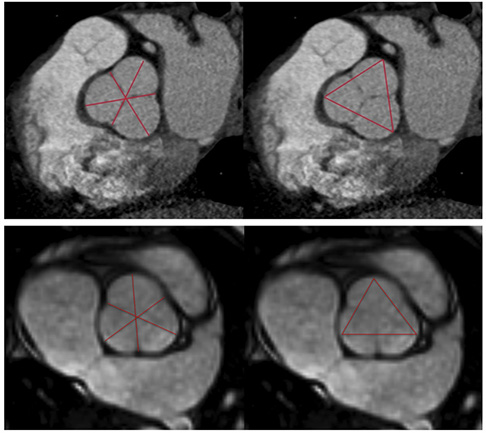
Figure 5 .
Mesure des diamètres des sinus de valsalva en scanner (haut) et en IRM (bas) de fond de cusp à commissure (gauche) et de fond de cusp à fond de cusp (droite).
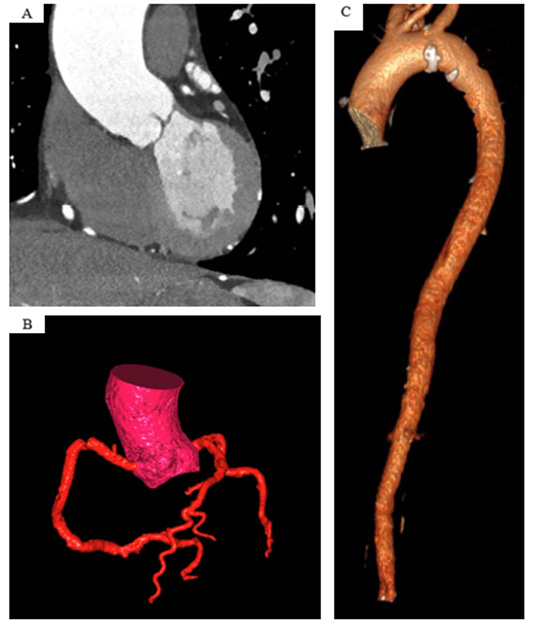
Figure 6.
Évaluation en scanner d'une aorte ascendante dilatée (A), reconstruction volumétrique du réseau coronaire (B) et de l'aorte thoracique (C).
En pratique
Si l'échocardiographie reste l'examen de première intention et de référence pour l'évaluation de l'insuffisance aortique, l'imagerie en coupe, et surtout l'IRM, apporte une complémentarité intéressante notamment dans les cas difficiles ou litigieux.
L'IRM cardiaque permet des mesures précises et reproductibles du volume régurgitant et de la fraction de régurgitation, des mesures précises de l'aorte thoracique, une évaluation de l'anatomie valvulaire ainsi que l'analyse du retentissement ventriculaire gauche.
Le scanner, grâce à sa meilleure résolution spatiale, permet l'évaluation des atteintes prothétiques et endocarditiques, notamment des abcès annulaires, ainsi que la recherche de pathologie aortique ou coronarienne associées.
Auteur

Julien HUDELO
CHU d'Amiens
Relecteur

Dr Yohann BOHBOT
CHU d'Amiens
Références
1. d'Arcy, Joanna L et al. “Large-scale community echocardiographic screening reveals a major burden of undiagnosed valvular heart disease in older people: the OxVALVE Population Cohort Study.” European heart journal vol. 37,47 (2016): 3515-3522. doi:10.1093/eurheartj/ehw229
2. Dujardin, K S et al. “Mortality and morbidity of aortic regurgitation in clinical practice. A long-term follow-up study.” Circulation vol. 99,14 (1999): 1851-7. doi:10.1161/01.cir.99.14.1851
3. Bernard, Samuel et al. “Acute valvular emergencies.” European heart journal. Acute cardiovascular care vol. 11,8 (2022): 653-665. doi:10.1093/ehjacc/ zuac086
4. Santangelo, Gloria et al. “The Global Burden of Valvular Heart Disease: From Clinical Epidemiology to Management.” Journal of clinical medicine vol. 12,6 2178. 10 Mar. 2023, doi:10.3390/jcm12062178
5. Khalique, Omar K et al. “Cardiac computed tomography in the contemporary evaluation of infective endocarditis.” Journal of cardiovascular computed tomography vol. 15,4 (2021): 304-312. doi:10.1016/j.jcct.2021.02.001
6. LaBounty, Troy M et al. “Evaluation of mechanical heart valve size and function with ECG-gated 64-MDCT.” AJR. American journal of roentgenology vol. 193,5 (2009): W389-96. doi:10.2214/AJR.08.2178
7. Lancellotti, Patrizio et al. “Multi-modality imaging assessment of native valvular regurgitation: an EACVI and ESC council of valvular heart disease position paper.” European heart journal. Cardiovascular Imaging vol. 23,5 (2022): e171-e232. doi:10.1093/ehjci/jeab253
8. Vermes, Emmanuelle et al. “Role of Cardiovascular Magnetic Resonance in Native Valvular Regurgitation: A Comprehensive Review of Protocols, Grading of Severity, and Prediction of Valve Surgery.” Frontiers in cardiovascular medicine vol. 9 881141. 7 Jul. 2022, doi:10.3389/fcvm.2022.881141
9. Crouch, Gareth et al. “Quantitative assessment of paravalvular régurgitation following transcatheter aortic valve replacement.” Journal of cardiovascular magnetic resonance : official journal of the Society for Cardiovascular Magnetic Resonance vol. 17,1 32. 8 May. 2015, doi:10.1186/s12968-015-0134-0
10. Cawley, Peter J et al. “Prospective comparison of valve regurgitation quantitation by cardiac magnetic resonance imaging and transthoracic echocardiography.” Circulation. Cardiovascular imaging vol. 6,1 (2013): 48-57. doi:10.1161/CIRCIMAGING.112.975623
11. Truedsson, Frida et al. “Importance of complex blood flow in the assessment of aortic regurgitation severity using phase contrast magnetic resonance imaging.” The international journal of cardiovascular imaging vol. 37,12 (2021): 3561-3572. doi:10.1007/s10554-021-02341-w
12. Guglielmo, Marco et al. “The Role of Cardiac Magnetic Resonance in Aortic Stenosis and Regurgitation.” Journal of cardiovascular development and disease vol. 9,4 108. 4 Apr. 2022, doi:10.3390/jcdd9040108
13. Chelu, Raluca G et al. “Qualitative grading of aortic regurgitation: a pilot study comparing CMR 4D flow and echocardiography.” The international journal of cardiovascular imaging vol. 32,2 (2016): 301-307. doi:10.1007/s10554-015-0779-7
14. Bolen, Michael A et al. “Cardiac MR assessment of aortic regurgitation: holodiastolic flow reversal in the descending aorta helps stratify severity.” Radiology vol. 260,1 (2011): 98-104. doi:10.1148/radiol.11102064
15. Kammerlander, Andreas A et al. “Diagnostic and Prognostic Utility of Cardiac Magnetic Resonance Imaging in Aortic Regurgitation.” JACC. Cardiovascular imaging vol. 12,8 Pt 1 (2019): 1474-1483. doi:10.1016/j.jcmg.2018.08.036
16. Yang, Li-Tan et al. “Automated Global Longitudinal Strain Exhibits a Robust Association with Death in Asymptomatic Chronic Aortic Regurgitation.” Journal of the American Society of Echocardiography : official publication of the American Society of Echocardiography vol. 35,7 (2022): 692-702.e8. doi:10.1016/j.echo.2021.10.018
17. Vahanian, Alec et al. “2021 ESC/EACTS Guidelines for the management of valvular heart disease.” European heart journal vol. 43,7 (2022): 561-632. doi:10.1093/eurheartj/ehab395
18. Myerson, Saul G et al. “Aortic regurgitation quantification using cardiovascular magnetic resonance: association with clinical outcome.” Circulation vol. 126,12 (2012): 1452-60. doi:10.1161/CIRCULATIONAHA.111.083600
19. Senapati, Alpana et al. “Regional Replacement and Diffuse Interstitial Fibrosis in Aortic Regurgitation: Prognostic Implications From Cardiac Magnetic Resonance.” JACC. Cardiovascular imaging vol. 14,11 (2021): 2170-2182. doi:10.1016/j.jcmg.2021.04.028
20. Groth, M et al. “Accuracy of thoracic aortic measurements assessed by contrast enhanced and unenhanced magnetic resonance imaging.” European journal of radiology vol. 81,4 (2012): 762-6. doi:10.1016/j. ejrad.2011.01.071

