Les immunodéprimés sont un ensemble très hétérogène de patients exposés à un risque infectieux dépendant du type d'immunodépression. Les patients d'hématologie sont particulièrement vulnérables aux infections graves, notamment fongiques, dont le poumon est la cible principale, pouvant engager le pronostic vital.
Les facteurs d'immunodépression associés aux infections fongiques invasives sont : la neutropénie profonde (inférieure à 500/mm3) et prolongée, l'allogreffe de cellules souches hématopoïétiques, le diabète, la corticothérapie prolongée...
Parmi les infections fongiques, Aspergillus est le plus fréquemment en cause, toutefois les mucorales sont en progression et associées à une morbi-mortalité importante. Le diagnostic précoce, notamment par le dépistage en biologie moléculaire, est donc primordial dans les populations à risque afin de débuter un traitement antifongique précoce, adapté et améliorer le pronostic.
La mucormycose est une infection fongique invasive, rare mais extrêmement agressive, touchant souvent les patients immunodéprimés à risque. Les mucorales, champignons saprophytes présents dans l'environnement, particulièrement dans les sols, appartiennent aux zygomycètes (champignons à filaments larges non cloisonnés).
La contamination se fait généralement par inhalation de spores, menant à des infections respiratoires ou ORL. Les formes cliniques de mucormycose les plus fréquentes sont l'atteinte rhino-orbito-cérébrale, l'atteinte pulmonaire, et plus rarement, des atteintes cutanées en cas de traumatisme délabrant. L'évolution rapide et agressive de ces infections confère un pronostic sombre en cas de dissémination. Un diagnostic précoce est donc crucial, reposant sur des signes cliniques, biologiques et radiologiques.
La prise en charge est multiple principalement basée sur la restauration de l'immunité, le traitement antifongique et une potentielle discussion chirurgicale. Le pneumologue se doit donc de connaître cette pathologie comme l'illustre notre observation.
Description du cas
M. J, 58 ans, pris en charge pour une leucémie aiguë myéloïde (FAB 0) découverte fortuitement devant une bicytopénie. Ses antécédents médicaux notables incluent une hypertension artérielle traitée par monothérapie et un ulcère de l'estomac. Il ne rapporte pas d'antécédents familiaux significatifs.
Il bénéficie d'un traitement d'induction par Daunorubicine-Aracytine (3+7). À J10 de l'induction, le patient présente un premier épisode d'aplasie fébrile, initialement sans point d'appel clinique traitée par une antibiothérapie large spectre par Pipéracilline-Tazobactam de 1ère ligne selon les recommandations de l'ECIL-4 (1).
À J24, il présente une dyspnée fébrile avec oxygénorequérance à 4l/min.
Dans ce contexte, de nouveaux prélèvements infectieux sont effectués ainsi qu'un scanner thoraco-abdomino pelvien.
Le scanner thoracique (figure 1) ne retrouve que quelques plages de condensation lobaire supérieure droit antérieure et lobaire moyen, et lobaire inférieur gauche associées à des micronodules centrolobulaires et du verre dépoli. Par ailleurs, il n'y pas d'anomalie au niveau des sinus et abdominopelvien.
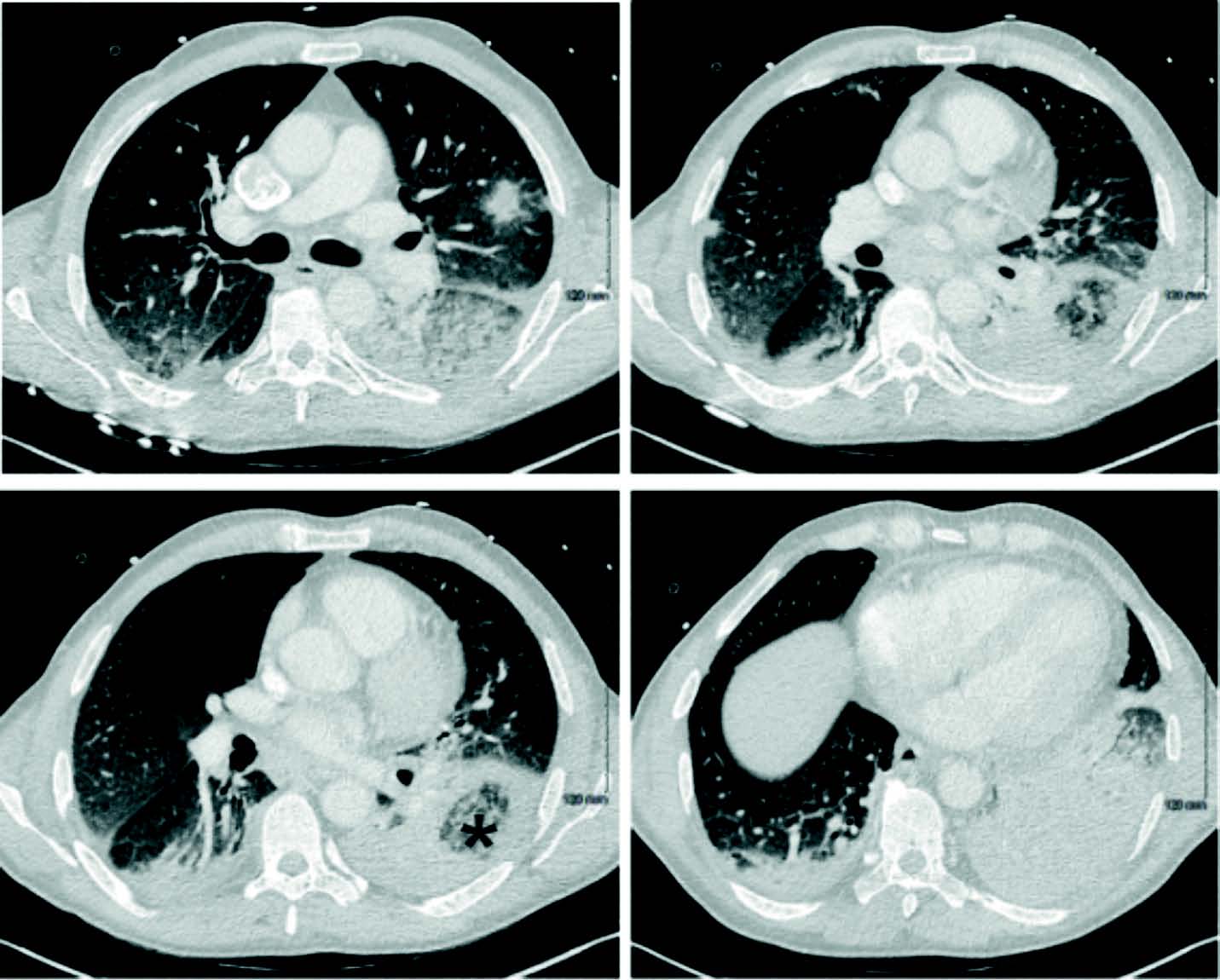
Figure 1. Scanner thoracique à J24 d'aplasie
Les nouveaux prélèvements microbiologiques reviennent négatifs. Dans ce contexte, en accord avec les recommandations de l'ECIL (1-2), l'antibiothérapie est complétée avec ajout de vancomycine.
À J40, l'état respiratoire du patient continue de s'aggraver avec une majoration de l'oxygénoréquerance jusqu'à 12L ainsi que l'apparition de crachats hémoptoïques motivant la réalisation d'un nouveau scanner crobiologiques reviennent négatifs. Dans ce contexte, en accord avec les recommandations de l'ECIL (1-2), l'antibiothérapie est complétée avec ajout de vancomycine.
À J40, l'état respiratoire du patient continue de s'aggraver avec une majoration de l'oxygénoréquerance jusqu'à 12L ainsi que l'apparition de crachats hémoptoïques motivant la réalisation d'un nouveau scanner thoracique (figure 2) révélant l'apparition d'une condensation circulaire avec du verre dépoli en son centre au niveau du lobe inférieur gauche décrivant le signe du halo inversé ou signe de l'atoll 1.
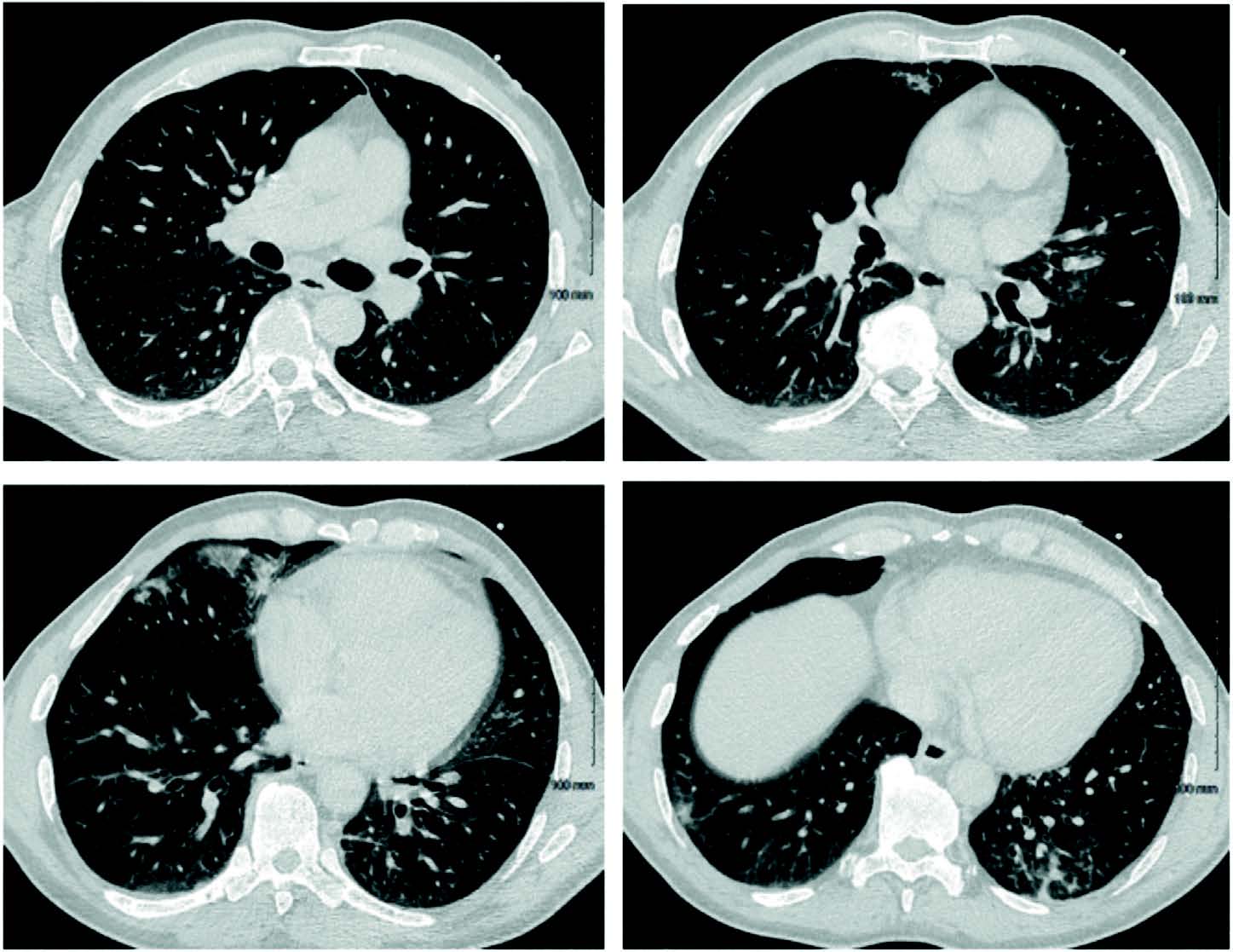
Figure 2. Coupes transversales du scanner thoracique à J40.
Le signe du halo inversé se caractérise par la présence d'une opacité en verre dépoli au centre, entourée par une condensation périphérique. Ce signe doit amener à envisager plusieurs diagnostics possibles selon le statut immunitaire : pneumonie organisée, granulomatose avec polyangéite ou infarctus pulmonaire si immunocompétent, une mycose pulmonaire invasive si immunodépression (3-5).
Dans notre cas, les prélèvements endoscopiques sont impossible du fait de la mécanique respiratoire défaillante, mais le diagnostic d'infection fongique invasive probable est posé devant le terrain à risque, le scanner très évocateur et confirmé par la positivité de la PCR mucorale sanguine.
Point focus diagnostic mucormycosis
Le diagnostic de la mucormycose repose principalement sur la mise en évidence du champignon dans les tissus. Il existe plusieurs méthodes (6) :
• Examen microscopique direct, culture et/ou histopathologie où on retrouve à l'examen direct, des filaments larges (6 à 25 µm), rubanés, peu ou pas septés (différent d'Aspergillus qui présente des filaments plus fins et septés).
• Culture : La croissance du champignon peut prendre entre 1 à 7 jours, mais la sensibilité est faible (seulement environ 50 %), rendant cette méthode souvent peu fi able. De plus, les prélèvements ne sont pas toujours réalisables chez les patients.
• Techniques de biologie moléculaire : La PCR permet un diagnostic plus rapide et plus précis avec une sensibilité et une spécificité élevées. La PCR Mucorales peut être effectuée sur des échantillons de sang ou de liquides comme le LBA (lavage broncho-alvéolaire).
Marqueurs sériques : Contrairement à l'aspergillose, les tests de détection de ?-D glucane et de galactomannane ne sont pas utiles pour diagnostiquer une mucormycose, car ils ne sont pas détectés dans le sérum en cas d'infection par les mucorales.
Le traitement de la mucormycose repose sur l'indispensable restauration de l'immunité, un traitement antifongique (tableau 1 et 2) plus ou moins associé à discussion multidisciplinaire de l'indication d'une prise en charge chirurgicale. Dans notre cas, la chirurgie n'était pas envisageable lors de sa prise en charge initiale devant la gravité respiratoire et l'aplasie profonde (7).
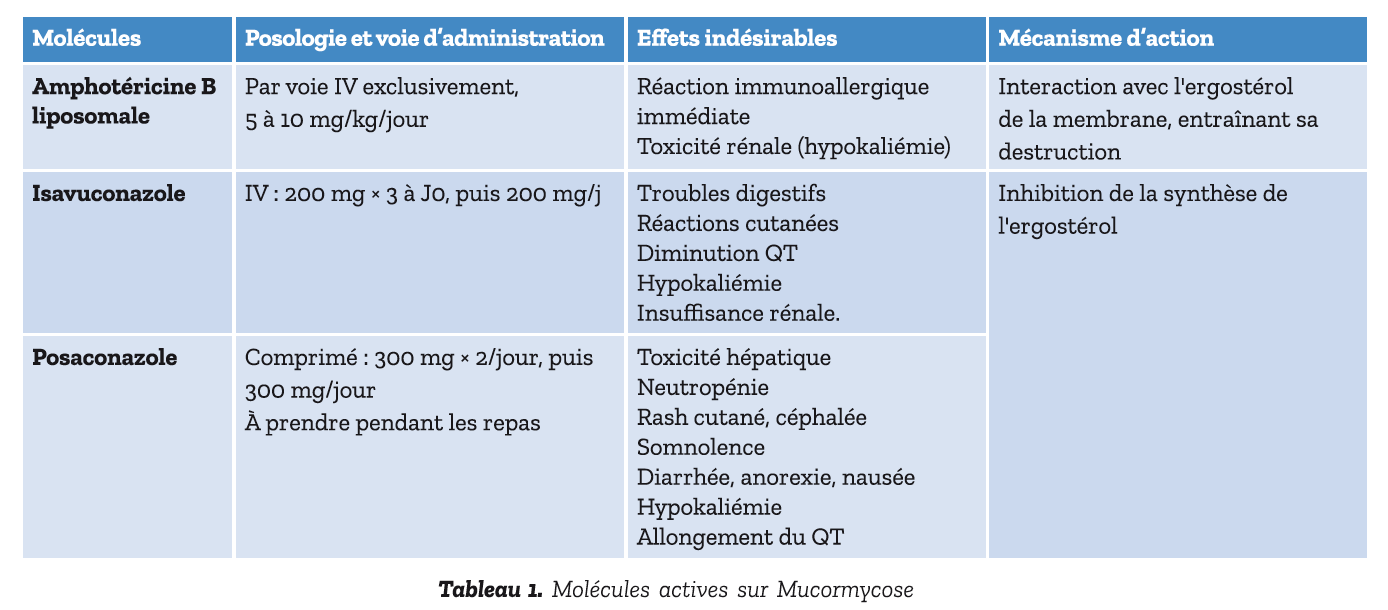
Le traitement de 1ère ligne (tableau 1) recommandé repose sur le traitement par Amphotéricine B liposomale à forte dose entre 5 et 10mg/kg/j en perfusion. Les mucormycoses possèdent une résistance naturelle au voriconazole.
L'amphotéricine B liposomale est formulé sous une forme liposomale ce qui permet de réduire la toxicité, notamment rénale, du médicament. Cela permet également d'améliorer la tolérance, mais des effets indésirables immédiats, comme des éruptions cutanées et des vomissements peuvent survenir.
Le mécanisme d'action repose sur l'interaction avec l'ergostérol, un composant clé de la membrane des champignons. La durée du traitement dépend de la gravité, de la possibilité de restauration de l'immunité et de la réponse thérapeutique.
La toxicité potentielle est essentiellement rénale avec une tubulopathie responsable d'une hypokaliémie. En cas de mauvaise tolérance ou d'indisponibilité de l'amphotéricine B liposomale, les traitements de sauvetage de 2ème ligne (tableau 1) incluent l'isavuconazole ou le posaconazole.
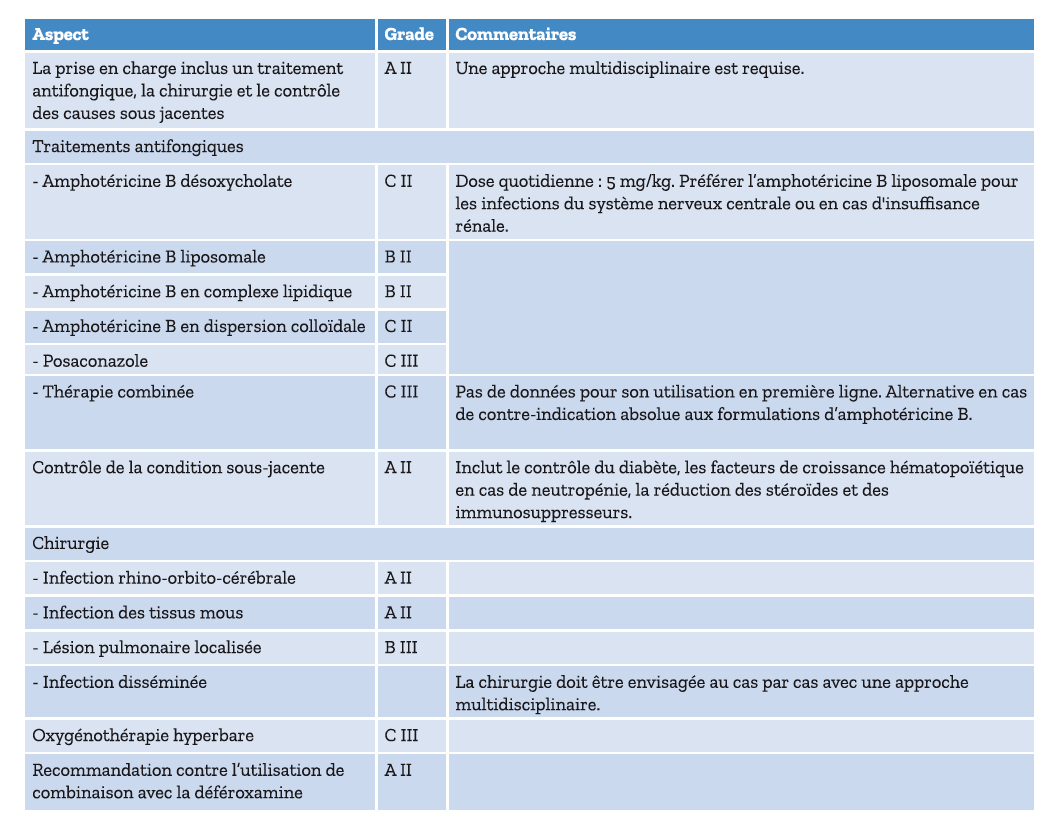
Légende : Grade A = bonnes preuves pour soutenir une recommandation d'utilisation, grade B = preuves modérées pour soutenir une recommandation d'utilisation, grade C = preuves faibles pour soutenir une recommandation d'utilisation, grade D = omission, grade E= omission. Qualité des preuves : I = Preuves issues d'au moins un essai clinique randomisé et contrôlé, II = preuves issues d'au moins une étude clinique bien conçue, sans randomisation ; ou d'études de cohortes ou cas-témoins ; ou d'analyses temporelles multiples ; ou résultats spectaculaires d'expériences non contrôlées, III = preuves issues des avis d'experts reconnus, basées sur l'expérience clinique, des études descriptives ou des rapports de comités d'experts.
Tableau 2. Adapté d'après les recommandations (ECIL-6) selon le niveau de preuve.
Après 5 jours de traitement, devant l'absence d'amélioration, du posaconazole est ajouté en bithérapie. L'évolution clinique est rapidement favorable (apyrexie, sevrage en O2...) pas tant lié au traitement antifongique que par la restauration immunitaire et la sortie d'aplasie (restauration de la lignée granuleuse non blastique).
L'évolution favorable avec une nette amélioration scanographique, une négativation persistante de la PCR mucorale et une rémission hématologique qui a permis de réaliser une allogreffe de cellules souches hématopoïétiques (ACSH) sous couvert de la bithérapie antifongique.
Le traitement antifongique a été poursuivi jusqu'à arrêt des traitement immunosuppresseurs à 6 mois post ACSH puis relayée en monothérapie par du posaconazole à dose curative.
À noter que les recommandations sur la durée des traitements ne sont actuellement pas codifiées et dépendent de l'évolution clinique du patient.
À 18 mois de l'épisode aiguë, le patient est en rémission hématologique, en excellent état général (PS 0), et asymptomatique sur le plan respiratoire ; seule persiste une séquelle excavée lobaire inférieure gauche et un nodule sous-pleural lobaire supérieur gauche non évolutif (figure 3) et non métabolique en 18FDG TEP-TDM.
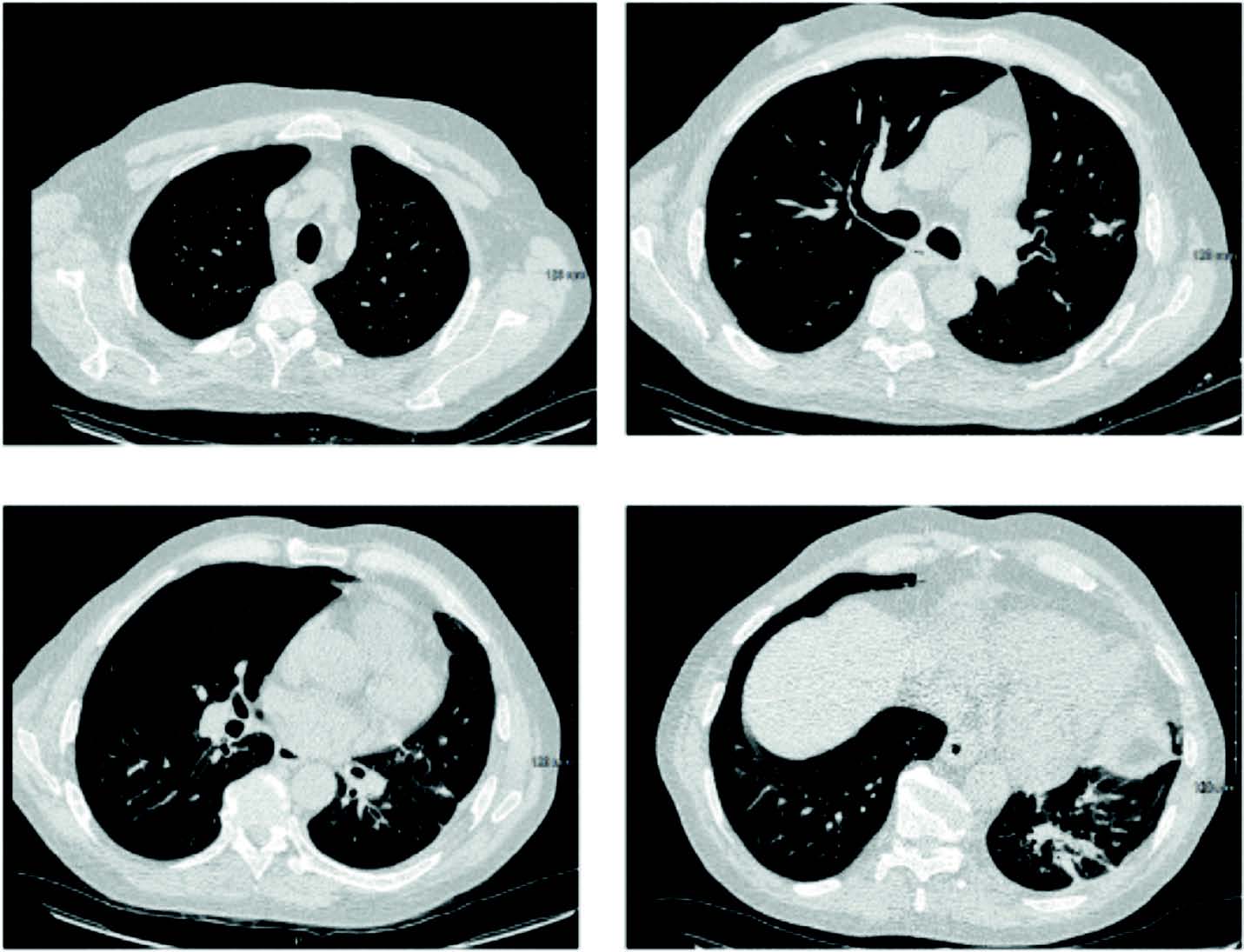
Figure 3. Scanner thoracique après 2 ans de traitement
Pour notre patient, la question en suspens est la place de la chirurgie des lésions résiduelles notamment dans la perspective d'un éventuel traitement immunosuppresseur en cas de réaction du greff on contre l'hôte chronique (c-GVHD). La chirurgie reste à l'état de discussion devant l'absence d'immunosuppresseur, la non évolutivité scanographique sans activité métabolique en TEP chez un patient asymptomatique mais ces lésions incitent la poursuite du posaconazole en monothérapie compte tenu de l'immunosuppression post ACSH.
Voici ci-contre les recommandations de la prise d'une mucormycose (8) incluant la chirurgie.
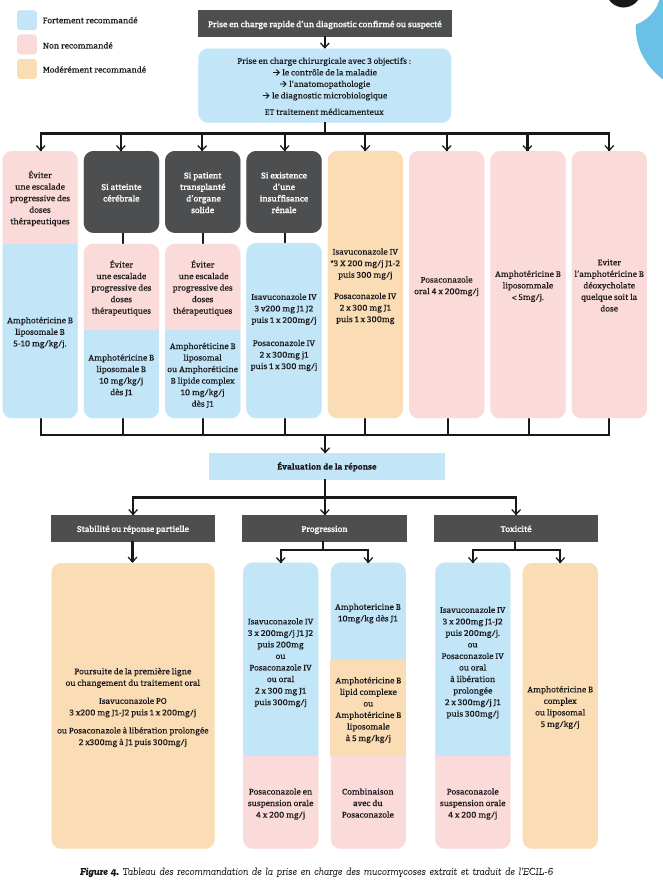
Pour conclure sur le black fungus et les principaux take home messages :
• Il s'agit d'une pathologie rare mais grave qui impose un diagnostic le plus précoce possible.
• Le poumon en est la cible principale.
• Les pneumologues se doivent de reconnaître cette pathologie.
• Il est important d'évoquer les infections fongiques invasives lors d'immunodépression profonde et en particulier lorsque le signe échographique du halo inversé est présent.
• Chez l'immunodéprimé le signe du halo inversé est quasiment pathognomonique d'une infection à mucormycose.
• Les diagnostics d'infections fongiques invasives sont facilités depuis peu par l'apparition de la biologie moléculaire avec des PCR sanguine permettant un diagnostic rapides et non invasif.
• Intérêt de discussion thérapeutique pluridisciplinaire composite avec comme principaux objectifs une restauration de l'immunité, un traitement antifongique voire une chirurgie.

Anaïs CONRAZIER
Interne DES pneumologie
Relecture
Rivière FRÉDÉRIC
M.D, PhD, Praticien hospitalier
Service de Pneumologie
CHU Côte de Nacre Caen
Bibliographie
1. Averbuch D, Orasch C, Cordonnier C, Livermore DM, Mikulska M, Viscoli C, et al. European guidelines for empirical antibacterial therapy for febrile neutropenic patients in the era of growing resistance: summary of the 2011 4th European Conference on Infections in Leukemia. Lancet Infect Dis. 2013;13(6).
2. Azoulay E, Russell L, Van de Louw A, Metaxa V, Bauer P, Povoa P, Montero JG, Loeches IM, Mehta S, Puxty K, Schellongowski P, Rello J, Mokart D, Lemiale V, Mirouse A; Nine-i Investigators. Diagnosis of severe respiratory infections in immunocompromised patients. Intensive Care Med. 2020;46(2):298-314. doi: 10.1007/s00134-019-05906-5.
3. Jain A. For Whom the Atoll Tolls: Targeting the Reversed Halo Sign.
4. Legouge C, Caillot D, Chrétien M-L, Lafon I, Ferrant E, Audia S, Pagès P-B, Roques M, Estivalet L, Martin L, Maitre T, Bastie J-N, Dalle F. The Reversed Halo Sign: Pathognomonic Pattern of Pulmonary Mucormycosis in Leukemic Patients With Neutropenia?
5. Lederlin M, Boussouar S, De Margerie Mellon C. Imagerie des Pneumopathies Interstitielles Diff uses : Elsevier masson ; 2023.
6. Jeong W, Keighley C, Wolfe R, Lee WL, Slavin MA, Kong DCM, Chen SCA. The epidemiology and clinical manifestations of mucormycosis: a systematic review and meta-analysis of case reports.
7. Tissot F, Agrawal S, Pagano L, Petrikkos G, Groll AH, Skiada A, Lass-Flörl C, Calandra T, Viscoli C, Herbrecht R. ECIL-6 guidelines for the treatment of invasive candidiasis, aspergillosis and mucormycosis in leukemia and hematopoietic stem cell transplant patients. Haematologica. 2017;102(3):433-444. doi: 10.3324/haematol.2016.152900.
8. Cornely OA, Alastruey-Izquierdo A, Arenz D, Chen SCA, Dannaoui E, ochhegger B, Hoenigl M, Jensen HE, Lagrou K, Lewis RE, Mellinghoff SC, Mer M, Pana ZD, Seidel D, Sheppard DC, Wahba R, Akova M, Alanio A, Al-Hatmi AMS, Arikan- Akdagli S, Chakrabarti A. Global guideline for the diagnosis and management of mucormycosis: an initiative of the European Confederation of Medical Mycology in cooperation with the Mycoses Study Group Education and Research Consortium.

