
L'asthme touche environ 365 millions de personnes dans le monde, avec une prévalence estimée à 6% (4 millions) en France. Il est associé à plus de 60 000 hospitalisations et à près de 900 décès par an, principalement parmi les adultes de plus de 55 ans (1, 2). Selon le GINA, l'asthme est une pathologie respiratoire chronique hétérogène secondaire à une inflammation des bronches. Cette hétérogénéité concerne la présentation clinique, menant à l'identification de phénotypes variés, mais aussi le type d'inflammation locale induits par divers mécanismes (endotypes) (3).
Comment poser le diagnostic d'un asthme sévère ?
Il est défini par l'ERS/ATS par un asthme qui nécessite (4) :
• L'utilisation de fortes doses de corticoïdes inhalés (1000 µg d'équivalent fluticasone) ;
• Plus un autre traitement de fond ;
• ET/OU le recours aux corticoïdes oraux supérieure 6 mois/an ;
• Pour maintenir le contrôle de l'asthme ; OU Si la pathologie demeure incontrôlée malgré l'utilisation de traitements appropriés.
Selon cette définition, on ne parlera d'asthme sévère qu'après un suivi minimal de 6 mois. Avant d'évoquer ce diagnostic, on s'évertuera à distinguer un asthme difficile d'un asthme sévère. Ainsi, il est nécessaire de suivre rigoureusement les étapes suivantes :
1. Revérifier le diagnostic d'asthme et éliminer les diagnostics différentiels (syndrome d'hyperventilation, dysfonction des cordes vocales…). 30 % des patients référés pour un asthme sévère n'ont pas d'asthme.
2. Il faudra donc s'assurer de l'absence de facteurs modifiables pouvant contribuer au mauvais contrôle de l'asthme (comorbidité, tabagisme, observance, éducation thérapeutique…).
3. Optimiser la prise en charge autant que possible (en agissant sur les facteurs modifiables par exemple : posologie insuffisante ? Technique de prise ? Mésusage ? …).
La progression des connaissances physiopathologiques a permis l'identification de phénotypes et d'endotypes de plus en plus précis de l'asthme sévère. Une fois le diagnostic d'asthme sévère posé, il convient de préciser ses caractéristiques phénotypiques. Il s'agit d'une étape primordiale pour orienter la prise en charge thérapeutique et peut-être, proposer la prescription d'une biothérapie.
Quelles sont les principales comorbidités à chercher chez un asthmatique sévère ?
• Syndrome d'hyperventilation.
• Rhinosinusite avec ou sans polypose.
• Rhinoconjonctivite allergique.
• Dysfonction des cordes vocales.
• Syndrome d'apnée obstructive du sommeil (SAOS).
• Reflux gastro-œsophagien.
• Urticaire / dermatite atopique.
• Œsophagite à œsinophiles.
• Dilatation des bronches (DDB).
• Aspergillose broncho-pulmonaire allergique (ABPA).
• Granulomatose à éosinophile avec polyangéite (EGPA).
• Anxiété/dépression.
Comment phénotyper un asthme sévère ?
Dans un premier temps, on phénotypera l'asthme sévère en distinguant les asthmes dont l'inflammation présente des caractéristiques de type T2 (ou T2 high) de ceux n'en ayant pas (T2 low).
1. Le groupe T2 high, le plus fréquent et le mieux connu. Il se caractérise par une augmentation des éosinophiles sanguins et des voies aériennes et/ou de la Fraction Exhalée de monoxyde d'azote (FeNO), et éventuellement des IgE totales ou une démonstration d'atopie.
Étant des biomarqueurs très variables, il est conseillé de multiplier le dosage de l'éosinophilie et de la FeNO pour affirmer et ne pas ignorer un phénotype T2 high, car il représente environ 85 à 90 % des patients asthmatiques. Nos confrères anglais ont même considéré que la présence d'un biomarqueur de type 2 élevé concourrait au diagnostic d'asthme, ce qui n'a pas été conservé par le GINA ni par les recommandations françaises actuelles.
2. Le groupe T2 low, comprend des patients asthmatiques exprimant peu (ou pas) les caractéristiques précédentes. Il s'agit plutôt d'une inflammation neutrophilique moins corticosensible, dans un contexte plus souvent (mais pas nécessairement) de tabagisme, d'exposition à des polluants inhalés et/ou d'obésité (5).
Qu'est-ce qu'une biothérapie ?
Une biothérapie est une molécule produite à partir d'une cellule ou d'un organisme vivant. Il s'agit d'une protéine recombinante qui correspond à un anticorps monoclonal pour les biothérapies utilisées dans l'asthme sévère.
L'indication d'une biothérapie et son choix doivent être discutés de façon collégiale en Réunion de Concertation d'Asthme. Il s'agit de traitements innovants et coûteux ce qui implique des modalités de prescription et de suivi stricts. De plus en plus, vues leurs multiples indications et AMM, ces réunions sont en pratique pluridisciplinaires (6).
À qui peut-on proposer une biothérapie ?
Les biothérapies ne peuvent être envisagées que chez des patients présentant un asthme sévère selon la définition ATS/ERS et restant non contrôlé malgré un traitement inhalé maximal bien conduit. Leur efficacité est surtout démontrée pour la réduction des exacerbations ou la réduction de la dose de corticothérapie orale au long cours moins évidente sur l'amélioration du contrôle des symptômes ou de la fonction. À ce jour, la majorité des biothérapies concernent les patients asthmatiques T2 high, cependant, le Tézépélumab peut être proposé aux patients T2 low (7).
Quelles sont les biothérapies disponibles en France ?
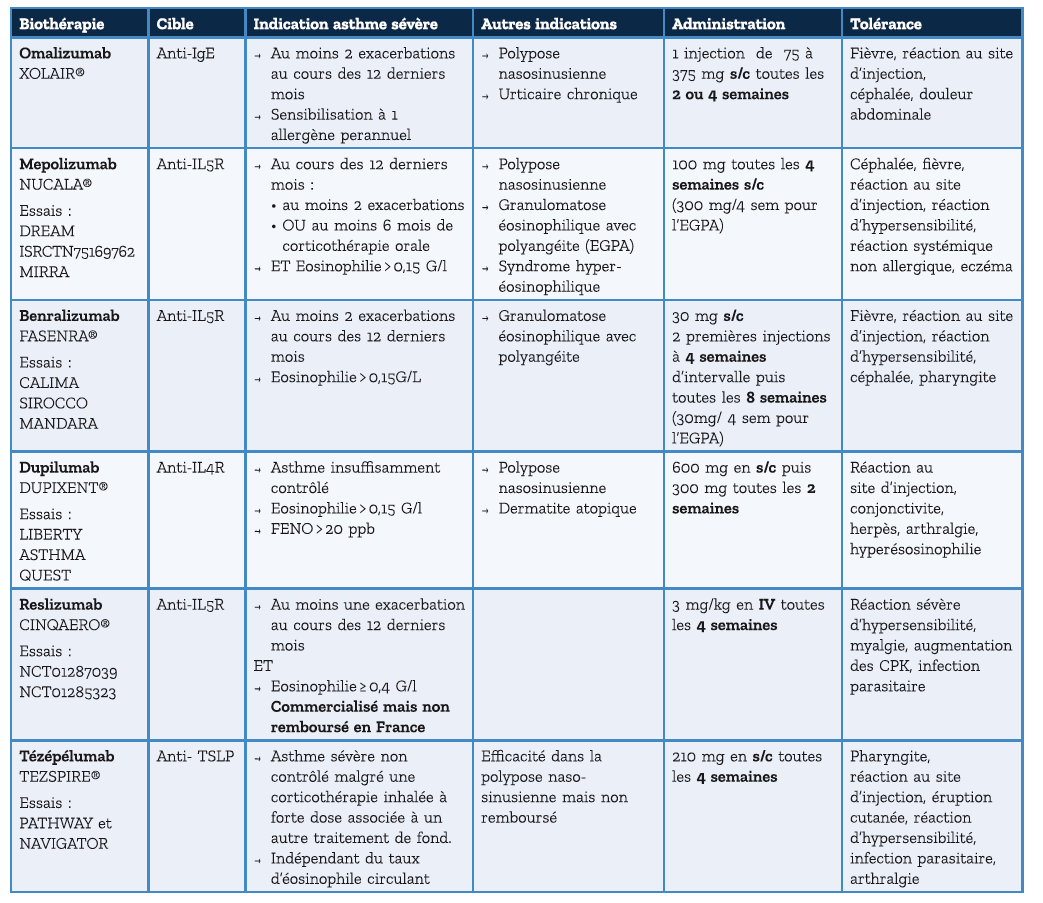
Et chez l'enfant et la femme enceinte ?
L'omalizumab, le mépolizumab et le dupilumab peuvent être prescrits chez l'enfant à partir de l'âge de 6 ans. Le tézépélumab et le benralizumab ne sont indiqués qu'à partir de 12 ans.
Par ailleurs, une conférence de consensus récente suggère le maintien et la possibilité d'initiation des biothérapies pendant la grossesse et la période d'allaitement (8).
Qui peut prescrire une biothérapie pour un asthmatique sévère ?

Quelle est la durée de traitement ?
Les objectifs, les critères d'échec et la durée de traitement doivent être discutés avant de débuter le traitement et à chaque modification thérapeutique. Si les objectifs ne sont pas atteints après 4 à 6 mois au moins de traitement bien conduit et en l'absence de facteurs modifiables majeurs, la biothérapie doit être arrêtée et éventuellement remplacée.

Dr Aïda Blondin DIOP
Docteur Junior
CHU de Montpellier
Relecture
Pr Arnaud BOURDIN PUPH,
CHU de Montpellier
Dr Merouane MESSEKHER
PH chargé d'enseignement
CHU de Montpellier
Références
1. Asthme · Inserm, La science pour la santé Inserm
2. Bousquet J, Mantzouranis E, Cruz AA, et al. Uniform definition of asthma severity, control, and exacerbations: World Health Organization Consultation on Severe Asthma. Journal of Allergy and Clinical Immunology 2010; 126: 926–938.
3. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2024
4. Global Initiative for Asthma. Difficult-To-Treat & Severe Asthma in Adolescent and Adult Patients, v5.0, 2024.
5. Schoettler N, Strek ME. Recent Advances in Severe Asthma: From Phenotypes to Personalized Medicine. Chest 2020; 157: 516–528.
6. Guilleminault L, Didier A. L'asthme sévère à l'ère des biothérapies. La Presse Médicale 2019; 48: 310–321.
7. Brusselle GG, Koppelman GH. Biologic Therapies for Severe Asthma. New England Journal of Medicine Massachusetts Medical Society; 2022; 386: 157–171.
8. Naftel J, Jackson DJ, Coleman M, et al. An international consensus on the use of asthma biologics in pregnancy. Lancet Respir Med 2024; : S2213-2600(24)00174-7.

