
Pour la deuxième année consécutive, l'AJCV, aux côtés de l'AGOF et de l'AFUF, a mis en oeuvre les Journées d'Anatomie et de Robotique Chirurgicale inter-Associatives. Cette deuxième édition s'est déroulée au Laboratoire d'Anatomie Côte d'Azur, au sein de la Faculté de Médecine de Nice. L'un des thèmes abordés concernait les lymphatiques de l'abdomen et les curages correspondants, qui peuvent être effectués par les chirurgiens digestifs, gynécologues et urologues. Comme lors du premier numéro du DIGEST'TIMES, nous souhaitons faire le point sur cette thématique en reproduisant les méthodes pédagogiques utilisées au sein du Collège Médical français des Professeurs d'Anatomie. Si vous avez manqué cette session, nous vous invitons à revoir le replay sur le site dédié sans attendre.
Lien des journées JARCA #2 : https://agof.fmcevent.com/fr
Introduction
La connaissance approfondie du système lymphatique abdominal est essentielle pour la pratique chirurgicale, notamment en oncologie. Les voies de drainage lymphatique jouent en effet un rôle clé dans la dissémination tumorale, ce qui justifie la réalisation de curages ganglionnaires adaptés en fonction de la pathologie traitée.
La compréhension détaillée de ces réseaux permet d'optimiser les stratégies chirurgicales, en minimisant les complications peropératoires et en améliorant les résultats oncologiques à long terme.
Lors de la deuxième édition des Journées d'Anatomie et de Robotique Chirurgicale inter-Associatives (JARCA #2), l'étude des lymphatiques de l'abdomen a été mise en avant, offrant une occasion unique de revoir et d'approfondir les connaissances anatomiques sur le sujet. Cet article se propose de faire le point sur l'anatomie générale du système lymphatique abdominal, ses principales voies de drainage ainsi que leurs implications chirurgicales.
Anatomie générale du système lymphatique
La lymphe est un ultra-filtrat du plasma sanguin contenant des lymphocytes, indispensables au bon fonctionnement du système immunitaire (1). Elle naît dans le tissu conjonctif interstitiel sous le nom de lymphe interstitielle, puis chemine dans les vaisseaux lymphatiques où elle devient lymphe vasculaire avant de rejoindre les lympho-noeuds (anciennement appelés ganglions lymphatiques), et être ainsi logiquement dénommée lymphoganglionnaire. Les lympho-nœuds peuvent s'hypertrophier en réponse à une infection ou une pathologie tumorale, et possèdent une vascularisation propre, source de saignements peropératoires lors de leur dissection. Les phénomènes immunitaires de lutte contre l'invasion tumorale ont lieu dans ces différents territoires lymphatiques.
Au niveau de la cavité abdominale, il faut distinguer la lymphe abdominale qui suit les axes vasculaires du rétropéritoine (détaillée ci-dessous) de la lymphe intestinale, qui circule dans les mésos du tube digestif.
La lymphe intestinale joue un rôle particulier. En plus de son rôle dans l'immunité, elle transporte les lipides absorbés par l'intestin grêle au décours immédiat d'une prise alimentaire.
Les vaisseaux lymphatiques, normalement invisibles, deviennent alors blanchâtres en raison de leur charge en lipide et deviennent parfaitement identifiables (par exemple lorsque l'on opère un patient en période post-prandiale immédiate). Ce phénomène conduisait les anciens à dénommer ce système vasculaire lymphatique le réseau des vaisseaux « lactés » en raison de la ressemblance entre la lymphe chargée en lipide et le lait (la « grande veine lactée d'Asseli » est l'ancienne dénomianion du conduit lymphatique thoracique).
En résumé, on distingue donc quatre types de lymphe selon leur localisation et leur fonction (Figure 1) : lymphe interstitielle, lymphe vasculaire, lymphe ganglionnaire et lymphe intestinale.
Le système lymphatique abdominal prend naissance au niveau des racines des cuisses, où il se dispose initialement en périphérie du réseau veineux (veine fémorale profonde au-dessous du ligament inguinal).
Plus haut, il adopte une disposition périphérique en se réprochant des axes artériels, en particulier l'aorte abdominale et ses branches. Avant d'atteindre le thorax, les vaisseaux lymphatiques convergent vers la citerne du chyle (de Pecquet), située classiquement en arrière de l'aorte thoraco-abdominale en regard de la 12ème vertèbre thoracique, pour former le conduit thoracique lymphatique.
Ce dernier, se jette dans la circulation sanguine à hauteur de la veine cave supérieure ou du confluent jugulo-sous-clavier gauche.

Le laboratoire d'Anatomie de la Côte d'Azur (anciennement Laboratoire d'Anatomie Normale de la Faculté de Médecine de Nice) existe depuis 50 ans. Actuellement dirigé par les professeurs Baqué et Bronsard, il est équipé d'un matériel technologique multimédia très performant. Cela a permis une présence importante sur Internet, avec plus de 36 500 abonnés sur sa chaîne YouTube (@NiceAnatomie), et plusieurs millions de vues des différents films autour de l'anatomie clinique ou chirurgicale, films produits par les enseignants et les élèves. Par ailleurs, ces systèmes ont permis de faire évoluer les méthodes d'enseignement de l'anatomie à la faculté de médecine de Nice. Ainsi, des leçons d'anatomie traditionnelles au tableau noir à la craie (tradition maintenue par le Collège Médical Français des Professeurs d'Anatomie) sont pratiquées, leçons qui sont couplées en direct à des dissections sur cadavre commentées. Le laboratoire est aussi souvent mis à contribution lors de congrès régionaux, nationaux ou même internationaux grâce à la technologie installée permettant un enseignement à distance en haute définition.
https://www.youtube.com/user/niceanatomie
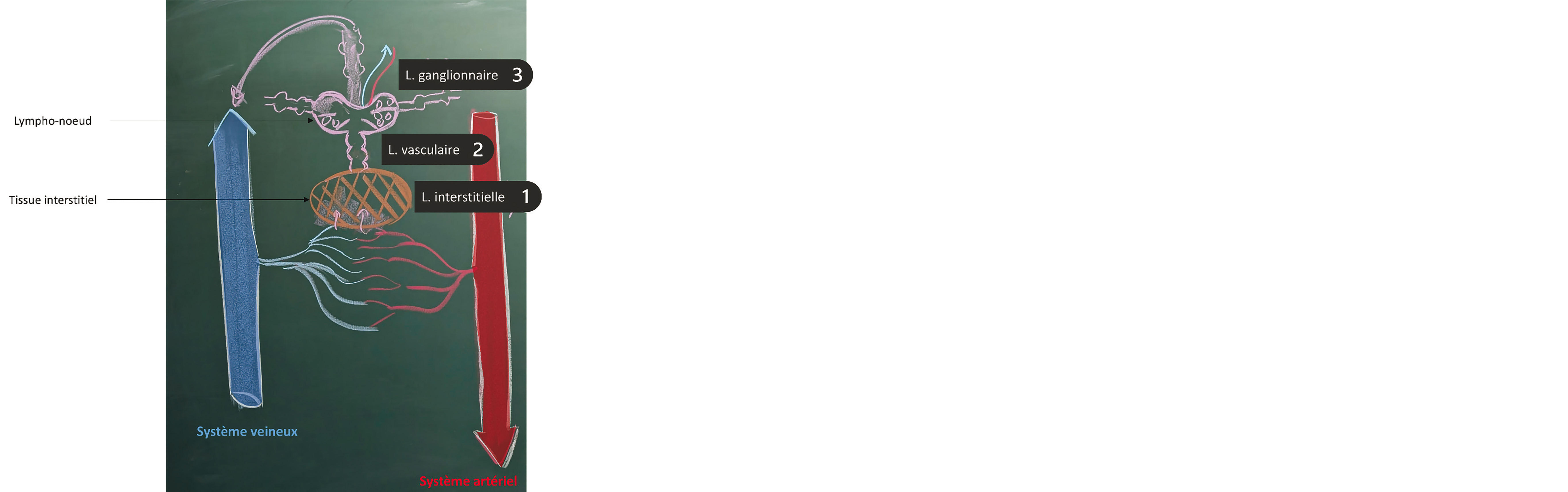
Figure 1 Vue schématique du système lymphatique à l'échelle d'un lymphonoeud.
L, lymphe
Les principaux courants lymphatiques de l'abdomen
L'abdomen est un carrefour lymphatique majeur regroupant plusieurs réseaux de drainage (Figure 2). Ces courants se subdivisent en plusieurs axes en fonction de leur origine anatomique et de leur implication chirurgicale. Ils sont inter-connectés et interrompus par des nœuds (ganglions) lymphatiques.
Un premier courant lymphatique est constitué de la lymphe des membres inférieurs. Il entre dans la région abdominale par l'intermédiaire de l'aine, en suivant les vaisseaux fémoraux puis iliaques externes. On notera la présence d'un lymphonoeud remarquable fémoral, dit « de Cloquet », situé dans la lacune vasculaire en dedans de la veine fémorale. Le curage ganglionnaire inguinal doit parfois être réalisé, notamment en cas de cancers cutanés des membres inférieurs (mélanome), et plus exceptionnellement en cas de métastases ganglionnaires isolées d'adénocarcinome rectal ou de carcinome épidermoïde du canal anal. Les limites de ce curage sont crânialement, le ligament inguinal ; latéralement, le bord médial du muscle sartorius ; et médialement, le bord antéro latéral du muscle long adducteur.
En profondeur, on identifie les éléments vasculo-nerveux du pédicule fémoral que sont, de dehors en dedans, le nerf fémoral et ses nombreux rameaux, l'artère, et la veine fémorale qu'il faut respecter. La veine grand saphène est classiquement emportée avec le curage (2).
Le deuxième courant est celui de la lymphe uro-génitale, qui débute d'une part au niveau des organes génitaux, et d'autre part au niveau des hiles rénaux. Ces vaisseaux lymphatiques ont une direction centripète, et se regroupent au niveau de l'axe aorto-iliaque puis de l'aire inter-aortico- cave. Sur le plan chirurgical, le curage ganglionnaire pelvien est réalisé notamment dans le cadre d'un cancer uro-génital (vessie, prostate, utérus). Les limites de ce curage sont les suivantes : au niveau crânial, le croisement de l'uretère avec l'artère iliaque commune ; latéralement, l'artère iliaque externe ; caudelement, le ganglion de Cloquet ; et médialement, l'artère ombilicale et la paroi latérale de la vessie. Typiquement, on trouve en profondeur du curage le nerf obturateur, qui innerve la peau de la face médiale de la cuisse sur le plan sensitif et les muscles adducteurs de la cuisse sur le plan moteur. Les principales complications per-opératoires sont donc à type de plaies vasculaires, urétérales, ou nerveuses obturatrices, alors que les complications post-opératoires concernent essentiellement les lymphocèles ou les thromboses veineuses profondes.

Figure 2 Vue schématique des principaux courants lymphatiques de l'abdomen
Le réseau lymphatique abdominal est constitué par un ensemble de vaisseaux lymphatiques situés dans le rétropéritoine, très interconnectés entre eux et interrompus par des noeuds lymphatiques. Ces nœuds lymphatiques se regroupent classiquement et topographiquement en lympho-noeuds inter-aortico-caves, latéro-caves et latéro-aortiques (Figure 3). Typiquement, on retrouvera des lympho-noeuds de part et d'autre des gros vaisseaux, mais jamais au niveau du versant postérieur de l'aorte, sauf au niveau de la citerne du chyle qui résume l'ensemble du flux abdominal et qui se trouve en arrière de l'aorte lorsque celle-ci traverse le diaphragme. Chirurgicalement, il est possible de réaliser un curage de ces aires ganglionnaires rétropéritonéales, notamment dans le cadre de cancers avancées, de cancers du testicule ou de récidives ganglionnaires localisées.
Habituellement, cette lymphadenectomie s'étend jusqu'au pédicule rénal crânialement, et peut aller jusqu'aux uretères latéralement, en emportant les lympho-noeuds latéro-aortiques, latérocaves et inter-aortico-cave.
En plus du risque de plaie des gros vaisseaux, il faut souligner le risque de blessures les veines lombaires qui se jettent à la face postérieure de la veine cave inférieure et qui peuvent être à l'origine de saignements importants lors du curage.
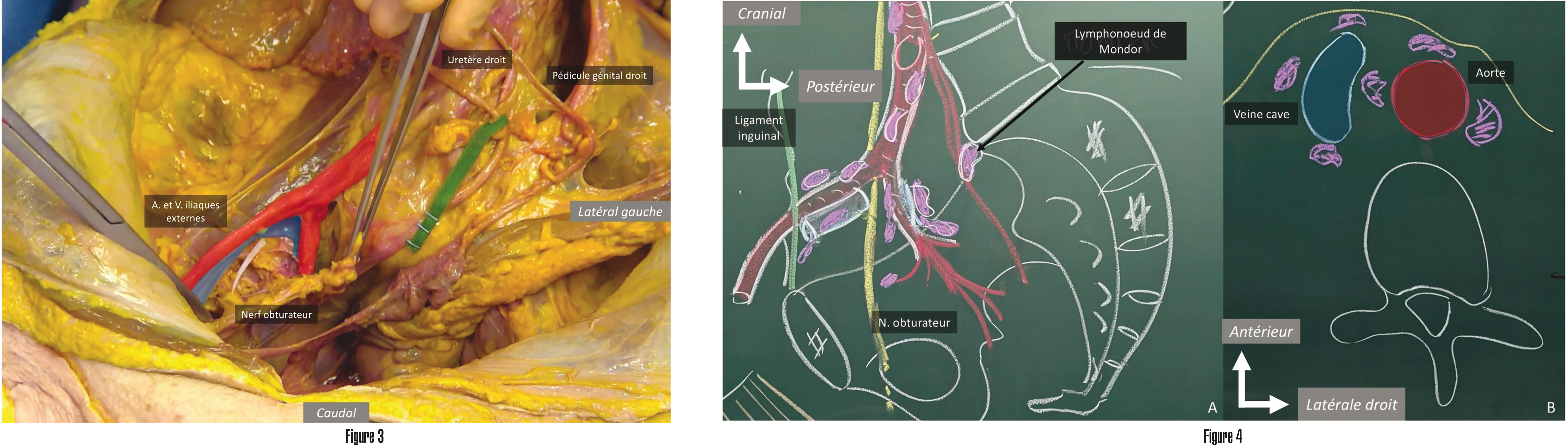
Figure 3 Dissection anatomique montrant les limites d'un curage pelvien droit. A, artère ; V, veine.
Figure 4 Vue schématique du réseau lymphatique abdominale centrale. N, nerf.
Un troisième courant est celui de la lymphe abdominale pariétale. Le drainage lymphatique de la paroi abdominale implique un réseau complexe de voies lymphatiques en fonction des régions, mais qui peuvent être résumés en deux réseaux principaux : un premier, dit superficiel, qui assure le drainage cutané et sous-cutané par des vaisseaux lymphatiques, dont le relais se fait dans les lympho-nœuds inguinaux et iliaques externes, et un second, dit profond, qui assure le drainage des muscles et des fascias, dont les relais rejoignent les lympho-noeuds para-aortiques et mésentériques supérieurs.
Enfin, le 4ème réseau, intestinal, constitue le dernier courant abdominal que nous décrirons ici. La conceptualisation de ce réseau lymphatique intestinal a évolué au cours du XXème siècle.
Le réseau lymphatique intestinal est centripète. Il longe les pédicules vasculaires de l'intestin, au sein des mésos, en suivant les axes veineux et artériels, et se termine en arrière du pancréas. La chirurgie oncologique colique est basée sur ce concept.
En effet, le curage lymphatique lors d'une colectomie gauche consiste, par exemple, à emporter l'ensemble du tissu cellulo-ganglionnaire situé le long de l'axe artériel mésentérique inférieur, avec un nombre minimum de 12 ganglions. Selon la localisation tumorale et pour des raisons de vascularisation colique et de préservation nerveuse, la ligature de l'artère mésentérique inférieure pourra se faire soit à son origine sur l'aorte (hightie), soit après l'émergence de l'artère colique gauche (low tie) (4). Quant à la colectomie droite, le curage lymphatique est désormais codifié sous l'appellation d'une excision complète du mésocolon (ECM) (5). L'ECM a été proposée par Hohenberger et al. en 2009 par analogie à l'exérèse complète du mésorectum décrite par Heald dans les années 1980, concept qui avait alors revisité la prise en charge des tumeurs du rectum tant en termes de risque de récidive que de risque de séquelles fonctionnelles (principalement génito-urinaires). Dans la colectomie droite, cette technique d'ECM consiste à réaliser une exérèse dite en monobloc du mésocolon, associant une ligature centrale des pédicules vasculaires, avec un curage jusqu'à la face antérieure et le bord droit de la veine mésentérique supérieure, voire pour certains, un curage de la face antérieure de l'artère mésentérique supérieure. Les fascias rétro-péritonéaux (fascia pré-urinaire, pancréatique et duodénal) sont respectés de façon à ne pas blesser l'uretère droit (Figure 4).
Liens entre la terminaison du réseau lymphatique intestinal et les structures anatomiques rétro-pancréatiques identifiables lors de la dissection chirurgicale.
Dans la description des traités d'anatomie classiques, la lymphe intestinale se termine dans un « tronc lymphatique intestinal » qui se jette dans la citerne du chyle, en arrière du pancréas puis de l'aorte. Ce tronc intestinal est réputé éminament variable.
Le concept de Descomps et Turnesco (3) repris par Pissas (7) établit que le réseau lymphatique intestinal peut en fait être sub-divisé en deux courants lymphatiques, droit et gauche. Le courant droit draine la partie distale de l'intestin grêle (iléon), le côlon droit, la vésicule biliaire, le foie et le duodeno-pancréas céphalique et forme une « racine droite » du tronc intestinal. Le courant gauche, quant à lui, draine la partie proximale de l'intestin grêle (jejunum), les côlons transverse, gauche et sigmoïde, la partie corporeo-caudale du pancréas, la rate et la partie gauche de l'estomac.
Il forme la « racine gauche » du tronc intestinal. Ainsi, on peut considérer que ces deux courants se terminent en arrière de la glande pancréatique sous la forme de deux « lames tissulaires », comprenant des vaisseaux, des nerfs, des lymphatiqueset du tissu conjonctif, situées et « accrochées » de part et d'autre des 5 à 8 premiers centimètres de l'artère mésentérique supérieure. Prioton et Laux, dans les années 1960, pour définir ces structures, ont utilisé les termes de « lame » rétro-portale (du côté droit de l'artère mésentérique supérieur et en arrière de la veine porte, « lame » disposée selon un plan frontal), et de lame rétro-pancréatique gauche (6, 7) (du côté gauche de l'axe artériel mésentérique supérieur et disposé plutôt dans un plan sagittal). De cette façon, la lame rétro- portale consituerait la terminaison du courant droit, alors que la lame rétro-pancréatique gauche celle du courant gauche. Dans la littérature anglo-saxonne, on désigne également la lame rétro-portale sous le terme de « mésopancréas ». Ce terme de mésopancréas peut donc être relié à la notion de « pédicule vasculo-nerveux » du pancréas, puisque de façon générale, les « pédicules » des organes digestifs sont situés au sein de « mésos ». Ainsi, étant donné que les vaisseaux artériels et veineux irriguant le duodéno-pancréatiques dépendent également de cet axe vasculaire mésentérico-porte (via les arcades duodéno-pancréatiques), on peut donc extrapoler et considérer que le mésopancréas droit (lame rétro-portale) représente à la fois la terminaison du courant lymphatique droit de l'intestin et le « pédicule vasculo- nerveux » du pancréas céphalique, alors que le « méso-pancréas gauche » représente à la fois le « pédicule vasculo-nerveux » du pancréas corporéo-caudal et la terminaison du courant gauche de la masse intestinale.
Toutefois, cette vision simplifiée peut être contestée étant donné la variabilité très importante de la vascularisation lymphatique et surtout les interconnexions qui existent en permanence dans le réseau lymphatique.
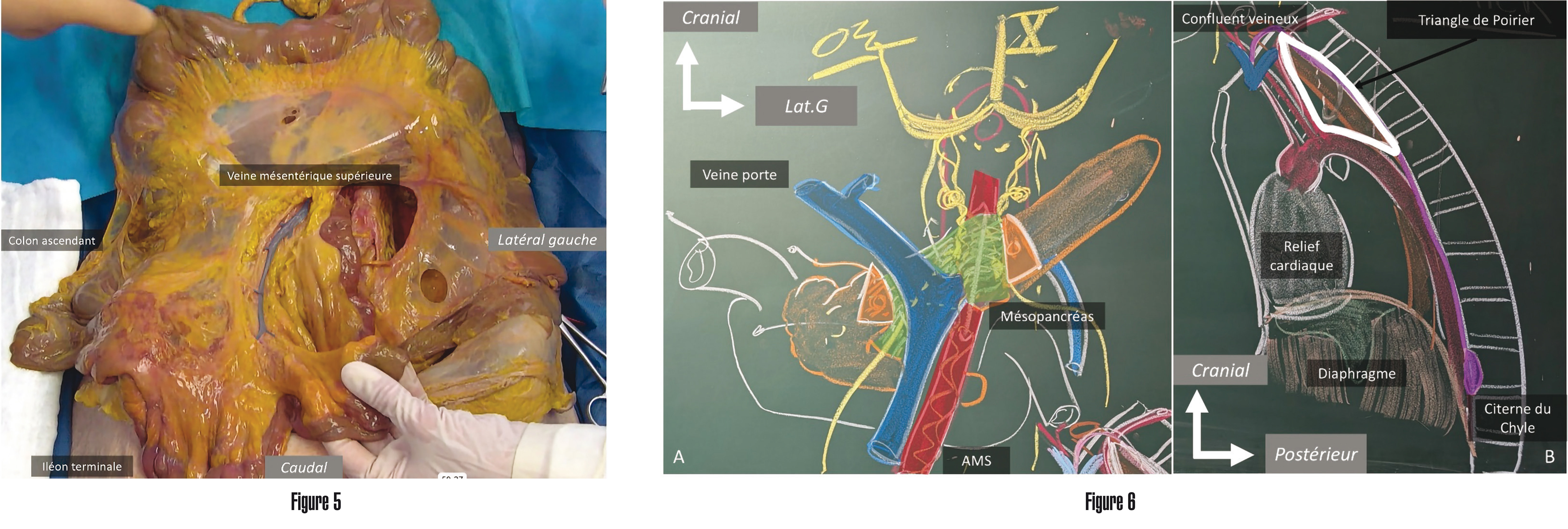
Figure 5 Dissection anatomique montrant la zone correspondante à une excision complète du mésocolon.
Figure 6 Vue schématique de la terminaison du système lymphatique (A) au niveau abdominal avec en vert le mésopancréas et en jaune le réseau nerveux situé en son sein ; et (B) au niveau thoracique avec en violet le conduit thoracique. AMS, artère mésentérique supérieure.
L'ensemble de ces réseaux lymphatiques vont venir se réunir dans la citerne du chyle de Pecquet, qui elle même se poursuivra par le conduit thoracique. Le conduit thoracique, dont le nom témoigne de son trajet intra-thoracique, peut être divisé en 3 portions : la première est rétro-aortique, la deuxième est rétro-oesophagienne et enfin, la troisième est rétro-sous-clavière gauche. Avant sa terminaison veineuse par un trajet en crosse, le conduit thoracique est typiquement situé au sein d'un triangle anatomique, le triangle de Poirier (8).
Celui-ci trouve les limites suivantes en arrière par le bord antérieur des 5 premières vertèbres thoraciques, en avant par le bord postérieur de l'artère sous-clavière gauche et en bas par l'arc aortique (Figure 6). Chirurgicalement, le conduit thoracique est parfois difficilement visible et en cas de plaie per-opératoire, on observera l'apparition d'un chylothorax post-opératoire.
Habituellement, il est possible de proposer un régime à base de matières grasses la veille d'une opération pour dilater ce conduit, mais on peut désormais utiliser la technique du vert d'indocyanine avec un système d'imagerie à fluorescence. C'est ainsi que se finalise le drainage lymphatique de l'abdomen, dans le confluent veineux jugulo-sous-clavier gauche.
Conclusion
Les bases anatomiques des curages lymphatiques dans la chirurgie abdominale reposent sur la compréhension précise des chaînes ganglionnaires qui drainent les différentes régions abdominales. Ces curages lymphatiques, souvent pratiqués dans le cadre d'une chirurgie à visée carcinologique, visent à retirer l'ensemble des ganglions lymphatiques présents dans la zone de drainage de l'organe atteint. Ils nécessitent donc une connaissance approfondie des principales voies de drainage lymphatique et des structures anatomiques associées ainsi que leur relation avec les organes adjacents. Une maîtrise de cette anatomie est cruciale pour une prise en charge optimale des patients notamment pour améliorer le pronostic oncologique mais aussi pour diminuer le risque de récidive ganglionnaire à plus ou moins long terme.

Dr Sébastien FREY 1, 2, 3

Dr Victor TEMIME 1, 3

Pr Patrick BAQUÉ 1, 2, 3
Correspondance
Dr Sébastien FREY
Service de Chirurgie Digestive,
Hôpital Pasteur 2,
Centre Hospitalo-Universitaire de Nice,
[email protected]
1. Service de Chirurgie Digestive, Hôpital Pasteur 2, Centre Hospitalo-Universitaire de Nice, France.
2. Laboratoire d'Anatomie Côte d'Azur.
3. Université Côte d'Azur.
Références
1. Riquet M, Mordant P, Pricopi C, Achour K, Le Pimpec Barthes F. Anatomie, microanatomie et physiologie des lymphatiques des poumons et de la paroi thoracique. Rev Pneumol Clin. 2013 Apr;69(2):102-10. French. doi: 10.1016/j. pneumo.2012.12.007.
2. Lupinacci RM, Benoît O, Peschaud F. Inguinal lymph node dissection. J Visc Surg. 2023 Apr;160(2):127-133. doi: 10.1016/j. jviscsurg.2023.01.010.
3. Descomps P, Turnesco D. Les grands courants lymphatiques de l'abdomen, leur convergence, leurs ganglions satellites.
Arch Franco-Belges Chir. 1922; 7:298–319.
4. Fan Y.C, Ning F.L, Zhang C.D., and Dai D.Q. Preservation versus non-preservation of left colic artery in sigmoid and rectal cancer surgery : a meta-analysis. Int J Surg 2018 : pp.269-277
5. Hohenberger W, Weber K, Matzel K, Papadopoulos T, Merkel S. Standardized surgery for colonic cancer: complete
mesocolic excision and central ligation - technical notes and outcome. Colorectal Dis 2009;11(4):354-364. doi: 10.1111/j.1463-1318.2008.01735.x.
6. Prioton JB, Laux R. La lame rétro-portale du pancréas céphalique. Incidences de sa topographie en chirurgie pancréatique et portale. CR Assoc Anat. 1960; 108:667–673.
7. Pissas A. Anatomoclinical and anatomosurgical essay on the lymphatic circulation of the pancreas. Anat Clin. 1984; 6:255–280.
8. Poirier P, Charpy A. Traité d'anatomie humaine. Masson, Paris. 1901.

