Introduction
La Tétralogie de Fallot est une cardiopathie congénitale caractérisée par une communication interventriculaire (CIV), une aorte dextroposée ou à cheval sur la CIV, une sténose ulmonaire, et une hypertrophie ventriculaire droite (Figure 1).
On parle de Tétralogie de Fallot irrégulière quand elle est associée à d'autres anomalies telles qu' une sténose des branches pulmonaires, des CIV multiples, des anomalies de connexion et/ou de trajet des artères coronaires, une crosse aortique droite.
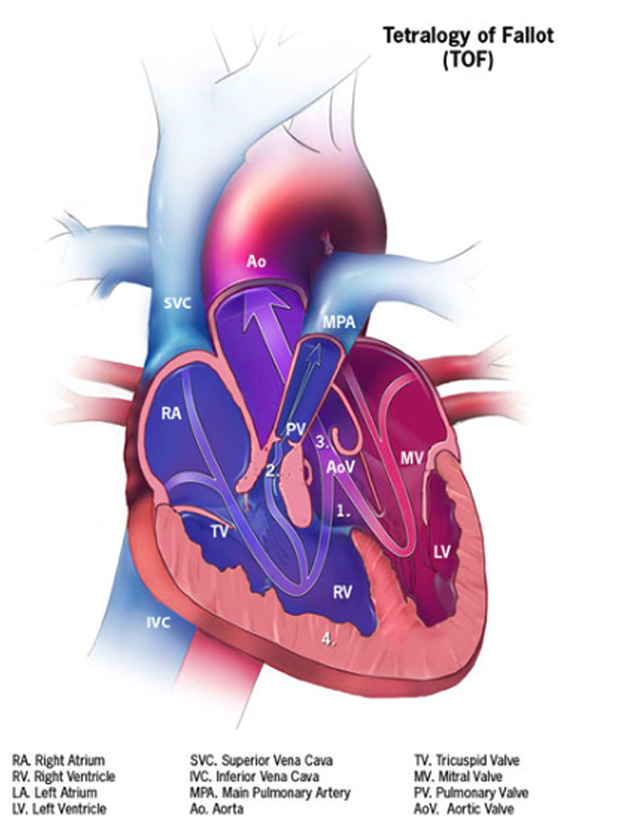
Figure 1.
Représentation schématique d'une Tétralogie de Fallot (9)
La majorité du temps, elle est isolée mais quelques patients présentent une forme syndromique (15 %) représentée majoritairement par le syndrome de Di George (micro délétion 22q11) et la Trisomie 21 mais aussi des entités plus rares comme le syndrome d'Alagille, de Noonan… (1)
C'est la cardiopathie cyanogène la plus fréquente (2). La cyanose provient du shunt droite-gauche au travers de la CIV, son importance dépend de la sévérité de la sténose pulmonaire.
Diagnostic
Cliniquement le diagnostic est suspecté en cas de souffle systolique au foyer pulmonaire. Il peut être associé à une cyanose, pouvant s'accroître jusqu'à se compliquer de malaises anoxiques liés à un spasme infundibulaire appelés « malaises de Fallot ».
À l'électrocardiogramme, l'axe peut-être dévié à droite avec une hypertrophie ventriculaire droite.
À la radiographie, le cœur est en « sabot » (c'est-à dire avec une pointe relevée) avec des poumons hyper-clairs (car hypo-vascularisés).
Le diagnostic est échographique (peut-être posé en anténatal ou en post-natal) et associe les anomalies précédemment citées : CIV, aorte dextroposée, sténose pulmonaire, et hypertrophie ventriculaire droite. Il faut définir, lors de cet examen, l'importance et la localisation de la sténose pulmonaire, ainsi que d'analyser l'anatomie coronaire et des branches pulmonaires.
Prise en charge séquentielle
Avant l'âge de la réparation chirurgicale (classiquement entre 4 et 6 mois), il peut y avoir besoin d'un traitement médical. En effet, la prise en charge immédiate du « malaise de Fallot » comprend : la réassurance, regrouper l'enfant, effectuer un remplissage vasculaire (10mL/kg), et donner des bétabloquants en injectable (Propranolol IVL 1mg) ou en intra-rectal (Diazépam 0,5mg/kg) jusqu'à réapparition du souffle de sténose pulmonaire.
Les bêtabloquants peuvent aussi être utilisés en traitement quotidien avant prise en charge chirurgicale curative en cas de sténose pulmonaire à prédominance musculaire significative avec cyanose persistante.
La prise en charge curative consiste en un traitement chirurgical pouvant passer par plusieurs étapes. En cas de sténose pulmonaire très sévère résistante au traitement avec désaturation majeure, il peut parfois être proposé une première étape intermédiaire consistant en une ouverture VD-AP, une anastomose systémicopulmonaire (3) ou une dilatation percutanée au ballon.
La prise en charge curative est réalisée en général entre 4 et 6 mois de vie et consiste en une correction chirurgicale complète comprenant : infundibulotomie pulmonaire longitudinale avec résection musculaire +/- importante selon l'hypertrophie, calibrage de la valve pulmonaire amenant à la valvuloplastie (commissurotomie, valvectomie ou patch d'élargissement de la voie pulmonaire…), et fermeture de la CIV par patch.
Évolution et complications
En l'absence de prise en charge, l'évolution naturelle est marquée par une accentuation de la sténose pulmonaire donc de l'hypo vascularisation pulmonaire et de la cyanose amenant à une polyglobulie et une insuffisance cardiaque, lipothymies, syncopes ou morts subites avec un risque d'endocardite élevé et d'emboles cérébrales sur le shunt droit-gauche. Ces formes cliniques sont rares devant l'amélioration du diagnostic pré et post-natal des cardiopathies congénitales en France et en Europe.
En post-opératoire immédiat, la mortalité est faible (2 %), majorée en cas de forme irrégulière, de petit poids/âge jeune. Les autres complications sont (Figure 2) : les CIV résiduelles, sténose pulmonaire résiduelle, insuffisance pulmonaire, plus rarement les troubles du rythme (JET) ou troubles conductifs (bloc atrio-ventriculaire).
L'évolution au long cours est marquée (4) le plus souvent par une majoration de la fuite pulmonaire progressive, à surveiller (5), amenant le plus souvent à la nécessité d'une revalvulation pulmonaire à l'adolescence ou jeune adulte pouvant être réalisée par chirurgie ou par cathétérisme.
La dilatation de la racine aortique est fréquente est doit être surveillée car elle peut également nécessiter une prise en charge chirurgicale.
Les troubles du rythmes supra-ventriculaires et ventriculaires peuvent apparaître au cours du suivi et sont aussi à surveiller avec notamment des électrocardiogrammes et holters réguliers. Ils proviennent le plus souvent de cicatrices de la chirurgie (notamment de l'infundibulotomie). L'association de facteurs de risques tels que l'antécédent de Blalock, l'antécédent de cicatrice étendue, de fibrose étendue en IRM, QRS larges >180 ms, présence de TVNS, SVP positive, peut amener à discuter d'ablation ventriculaire préventive ou de la pose d'un défibrillateur en prévention primaire de la mort subite.
L'insuffisance cardiaque (6) sur la dilatation/dysfonction du ventricule droit secondaire à la fuite pulmonaire voire d'une fuite tricuspide secondaire peut également survenir.
Le suivi s'effectue par un cardiologue de ville en lien avec un cardio-pédiatre en centre de référence, environ une fois par an, à vie.
Le risque d'endocardite est présent, avec des patients à « haut risque » (7) donc nécessitant une antibioprophylaxie en cas de geste à risque en cas d'antécédent d'endocardite (groupe 1), de valve prothétique (groupe 2), avant la cure chirurgicale complète (groupe 3). Dans les autres cas, l'antibioprophylaxie n'est pas recommandée.
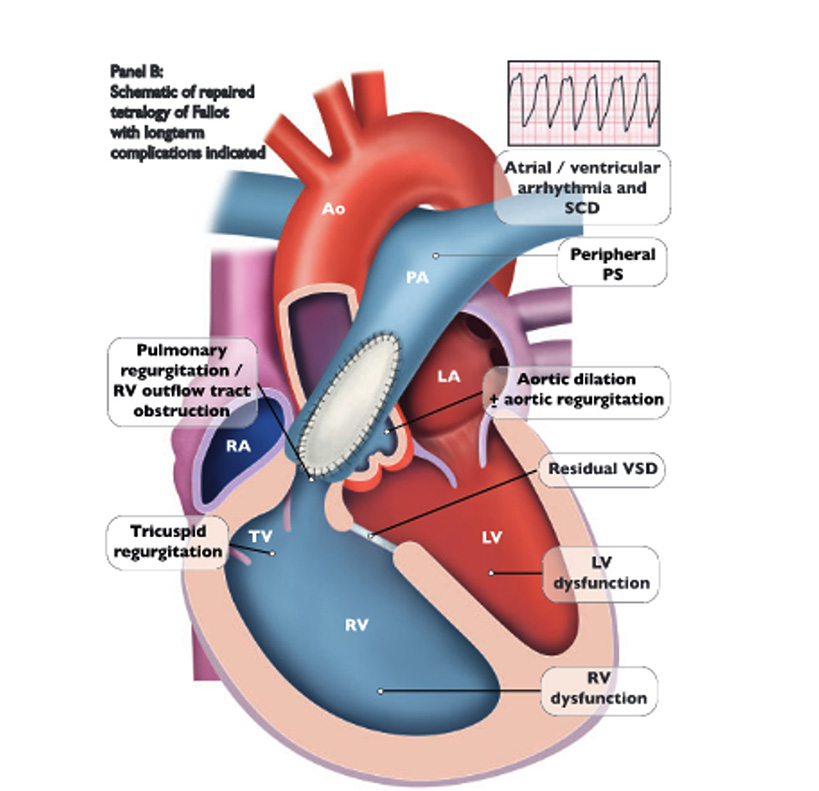
Figure 2.
Réparation chirurgicale d'une Tétralogie de Fallot et complications (8)
Auteur

Pauline NORMANDIN
CHU de Lille
Relectrice

Dr Olivia DOMANSKI
CHU de Lille
Références
1. Bajolle F, Zaffran S, Bonnet D. Genetics and embryological mechanisms of congenital heart diseases. Archives of Cardiovascular Diseases. 2009 Jan 1;102(1):59–63.
2. Van der Linde D, Konings EEM, Slager MA, Witsenburg M, Helbing WA, Takkenberg JJM, et al. Birth Prevalence of Congenital Heart Disease Worldwide : A Systematic Review and Meta-Analysis. Journal of the American College of Cardiology. 2011 Nov 15;58(21):2241–7.
3. Blalock A, Taussing HB. The surgical treatment of malformations of the heart : in which there is pulmonary stenosis or pulmonary atresia. Journal of the American Medical Association. 1945 May 19;128(3):189–202.
4. Hickey EJ, Veldtman G, Bradley TJ, Gengsakul A, Manlhiot C, Williams WG, et al. Late risk of outcomes for adults with repaired tetralogy of Fallot from an inception cohort spanning four decades. European Journal of Cardio-Thoracic Surgery. 2009 Jan 1;35(1):156–64.
5. Quail MA, Frigiola A, Giardini A, Muthurangu V, Hughes M, Lurz P, et al. Impact of pulmonary valve replacement in tetralogy of Fallot with pulmonary regurgitation: a comparison of intervention and nonintervention. Ann Thorac Surg. 2012 Nov;94(5):1619–26.
6. Zomer AC, Vaartjes I, Velde ET van der, Jong HMY de, Konings TC, Wagenaar LJ, et al. Heart failure admissions in adults with congenital heart disease; risk factors and prognosis. International Journal of Cardiology. 2013 Oct 3;168(3):2487–93.
7. Delgado V, Ajmone Marsan N, De Waha S, Bonaros N, Brida M, Burri H, et al.
2023 ESC Guidelines for the management of endocarditis. European Heart Journal. 2023 Oct 14;44(39):3948–4042.
8. Baumgartner H, De Backer J, Babu-Narayan SV, Budts W, Chessa M, Diller GP, et al. 2020 ESC Guidelines for the management of adult congenital heart disease: The Task Force for the management of adult congenital heart disease of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Adult Congenital Heart Disease (ISACHD). European Heart Journal. 2021 Feb 7;42(6):563–645.
9. Centers for Disease Control and Prevention, National Center on Birth Defects and Developmental Disabilities

