Échec de resynchronisation cardiaque : quelles sont les alternatives en 2023 ?
Messages clés
• La resynchronisation cardiaque chez les patients qui le nécessitent est associée à une augmentation de la FEVG, une diminution de la morbi-mortalité et une amélioration fonctionnelle.
• On estime un taux de 5 à 7 % d’ échec d’implantation et environ 30 % de patients non répondeurs à la resynchronisation classique.
• La stimulation hissienne peut permettre de corriger un bloc de branche mais est associée à des seuils de stimulation élevés et des problématiques de sur- et sous-détection.
• La stimulation de branche gauche permet d’affiner les QRS avec d’excellents seuils de stimulation.
• Des données de suivi à long terme sont nécessaires et ces techniques doivent être réservées en seconde intention aux échecs de resynchronisation classique.
• Le système WISE-CRT est pour l’instant destiné à une petite niche de patients, mais est une technique prometteuse qui prendra peut-être de l’essor dans les prochaines années.
La resynchronisation cardiaque a été introduite dans les années 1990 en France par S. Cazeau en collaboration avec l’équipe rennaise(1).
La physiopathologie qui sous-tend ce principe est que les patients insuffi sants cardiaques présentent fréquemment d’importants troubles de conduction atrio-ventriculaires, intra et/ou interventriculaires à l’origine d’un asynchronisme de contraction, qui se traduira sur l’électrocardiogramme par un bloc de branche gauche. La resynchronisation cardiaque va permettre le rétablissement d’une contraction synchrone entre les deux ventricules. Elle peut être associée à un stimulateur cardiaque (CRT-P) ou à un défi brillateur (CRT-D) en fonction du profil du patient.
Les indications actuelles de resynchronisation - parues dans les dernières recommandations de l’ESC (European Society of Cardiology) en 2021 - sont les patients présentant une insuffisance cardiaque avec FEVG < 35 % symptomatique (au moins classe II de la NYHA), avec un bloc de branche gauche > 150ms (Ia), un bloc de branche gauche entre 130 et 150 ms, ou un bloc de branche droit (IIa)(2).
Figure 1. Recommandations de l’European Society of Cardiology (ESC) sur la resynchronisation cardiaque.
La technique repose sur la mise en place sous scopie d’une sonde au sein d’une veine latérale du sinus coronaire. Le sinus coronaire s’abouche dans l’oreillette droite juste en dessous de la valve tricuspide, puis longe la paroi du ventricule gauche.
Contrairement aux sondes atriale et ventriculaire droite, la sonde de resynchronisation n’est pas fixée, cela nécessite donc qu’elle soit placée dans une veine terminale du sinus coronaire afin d’assurer sa stabilité dans le temps. Cette étape est la plus difficile du fait d’un réseau la plupart du temps tortueux et fi n avec parfois difficulté decanulation, ou absence de collatérale.
La resynchronisation cardiaque a montré une amélioration de la fonction cardiaque et de la qualité de vie, ainsi qu’une diminution de la morbi-mortalité dans plusieurs essais randomisés(3)(4).
Du fait des difficultés anatomiques précédemment mentionnées, il existe un certain nombre d’échec d’implantation de 5 à 7 %, et un taux de non répondeur à la resynchronisation autour de 30 % selon les études(5)(6).
Actuellement, nous disposons de nouvelles modalités de stimulation qui peuvent être proposées en seconde intention, que nous allons passer en revue, en s’attardant sur la stimulation de branche gauche récemment introduite avec des résultats prometteurs.
Stimulation hissienne
Technique
La stimulation hissienne existe depuis de nombreuses années puisqu’elle a été décrite pour la première fois chez l’homme en 1995(7).
Cette technique repose sur l’introduction d’une sonde dans le ventricule droit au travers d’une gaine préformée, puis repérage du signal électrique du faisceau de His, et fixation de la sonde par tour de vis. Elle permet d’obtenir un QRS stimulé proche du QRS spontanément, mais également peut permettre de corriger un bloc de branche gauche existant dans 70 à 90 % des cas(8).
La stimulation peut être sélective ou non sélective, sans différence rapportée en termes hémodynamique.
Figure 2. Inspiré de Vijayaraman p et al, JACC 2017, 69 3099–3114. À gauche : site de stimulation hissienne.
A droite : ECG d’une stimulation hissienne sélective.
Résultats
Le taux de succès et la durée de cette procédure se sont améliorés ces dernières années du fait du développement de matériel dédié.
Malgré des résultats encourageants, les principales limites de cette technique sont liées à des seuils de stimulation plus élevés pouvant entraîner une usure prématurée de la batterie, mais également un risque de perte de capture nécessitant dans certains cas la mise en place d’une sonde VD en « back-up »(9)(10). Il a également été décrit des seuils de détection plus faibles de l’onde R, et une sur-détection de l’oreillette et du faisceau de His, ce qui représente un danger potentiel chez certains patients dépendants.
Elle fait l’objet d’une recommandation de classe IIa en cas d’échec de resynchronisation classique. Nous ne disposons pas pour l’instant de données de sécurité à long terme.
Stimulation de branche gauche
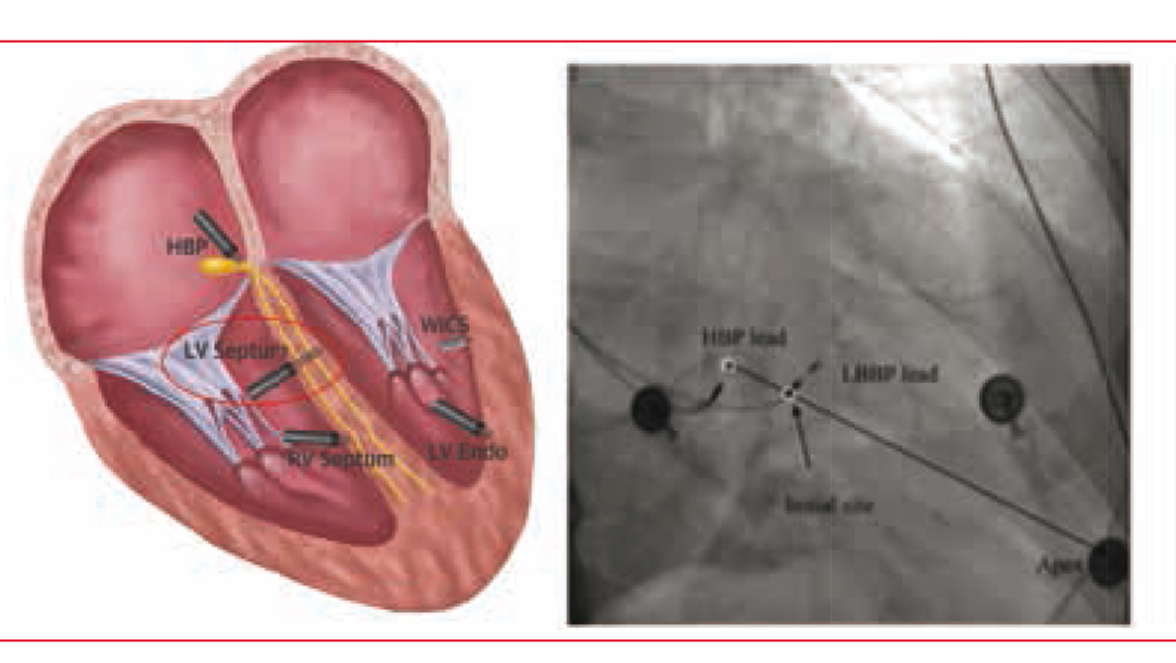
La stimulation de la branche gauche ou Left Bundle Branch Pacing (LBBP) est une technique récemment introduite en 2017.(11) Contrairement à la stimulation hissienne, la sonde est implantée plus en distalité au niveau de la branche gauche du faisceau de His.
Technique
Un abord veineux classique est réalisé, avec mise en place de la sonde dans une gaine préformée semblable à celle utilisée pour une implantation hissienne.
Il faut ensuite repérer à l’aide de la gaine la zone cible qui se situe 10 à 20 mm en dessous du His sur une ligne imaginaire reliant le His et l’apex du VD. L’aspect initial est un aspect en W dans la dérivation V1 en stimulation unipolaire.
Ensuite, plusieurs tours de vis sont effectués au niveau du corps de sonde jusqu’à l’obtention de critères sélectifs, à savoir un aspect qR ou RsR’ en V1. On mesure également la durée du QRS stimulé qui doit être affiné avec un aspect de bloc de branche droit (Figure 3).
Figure 3. À gauche. Site de stimulation de la branche gauche. Inspiré de Vijayaraman p et al, JACC 2017, 69 3099–3114 ; Au milieu. Repérage du site d’implantation en vue OAD 30°; A droite. Évolution de l’aspect en V1 en stimulation unipolaire.
Résultats
On constate que la stimulation de branche gauche présente l’avantage de seuils de stimulations faibles proches de ceux attendus avec une stimulation classique, et la possibilité de corriger les blocs de branche gauche du fait d’une stimulation en aval du site de blocage.
L’étude randomisée LBBB-RESYNC parue en 2022 dans le JACC a comparé la stimulation de branche gauche à une resynchronisation classique dans une population de patients présentant une cardiomyopathie non ischémique avec une FEVG < 35 % et un bloc de branche gauche complet. Après un suivi de 6 mois, la stimulation de branche gauche a démontré une amélioration significative de la fraction d’éjection du ventricule gauche, une diminution du NTproBNP et du volume télédiastolique du VG, comparativement à la resynchronisation classique(12).
Jusqu’alors nous ne disposions que d’études observationnelles, et ces résultats devraient permettre à cette nouvelle modalité de stimulation d’intégrer les prochaines recommandations européennes, même si elle doit pour l’instant être limitée aux échecs de resynchronisation.
Des données à long terme seront nécessaires afin de s’assurer de la sécurité de cette technique, notamment sur les possibilités d’extraction de la sonde.
Cas particulier du WISE CRT
Il s’agit d’un système de resynchronisation cardiaque sans sonde développé par la société EBR Systems, Sunnyvale, CA. Ce système nécessite la présence d’un système de stimulation du ventricule droit (classique ou sans sonde). Un transmetteur à impulsion par ultrasons est implanté par voie sous-cutanée, et relié à une batterie. Une électrode de 9,1 mm de longueur x 2,7 mm de diamètre est insérée directement dans le ventricule gauche par un abord transseptal, et fi xée à l’aide des ancres présentes à son extrémité (Figure 4).
Figure 4. Illustration d’un système de resynchronisation sans sonde.
Le transmetteur va détecter le pic de stimulation du ventricule droit et transmettre une impulsion à l’électrode permettant la stimulation du ventricule gauche avec un délai de 3 à 10 ms.
Très peu d’études sont disponibles, et une récente méta-analyse incluant 175 patients a montré une tendance à l’amélioration de la FEVG et du remodelage ventriculaire(13).
Ce système a obtenu une prise en charge transitoire de la Haute Autorité de Santé en 2018 chez des patients non répondeurs à la resynchronisation classique ou en cas d’échec d’implantation, mais ne fait pour l’instant pas l’objet de recommandations.
Conclusion
Ces dernières années ont vu naître de nouvelles modalités de stimulation. Si la stimulation hissienne et la stimulation de branche gauche semblent toutes deux être plus physiologiques que la stimulation VD classique, la stimulation de branche gauche semble une technique plus prometteuse dans la resynchronisation cardiaque. Le WISE-CRT est quant à lui un système innovant qui n’en est probablement qu’à ses débuts. Des études supplémentaires seront nécessaires pour disposer des données à long terme, et la resynchronisation cardiaque bi-ventriculaire doit pour l’instant rester la référence.
Références
1. Cazeau S, et al. Four Chamber Pacing in Dilated Cardiomyopathy. Pacing Clin Electrophysiol. 1994 Nov;17(11):1974–9.
2. Glikson M, et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. Eur Heart J. 2021 Sep 14;42(35):3427–520.
3. Moss AJ, et al. Cardiac-Resynchronization Therapy for the Prevention of Heart-Failure Events. N Engl J Med. 2009 Oct;361(14):1329–38.
4. Bristow MR, et al. Cardiac-Resynchronization Therapy with or without an Implantable Defi brillator in Advanced Chronic Heart Failure. N Engl J Med. 2004 May 20;350(21):2140–50.
5. Bleeker GB, et al. Clinical Versus Echocardiographic Parameters to Assess Response to Cardiac Resynchronization Therapy. Am J Cardiol. 2006 Jan;97(2):260–3.
6. van Rees JB, et al. Implantation-Related Complications of Implantable Cardioverter-Defi brillators and Cardiac Resynchronization Therapy Devices. J Am Coll Cardiol. 2011 Aug;58(10):995–1000.
7. Mabo P, et al. A Technique for Stable His-Bundle Recording and Pacing: Electrophysiological and Hemodynamic Correlates. Pacing Clin Electrophysiol. 1995 Oct;18(10):1894–901.
8. El-Sherif N, et al. Normalization of bundle branch block patterns by distal His bundle pacing. Clinical and experimental evidence of longitudinal dissociation in the pathologic his bundle. Circulation. 1978 Mar;57(3):473–83.
9. Teigeler T, et al. Intermediate-term performance and safety of His-bundle pacing leads: A single-center experience. Heart Rhythm. 2021 May;18(5):743–9.
10. Vijayaraman P, et al. Permanent His-bundle pacing: Long-term lead performance and clinical outcomes. Heart Rhythm. 2018 May;15(5):696–702.
11. Huang W, et al. A Novel Pacing Strategy With Low and Stable Output: Pacing the Left Bundle Branch Immediately Beyond the Conduction Block. Can J Cardiol. 2017 Dec;33(12):1736.e1-1736.e3.
12. Wang Y, et al. Randomized Trial of Left Bundle Branch vs Biventricular Pacing for Cardiac Resynchronization Therapy. J Am Coll Cardiol. 2022 Sep;80(13):1205–16.
13. Cang J, et al. WiSE CRT Is Benefi cial for Heart Failure Patients as a Rescue Therapy: Evidence From a Meta-Analysis. Front Cardiovasc Med. 2022 Mar 15;9:823797.
Dr Elodie DESCHAMPS
CCA de rythmologie, CHU de Grenoble
Pr Pascal DEFAYE
PU-PH de rythmologie, CHU de Grenoble
Article paru dans la revue « Collèges des Cardiologues en Formation » / CCF n°17

