
Vous lʼavez appris lors de votre internat : « Time is Brain », chaque minute, plus de 2 millions de neurones meurent. De lʼépoque du Kardégic à la thrombolyse et à la thrombectomie, revenons sur lʼhistoire du rt-PA et revivons les moments clés qui ont marqué la neurologie vasculaire !
Wake-up, Extend, ECASS 3… des noms dʼétudes emblématiques, mais il nʼest pas toujours facile de se rappeler de leurs résultats.
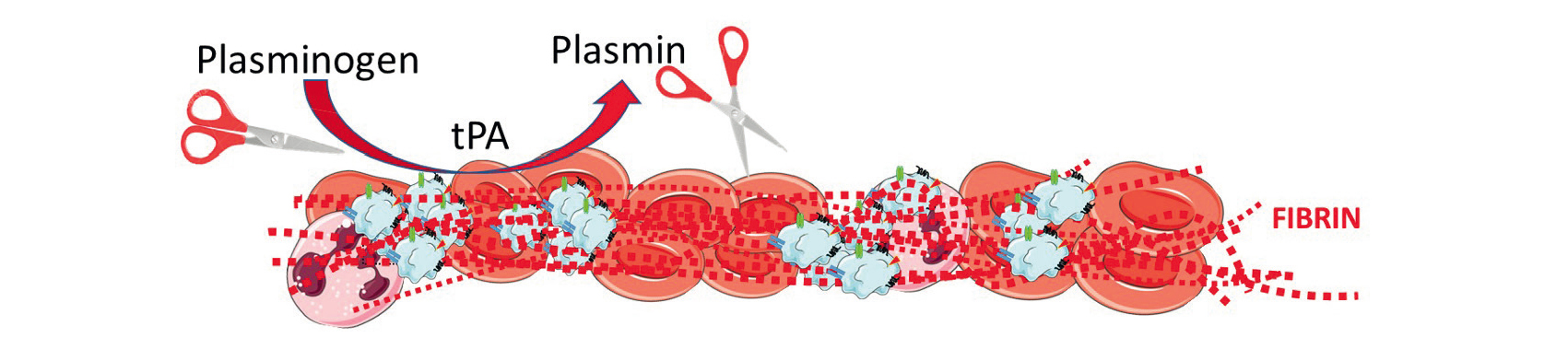
Adapté de Ho-Tin-Noé, B., Desilles, J.-P. & Mazighi, M. Thrombus composition and thrombolysis resistance in stroke. Res Pract Thromb Haemost 7, 100178 (2023).
En 1995, alors que Microsoft lançait son système d'exploitation révolutionnaire, Windows 95, l'étude NINDS1 (National Institute of Neurological Disorders and Stroke) représentait elle aussi un tournant majeur dans la prise en charge de l'accident vasculaire cérébral (AVC) ischémique. Cette étude pionnière démontrait que l'administration précoce de tissu plasminogène activé (t-PA), dans les 3 heures suivant l'apparition des symptômes, permettait d'améliorer de manière significative les chances de récupération fonctionnelle des patients (NNT = 8 pour un score de Rankin inférieure ou égale 1). Ces conclusions ont joué un rôle crucial dans l'approbation du t-PA comme traitement standard de l'AVC ischémique aiguë, une avancée qui a transformé la prise en charge de cette pathologie. Rappelez-vous qu'auparavant, seul le Kardégic était utilisé. Il est aussi important de noter que l'imagerie utilisée dans cette étude était le scanner cérébral sans perfusion (l'IRM lors de l'alerte AVC n'est pas la norme partout !).
Il faudra attendre quelques années, en 2008, année où Barack Obama a été élu 44e président des États-Unis, pour que la publication de l'étude ECASS III permette d'étendre la fenêtre thérapeutique de la thrombolyse par alteplase à 4,5 heures du début des symptômes (NNT = 14 pour un score de Rankin inférieure ou égale à 1). Soulignons à nouveau que la très grande majorité des diagnostics reposait sur un scanner cérébral sans perfusion (seulement 6 % d'IRM cérébrale étaient utilisées)2. De plus en plus souvent évoqué dans les études, le concept de pénombre et d'oligohémie apparaît. En 2008, l'étude « Echoplanar Imaging Thrombolytic Evaluation Trial » (EPITETH) suggère l'intérêt de l'imagerie avancée pour prolonger le délai de thrombolyse au-delà de trois heures. Le but était de comparer les séquences de perfusion et de diffusion en IRM afin de déterminer la zone de pénombre (zone susceptible de redevenir viable en cas de reperfusion)3, 4. En 2014, année du baccalauréat pour les personnes nées en 1996, la méta-analyse d'Emberson et al., reprenant les études NINDS (1995), ECASS II (1998), ECASS III (2008), ATLANTIS (2002), EPITETH, et IST-3 (soit 6756 patients), valide l'efficacité de l'alteplase pour les AVC ischémiques dans les 4,5 heures suivant le début des symptômes. L'alteplase est plus efficace lorsqu'elle est administrée tôt :
• 0–3 h : 32,9 % des patients ont une récupération fonctionnelle (Rankin 0–1) sous alteplase vs. 23,1 % sous placebo (OR 2,55 ; p inférieure à 0,001).
• 3–4,5 h : 35,3 % vs. 30,1 % (OR 1,44 ; p inférieure à 0,001).
• 4,5–6 h : 32,6 % vs. 30,6 % (OR 1,15 ; p = 0,05).
• Après 6 h : Pas de bénéfice démontré.
Le bénéfice est maximal dans les 3 premières heures, avec un effet encore présent entre 3 et 4,5 heures. Après 4,5 heures, l'efficacité est plus faible et les risques hémorragiques augmentent5. Rappelons que tous ces essais sont réalisés lorsque le début des symptômes est connu !
Et si lʼheure de début des symptômes nʼest pas connue ?
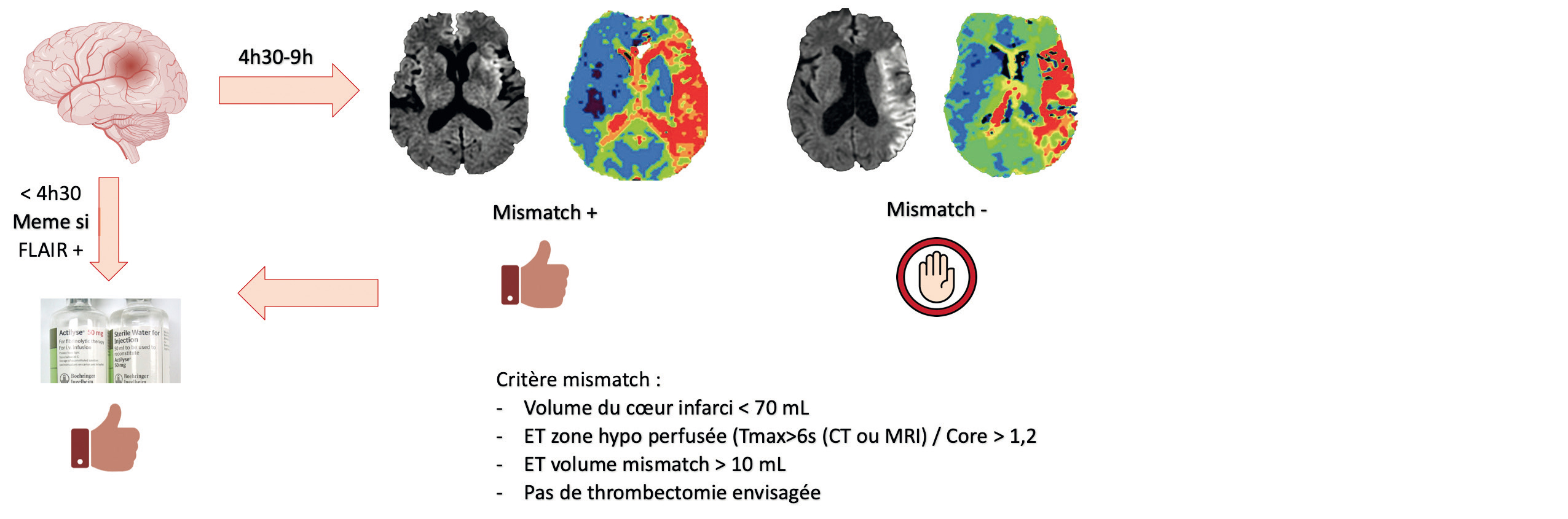
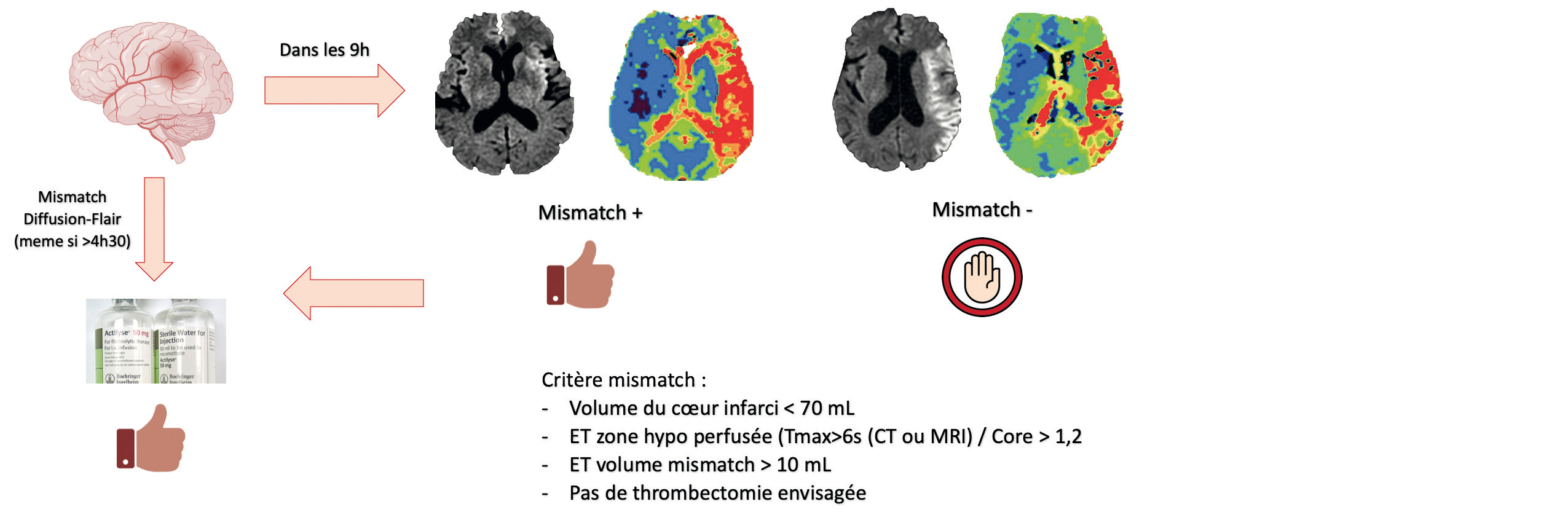
En 2018, alors que la France célèbre la victoire de la Coupe du Monde, l'étude WAKE-UP permet elle aussi de célébrer les premiers résultats de la thrombolyse en cas d'heure de début des symptômes inconnue. Basée sur le critère du mismatch diffusion/FLAIR (hypersignal diffusion non visible en FLAIR), cette étude suggère un bénéfice de la thrombolyse (NNT : 9 pour un score de Rankin inférieure ou égale à 1) chez des patients non inclus auparavant devant l'incertitude du timing : pratique pour les AVC du réveil6 ! Notons que les patients éligibles à la thrombectomie étaient exclus. Au-delà de 4h30, si le patient nʼest pas éligible à la thrombectomie, l'étude EXTEND7 permet de suggérer un bénéfice de la thrombolyse chez les patients avec des symptômes (entre 4,5h et 9h) ou un AVC du réveil et un mismatch diffusion/perfusion définit comme : Un ratio de volume entre la zone hypo-perfusée et la zone irréversiblement ischémiée supérieure à 1,2Un volume hypoperfusion supérieure à 10 ml avec un noyau ischémique en diffusion inférieure à 70 ml7Ces résultats sont également confirmés dans la méta-analyse de Campbell et col. de 20198 incluant EXTEND ECASS 4 et EPITHET (414 patients), sans augmentation significative de la mortalité.
En pratique, que disent les recommandations concernant la thrombolyse par altéplase ? (ESOC 2021)
Si l'heure de début des symptômes est connue
Si l'heure de début des symptômes est inconnue
Quelques précisions
AVC ischémiques mineurs avec déficit cliniquement pertinent (en général : présence d'une hémianopsie latérale homonyme, aphasie, négligence, déficit moteur supérieure à 2) et de moins de 4,5h : TIV AVC ischémiques sévères NIHSS supérieure à 25 et inférieure à 4h30 : TIV.
Et la ténectéplase ? On en parle beaucoup…
La ténectéplase est une forme génétiquement modifiée de l'alteplase. Elle a le même mode d'action que l'alteplase, en activant la transformation du plasminogène en plasmine pour lyser les caillots. Cependant, elle est 80 fois plus résistante au PAI-1, ce qui lui permet de rester active plus longtemps dans la circulation, avec un effet fibrinolytique plus durable. Elle est aussi plus spécifique de la fibrine, ciblant préférentiellement les thrombus et réduisant le risque de fibrinolyse systémique et de saignement. Sa demi-vie plus longue (22 minutes) permet une administration en bolus unique de 0,25 mg/kg (max 25 mg), contrairement à l'alteplase qui nécessite un bolus suivi d'une perfusion. Initialement développée pour les infarctus du myocarde, la ténectéplase est désormais utilisée dans la prise en charge des AVC ischémiques9.
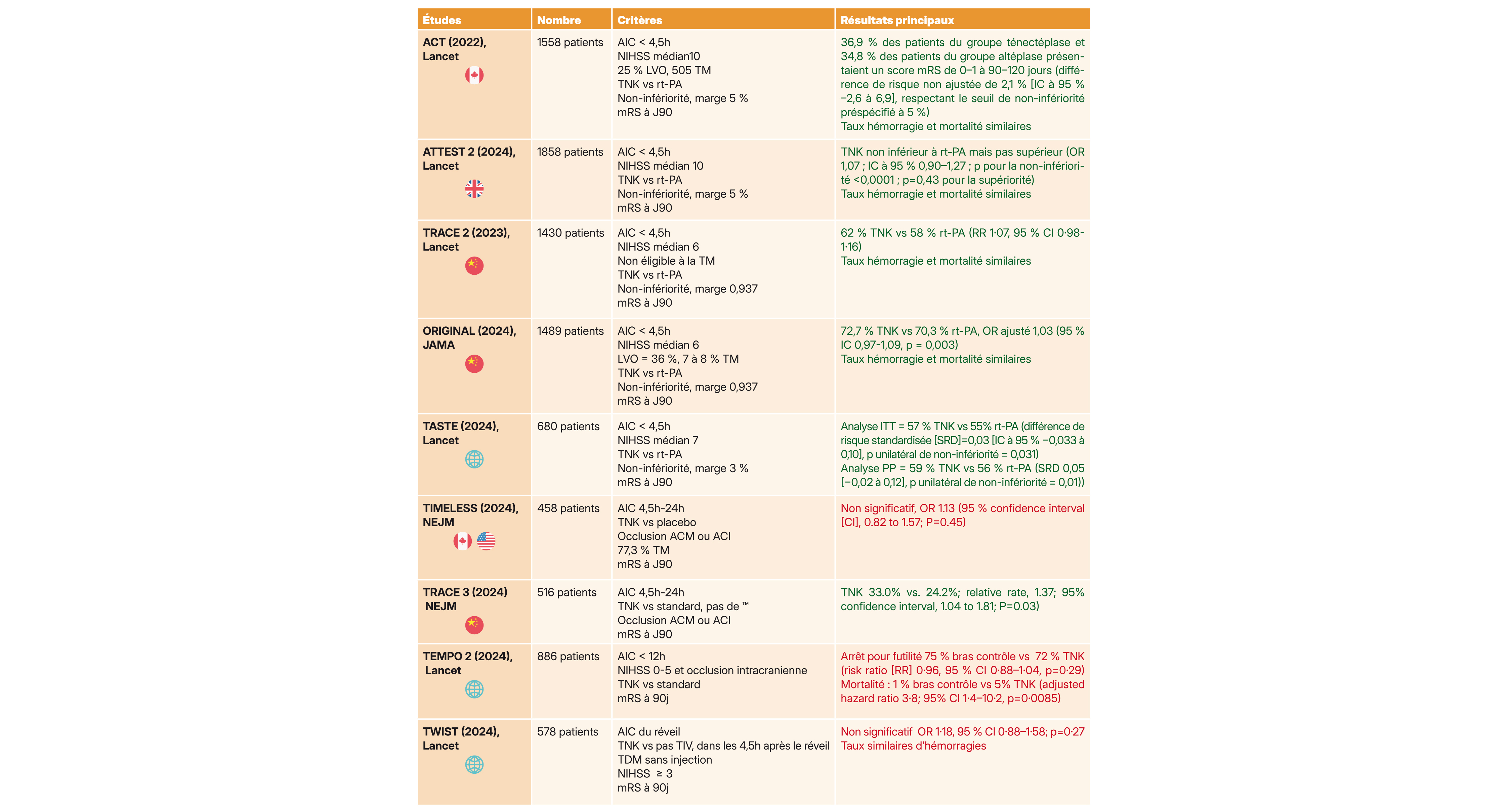
Voici les études récentes sur cette molécule :
Que disent les recommandations à propos de la Tenectéplase ? (ESOC 2023)
Pour AVC ischémiques de moins de 4,5 h du début des symptômes : l'utilisation de la Ténectéplase 0,25 mg/kg est aussi sécure et efficace que l'altéplase.
Pour les AVC ischémiques de moins de 4,5h du début des symptômes avec une occlusion d'un gros vaisseau : préférer Ténectéplase 0,25 mg/kg plutôt que l'alteplase, et ne pas retarder la thrombectomie mécanique.
Remarque avis d'experts : Dans un centre mother ship, si inférieure à 4,5h et obstruction des gros vaisseaux : réaliser la TIV avec Ténectéplase 0,25 ou 0,4 mg/kg. Si drip and ship (pas de centre de thrombectomie), réaliser TIV avec Ténectéplase 0,25 mg/kg avant le transfert rapide vers le centre de TM.
To be continued…
Rendez-vous au congrès de la SFNV du 19 au 21 novembre 2025, à Dijon !
Références
1 National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group. Tissue plasminogen activator for acute ischemic stroke. N Engl J Med 333, 1581–1587 (1995).
2. Hacke, W. et al. Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke. N Engl J Med 359, 1317–1329 (2008).
3. Effects of alteplase beyond 3 h after stroke in the Echoplanar Imaging Thrombolytic Evaluation Trial (EPITHET): a placebo-controlled randomised trial - PubMed. https://pubmed.ncbi.nlm.nih.gov/18296121/.
4. Nagakane, Y. et al. EPITHET: Positive Result After Reanalysis Using Baseline Diffusion-Weighted Imaging/Perfusion-Weighted Imaging Co-Registration. Stroke 42, 59–64 (2011).
5. Emberson, J. et al. Effect of treatment delay, age, and stroke severity on the effects of intravenous thrombolysis with alteplase for acute ischaemic stroke: a meta-analysis of individual patient data from randomised trials. Lancet 384, 1929–1935 (2014).
6. Thomalla, G. et al. MRI-Guided Thrombolysis for Stroke with Unknown Time of Onset. N Engl J Med 379, 611–622 (2018).
7. Ma, H. et al. Thrombolysis Guided by Perfusion Imaging up to 9 Hours after Onset of Stroke. N Engl J Med 380, 1795–1803 (2019).
8. Campbell, B. C. V. et al. Extending thrombolysis to 4·5-9 h and wake-up stroke using perfusion imaging: a systematic review and metaanalysis of individual patient data. Lancet 394, 139–147 (2019).
9. Nordt, T. K. & Bode, C. Thrombolysis: newer thrombolytic agents and their role in clinical medicine. Heart 89, 1358–1362 (2003).

Alexandra DUPIC
Interne en 3ème semestre Paris

Jérémy NEEL
Interne en 6ème semestre Amiens

