
La maladie de Parkinson est une maladie neurodégénérative caractérisée par la triade clinique tremblements de repos, rigidité plastique et bradykinésie. En l'absence de drapeaux rouges, le diagnostic est clinique. La thérapeutique actuelle est uniquement symptomatique. En première intention, un traitement par agoniste dopaminergique, IMAO-B ou Levodopa + Carbidopa est instauré (Tableau 1), permettant un bon contrôle de la symptomatologie pendant 4 à 6 ans (ce qu'on appelle la Lune de miel).
Malgré une gestion médicale optimale, la maladie progresse chez la majorité des patients avec notamment des fluctuations motrices, des dyskinésies, une instabilité posturale, de la dysautonomie, des troubles psychiatriques voire une démence…
Pour les patients avec des fluctuations et des dyskinésies sévères insuffisamment contrôlées par les thérapeutiques médicamenteuses, l'option chirurgicale est proposée.
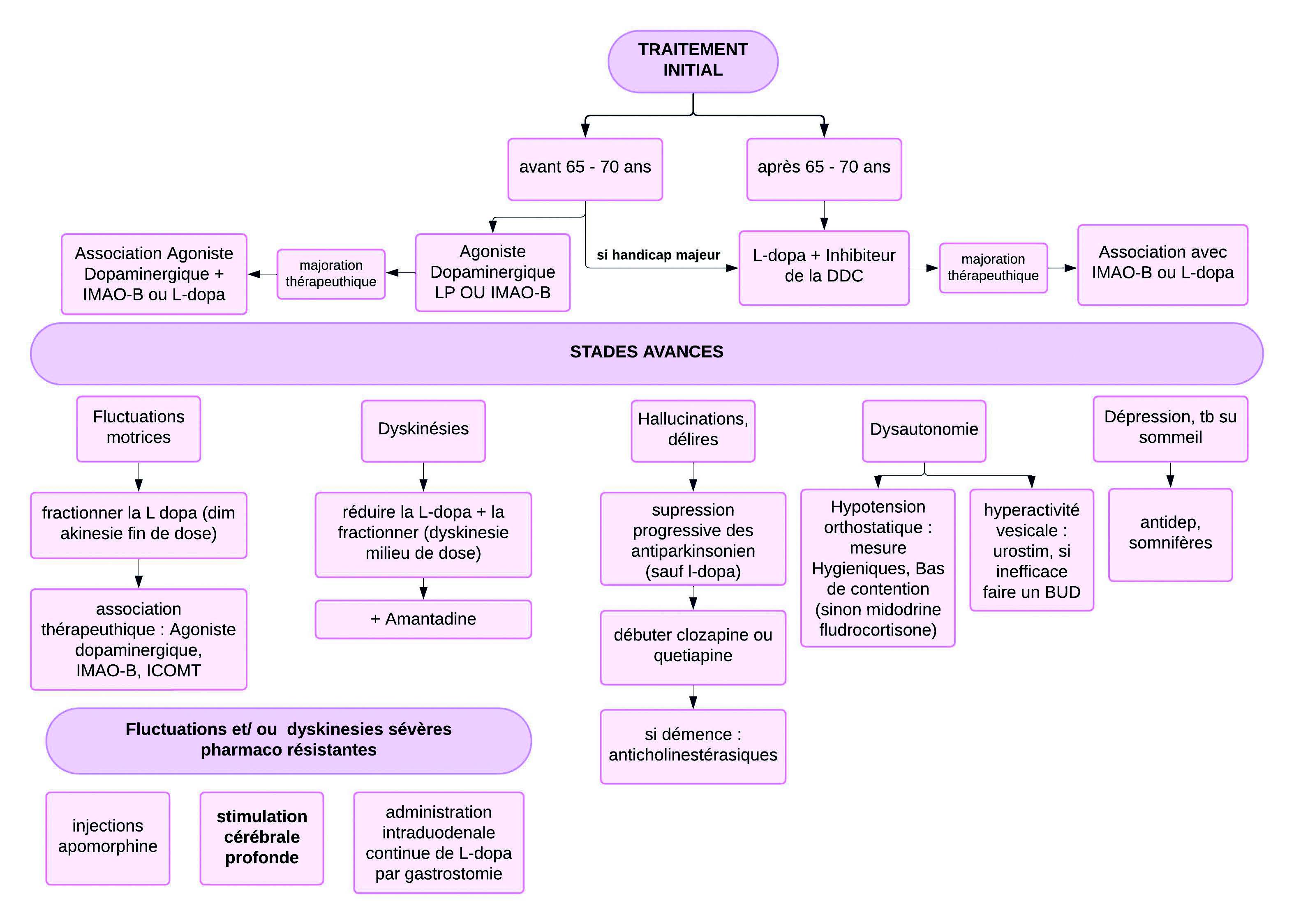
Schéma 1 : Arbre décisionnel pour les traitements de la maladie de Parkinson. (inspiré du chapitre maladie de Parkinson du Collège des enseignants de Neurologie).
Qu'est-ce que la stimulation cérébrale profonde (SCP) ?
La SCP est une chirurgie mini-invasive, elle n'engendre pas de destruction du tissu cérébral ; elle est réversible et peut être ajustée pour optimiser ses effets bénéfiques et diminuer les effets indésirables.
Le matériel est composé de :
• Deux électrodes implantées dans les structures profondes du cerveau. Elles sont chacune munies de 4 plots pour Medtronic ou 8 plots pour Boston (zones de contact avec le cerveau).
• Stimulateur électrique (1 ou 2) situé sous la peau au niveau de la clavicule et relié par des fils passés sous la peau aux électrodes intracérébrales. Il peut être rechargeable régulièrement comme un chargeur externe ou à batterie non rechargeable qui dure entre 3 et 5 ans (nécessitant une réintervention chirurgicale).
Le matériel récent est compatible avec l'IRM.
Le mécanisme exact de la stimulation reste inconnu.
La modalité de stimulation la plus utilisée, à haute fréquence, entraîne une inhibition fonctionnelle des structures ciblées (similaire à une lésion de ces structures).
Les structures stimulées dans la maladie de Parkinson sont détaillées dans le tableau 1.
Les stimulations des noyaux sous-thalamiques et du Globus pallidus sont globalement les deux sites privilégiés (avec plus d'indications pour le NST+++). Ils améliorent tous les deux les symptômes moteurs du patient ainsi que les fluctuations et dyskinésies.
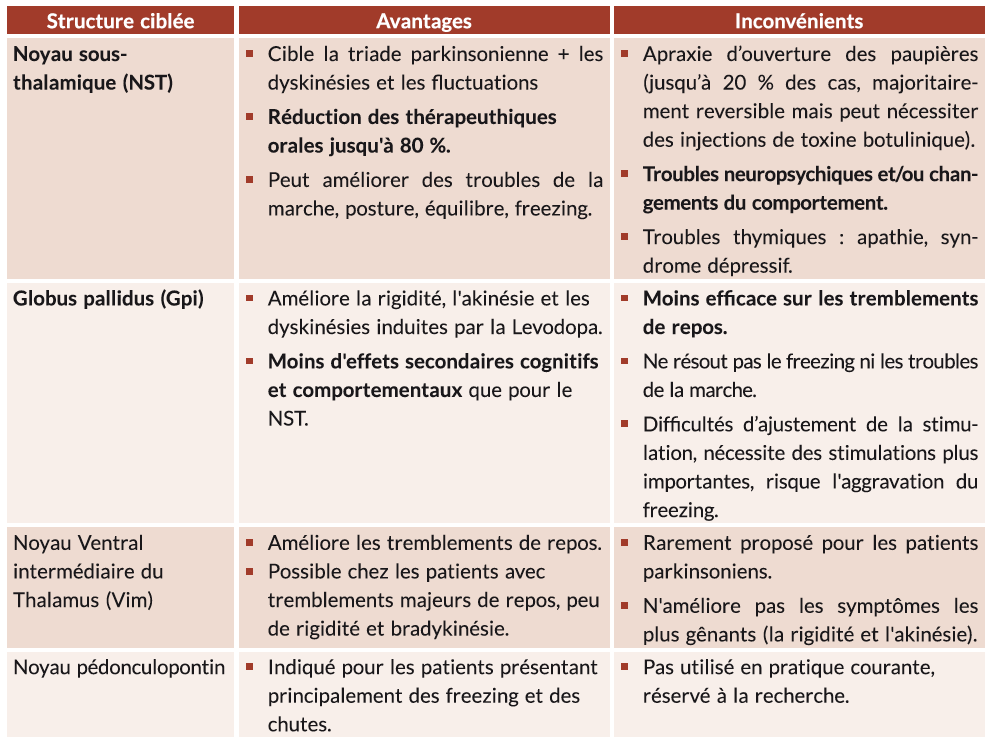
Tableau 1 : Avantages et inconvénients de la stimulation des différentes zones anatomiques ciblées par la stimulation cérébrale profonde.
Comment se déroule la chirurgie ?
La première étape de l'intervention consiste en l'installation d'un cadre de stéréotaxie, qui permet un repérage précis par imagerie IRM et scanner avant, pendant et après la chirurgie.
Selon les équipes, l'intervention est réalisée sous anesthésie locale en partie puis complétée par une anesthésie générale ou complètement sous anesthésie générale (grâce à la fiabilité des nouvelles méthodologies de repérage). Des électrodes temporaires sont placées pour enregistrer l'activité électrique des neurones, sous la supervision d'un neurophysiologiste. Ces électrodes permettent également de réaliser des stimulations électriques sur la zone cible, afin d'évaluer leur impact clinique sur les signes moteurs de la maladie.
Un faisceau d'arguments combinant les données radiologiques, électrophysiologiques et cliniques permet de déterminer la trajectoire optimale pour l'implantation des électrodes définitives.
Une fois l'électrode définitivement positionnée, elle est fixée au crâne par différents moyens, tels que des vis, des bouchons ou du ciment dentaire.
La deuxième phase de l'intervention, qui inclut l'implantation du boîtier de stimulation et sa connexion aux électrodes, est réalisée sous anesthésie générale. Dans certaines équipes cette phase est réalisée dans un second temps (quelques jours après s'être assuré de la stabilité de l'IRM de contrôle).
Le patient est ensuite surveillé pendant environ 1 à 2 semaines dans un service de neurologie pour un suivi post-opératoire. Selon les pratiques des équipes, les premiers réglages du stimulateur peuvent être réalisés soit dans la semaine suivant l'implantation, soit plusieurs semaines après.
Il est à noter que certains patients peuvent bénéficier d'une amélioration immédiate (en dehors de toute stimulation) en raison de l'effet lésionnel sur les noyaux gris (un phénomène observé lors des interventions chirurgicales ablatives, désormais abandonnées).
Le suivi est assuré les 3 premiers mois (selon les équipes une fois par semaine ou une fois par mois).
À 3 mois, une fois que l'effet lésionnel s'est estompé, on effectue un test des Plots (où on reprend les paramètres de tous les plots). À 12 mois est effectué un test à la Dopa post-opératoire (où on éteint la stimulation et on refait le test à la L-Dopa).
Il faut compter au minimum 3 mois et au maximum 1 an pour obtenir un équilibre des paramètres de stimulation.
Qui peut bénéficier de la stimulation cérébrale profonde ?
L'indication est discutée en staff pluridisciplinaire et les notions ci-dessous sont données à titre indicatif.
Elle est indiquée pour des patients atteints d'une maladie de Parkinson idiopathique, de moins de 70 ans, Dopa-sensible, au stade des complications motrices malgré un traitement médicamenteux optimisé, ayant un impact sur leur qualité de vie.
La Dopa sensibilité s'étudie lors d'une courte hospitalisation où un neurologue évalue le patient dans son état maximal d'efficacité (ON médicament) et minimum d'efficacité (OFFmédicament) après une augmentation de la dose matinale de L-Dopa de 150 %. (ou 120 % de L-Dopa + un agoniste selon les équipes).
En l'absence de :
En l'absence de :
• Signes axiaux sévères (troubles de déglutition, dysarthrie sévère, troubles de l'équilibre et de la marche non réversibles lors du test à la L-Dopa) ;
• D'altération cognitive : évaluation neuropsychologique pré chirurgicale (score Mattis supérieur à 136/144 et BREF supérieur à 15) ;
• De troubles psychiatriques évolutifs ;
• De lésions encéphaliques sur l'IRM présentant un sur-risque de complication implantatoires ;
• D'affection concomitante évolutive à moyen terme (cancer, insuffisance rénale ou hépatique sévère) ;
• De risque anesthésique (affections respiratoires, cardiaques sévères) ;
• De pathologie cutanée du cuir chevelu (risque infectieux).
Comment peut-on juger de l'efficacité de la SCP ?
On peut utiliser le score UPDRS (“off-medicine” Unified Parkinson Disease Rating Scale). C'est une échelle utilisée pour évaluer la gravité des symptômes de la maladie de Parkinson. Elle sert à suivre l'évolution de la maladie et à évaluer les effets des traitements.
En général on considère une réduction de 20 à 30 % du score comme jugement d'efficacité d'une thérapeutique (même si une réduction de moins de 20 % peut rester positive si le patient est amélioré sur le plan fonctionnel).
D'autres échelles existent, comme la PDSS (Parkinson Disease Sleep Scale) qui permet d'évaluer la qualité du sommeil et juger de son amélioration par la stimulation cérébrale profonde.
Quels sont les risques ?
Les risques chirurgicaux associés à la stimulation cérébrale profonde sont similaires à ceux d'autres interventions intracrâniennes.
Les événements indésirables graves, tels que l'aphasie, l'hémiparésie ou le coma, surviennent dans 1 à 2 % des cas. Le risque hémorragique est d'environ 3,9 % des patients, tandis que le risque infectieux varie de 3 à 5 %, pouvant dans certains cas nécessiter le retrait du matériel. La confusion post-opératoire est relativement fréquente, mais elle est généralement de courte durée et se résout rapidement. Le risque d'épilepsie est rare.
En outre, des dysfonctionnements du matériel peuvent survenir dans 4 à 25 % des cas, selon les études, et incluent des infections, des déplacements d'électrodes, des fractures d'électrodes, des dysfonctionnements du stimulateur et des érosions cutanées.
Des complications liées à la stimulation elle-même incluent la stimulation non intentionnelle des structures adjacentes, lorsque l'électrode est positionnée trop latéralement pour la stimulation du noyau sous-thalamique (NST) ou trop médialement pour le globus pallidus, entraînant une stimulation du faisceau cortico-spinal. Cela peut provoquer des contractures musculaires, ce qui oblige à réduire l'intensité de la stimulation, pouvant ainsi diminuer l'efficacité clinique du traitement.
Enfin, des effets indésirables spécifiques peuvent être observés en fonction de la stimulation de la structure ciblée (voir les inconvénients du tableau 1).
Sur quoi focalise la rééducation pour un patient traité par stimulation cérébrale profonde ?
Il est intéressant lors de la rééducation d'un patient ayant un traitement par stimulation cérébrale profonde de cibler les déficiences persistantes après un réglage optimal du stimulateur.
Par exemple, le freezing et les troubles posturaux ne sont généralement pas améliorés. Il serait intéressant de s'y focaliser par moyen de rééducation intensive, comme par exemple un programme LSVT BIG qui permettrait d'améliorer la marche, l'équilibre du tronc, les rotations.
Maria ZAKHEM
Relu par Dr Yara AHMAR
Bibliographie
1. Collège des enseignants de neurologie : collège second cycle : maladie de Parkinson.
2. Deep Brain Stimulation for Parkinson Disease: Overview, Mechanism of Action, Advantages and Disadvantages, Medscape Dec 9 2020.
3. Herrington, T.M., et al, 2016. Mechanisms of deep brain stimulation. J Neurophysiol 115, 19–38. https://doi.org/10.1152/jn.00281.2015
4. Bronstein, J.M., et al 2011. Deep Brain Stimulation for Parkinson Disease: An Expert Consensus and Review of Key Issues. Archives of Neurology 68, 165. https://doi.org/10.1001/archneurol.2010.260
5. Stimulation cérébrale profonde dans le traitement de la maladie de Parkinson - Encyclopædia Neurochirurgica [WWW Document], n.d. URL http://encyclopedia.neurochirurgica.org/m/spip.php?article20 (accessed 1.2.25).

