Introduction
La myocardite est une maladie inflammatoire du myocarde pouvant évoluer de manière aiguë ou chronique. Dans la majorité des cas, l’étiologie est secondaire à une infection virale, une iatrogénie ou à des toxiques. Dans de plus rare cas, elle est l’expression initiale de maladies systémiques, auto-immunes ou inflammatoires, et pourrait être un mode d’expression phénotypique de certaines cardiomyopathies arythmogènes, lui conférant un caractère clinique tout particulièrement hétérogène (1, 2).
En dépit des progrès récents des techniques d’imagerie, le diagnostic, la surveillance et le pronostic de ces patients restent difficiles à établir (3).
Nous allons voir comment l’IRM cardiaque se positionne au cours de la stratégie diagnostique d’une myocardite aiguë, et quels sont les paramètres qui peuvent nous aider à la stratification du risque d’évènements chez nos patients.
Contexte clinique
Après un interrogatoire et un examen clinique, un ECG, une échocardiographie et une biologie comprenant Troponine et CRP doivent être pratiqués à tout patient suspect de myocardite. En fonction de la probabilité pré-test, le bilan initial doit être complété par une coronarographie ou une imagerie anatomique ou fonctionnelle non invasive, dans le but d’exclure une coronaropathie obstructive (1). À ce stade, aucun examen de première ligne ne suffit seul pour faire le diagnostic (4).
La biopsie endomyocardique (BEM) est à ce jour le gold standard pour le diagnostic de myocardite (1). Reposant sur des critères histologiques, immunologiques et immunohistochimiques, elle permet d’identifier de manière direct le substrat pathologique.
Elle met alors en évidence un infiltrat inflammatoire myocardique associé à une dégénérescence myocytaire et une nécrose d’origine non ischémique. Elle permet également de préciser le type d’infiltrat cellulaire (lymphocytaire, éosinophilique, polymorphique, à cellules géantes ou granulomateux) et d’identifier le génome viral par RT-PCR afin de guider la stratégie thérapeutique sur une cible spécifique si nécessaire.
Cependant, en dépit de progrès techniques récent, la BEM reste confrontée à de nombreuses limites : Faux négatifs, technique invasive, nécessité d’une équipe expérimentée (5). De ce fait, son utilisation en routine n’est pas recommandée dans les cas de myocardite à faible risque, qui représentent jusqu’à 75 % des cas rencontrés en pratique clinique (1, 6, 7, 8).
Place de l’IRM cardiaque pour le diagnostic de myocardite
Introduction des critères de Lake Louise
Au cours des quinze dernières années, l’IRM est devenue un outil d’imagerie non invasif de référence pour la quantification des volumes, de la fraction d’éjection ventriculaire gauche (FEVG) et de la masse myocardique (8). Grâce à sa capacité unique de caractérisation des tissus myocardiques, elle a rendu le diagnostic de myocardite plus rapide et plus fiable, facilitant les stratégies diagnostiques et thérapeutiques. En fournissant des indices étiologiques précieux sur le myocarde, notamment en différenciant les causes ischémiques des causes non ischémiques, elle a permis d’éviter des procédures invasives chez de nombreux patients, telles que la coronarographie et la BEM (9). Par exemple, quand le tableau initial est celui d’un MINOCA, l’IRM cardiaque permet de redresser le diagnostic dans 33 % des cas (10).
En 2009 un premier consensus d’experts formalise le diagnostic de myocardite aiguë en IRM cardiaque en proposant trois cibles diagnostiques au sein du tissu myocardique (Figure 1) :
- L’oedème myocardique focal est dérivée de l’évaluation de l’intensité du signal en pondération T2 (séquences STIR) ;
- L’hyperhémie locale est évaluée par le rehaussement précoce (EGE) 2 minutes après injection de gadolinium ;
- Et la nécrose tissulaire par l’étude du rehaussement tardif (LGE) 10 minutes après injection de gadolinium.
Une forte probabilité de myocardite aiguë est retenue si deux des trois critères sont présents. La précision du diagnostic était alors estimée à 78 %, avec une sensibilité de 67 % et une spécificité de 91 % (9).
Figure 1 : Exemple de patient avec un diagnostic de myocardite aiguë A. Hypersignal T2-STIR sous épicardique en motte de la paroi latérale du VG B. Réhaussement tardif concordant au sein de la paroi latérale du VG révélant une myocardite aiguë
Les Critères de Lake Louise (LLC) ont par la suite été utilisés et validés par plusieurs études robustes, notamment deux méta-analyses récentes rapportant une précision diagnostique de 83 % pour l’identification des myocardites aiguës (sensibilité de 80 % et spécificité de 87 %) (11, 12).
En 2013, les recommandations de l’ESC suggère l’utilisation de l’IRM en recommandation de classe I pour la confirmation d’une atteinte myocardique (13).
Nouvelles techniques de cartographies et update des LLC Les mesures de l’intensité du signal en pondération T1 et T2 et l’étude du EGE ont toutefois montré certaines limites. Les artefacts d’acquisition liés aux longues apnées répétées et l’analyse visuelle, parfois subjective, de l’intensité du signal peuvent diminuer la capacité diagnostique de l’IRM cardiaque (3).
Les techniques de cartographies T1 et T2 ainsi que la quantification du volume extracellulaire (ECV) fournissent des données quantitatives sur les propriétés magnétiques des tissus. La mesure des temps de relaxation T1 et T2 du myocarde sont fonction de leurs caractéristiques intrinsèques, de leurs environnements, ainsi que du matériel (=hardware) et du logiciel (=software) utilisés pour l’acquisition (4). En éliminant la nécessité de se fier aux intensités relatives des signaux dans les régions d’intérêt d’une part, et en améliorant la qualité des acquisitions en fournissant des séquences en apnée plus courte d’autre part, les cartographies permettent ainsi de dépasser certaines limites des LLC (3).
De plus, les méthodes de cartographie peuvent détecter de manière plus fiable les changements tissulaires homogènes et diffus lors de l’évolution de la myocardite, que la caractérisation semi-quantitative seule. Les valeurs T1 et T2 sont sensibles aux modifications de la teneur en eau libre des tissus.
- Le temps T1 est augmenté en cas d’oedème ou de fibrose (<950–1150ms à 1,5T) ;
- Le temps T2 est augmenté en présence d’un oedème myocardique (<45–55ms) ;
- La cartographie en T2 natif permet une évaluation de l’inflammation aiguë de manière plus sensible par rapport au T2-STIR classiquement utilisé. Certaines études suggèrent que la cartographie T2
pourrait exclure l’inflammation avec une sensibilité allant jusqu’à 89 %, offrant ainsi la possibilité de faire la différence entre une myocardite active et chronique (15),
- La cartographie T1 avant et après injection, combinée avec la mesure de l’hématocrite, peut également être utilisée pour quantifier l’ECV qui est augmenté en cas d’oedème et de fibrose (<25 %),
- Un nouveau Consensus d’Expert publié en 2018 (Figure 2) ajoute ainsi ces nouveaux paramètres aux critères de Lake Louise de 2009 (3). Le diagnostic de myocardite aiguë peut désormais être posé sur la présence de :
- Au moins 1 critères de lésion myocardique non ischémique basé sur le T1 (cartographie T1, ECV ou LGE) ;
- ET au moins 1 critère d’oedème myocardique basé
sur le T2 (cartographie T2 ou imagerie pondérée en T2). De plus, l’altération de la FEVG, les anomalies de cinétique et l’épanchement péricardique sont considérés comme des critères ancillaires.
Figure 2 : IRM cardiaque pour le diagnostic de myocardite : Critères de Lake Louise originaux (panel du haut) puis Critères de Lake Louise modifiés en 2018 (panel du bas)
Le protocole d’acquisition d’IRM cardiaque est donc aujourd’hui standardisé (Figure 3).
Figure 3 : Protocole d’IRM cardiaque recommandé pour le diagnostic de myocardite
Cependant il existe plusieurs obstacles à la diffusion à large échelle de ces nouveaux paramètres. La difficulté de standardisation des protocoles d’acquisitions, d’interprétations et de post-traitement des images entre les différents centres sont le principal écueil actuel. De plus, des études de comparaison à l’histopathologie seront nécessaires pour comprendre et renforcer la solidité des preuves que peuvent apporter ces nouvelles séquences.
Optimisation de la valeur diagnostique : vers quelle association de paramètres ? À la lumière de l’étendue des paramètres IRM disponibles aujourd’hui, la recherche de la meilleure association diagnostique est nécessaire. Selon plusieurs études, les capacités diagnostiques des LLC ne semblent pas être réduites lorsque l’EGE est exclu de l’équation (14). De plus, certaines études suggèrent que l’utilisation d’une combinaison de la cartographie T2 et du LGE permet une précision diagnostique de 90 % (15, 16). Enfin, la performance diagnostique de la combinaison de deux techniques sans injection de produit de contraste (cartographie T1 et cartographie T2) serait de 86 %, pratique dans certaines situations cliniques où l’injection de gadolinium n’est pas possible (3).
Les prochaines années permettront probablement de préciser la meilleure association diagnostique de paramètres en IRM.
Innovations futures : comment améliorer encore notre capacité de diagnostic de myocardite en IRM cardiaque ?
Il est capital de souligner que la sensibilité de l’IRM cardiaque pour le diagnostic de myocardite est excellente, mais n’est pas parfaite. Ainsi, il est tout à fait possible qu’un patient présente une véritable myocardite qui pourrait être confirmée à l’aide d’une biopsie endomyocardique mais qui aurait une IRM cardiaque normale. C’est très rare mais ça existe !
Le monde de l’imagerie cardiovasculaire est probablement celui qui est le plus sujet aux innovations ces dernières années, avec en particulier en IRM cardiaque, le développement d’une nouvelle séquence de « rehaussement tardif 3D haute résolution » (Figure 4).
Cette séquence développée notamment au CHU de Bordeaux par le Pr Hubert Cochet et Aurélien Bustin, a récemment montré une meilleure sensibilité pour le diagnostic de MINOCA comprenant le diagnostic de myocardite. En effet, dans une étude récente publiée dans le JACC Cardiovascular Imaging, l’utilisation de cette nouvelle séquence permettait de réorienter le diagnostic dans 26 % des cas. L’inconvénient de cette séquence est qu’elle dure une dizaine de minutes environ à l’acquisition, contre moins de 3 minutes pour une séquence de rehaussement tardif traditionnelle.
Cependant les conséquences diagnostiques et thérapeutiques pour le patient sont majeures et ces études récentes poussent à la diffusion de ce type d’outils en routine clinique pour améliorer encore le pronostic de nos patients.
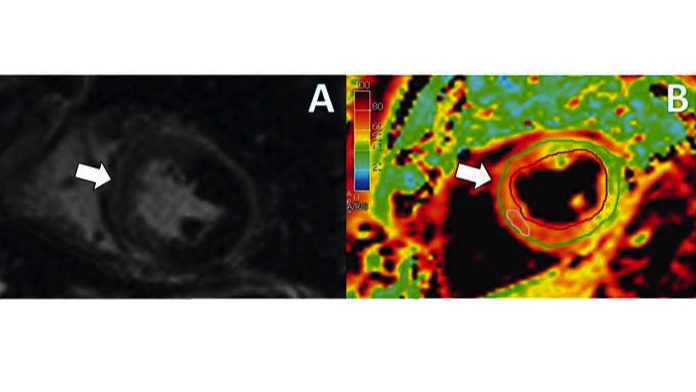
Figure 4 : IRM cardiaque de myocardite : réhaussement tardif de topographie non-ischémique (d’après Toupin S, et al. J Magn Reson Imaging. 2021)
Particularités du diagnostic de myocardite induite par une immunothérapie à check point inhibitor en IRM cardiaque
Il est essentiel de préciser que même si les données sur ces myocardites sont pour le moment, encore limitées, plusieurs séries rapportent une diminution de la sensibilité de l’IRM cardiaque pour le diagnostic précoce. En d’autres termes, il est fréquent d’avoir une IRM cardiaque normale dans les premiers jours d’évolution de ces myocardites bien particulières. Il ne faudra alors pas hésiter à répéter l’IRM cardiaque 7 à 15 jours après le début des symptômes, avec une apparition retardée des signes en IRM cardiaque (Figure 5).
Cependant, ces myocardites nécessitent un traitement rapide par corticoïdes en bolus intraveineux sur 3 jours, voire en cas de forme résistante, un traitement immuno- modulateur dédié. Il ne faudra donc pas attendre de répéter l’IRM cardiaque pour traiter ces patients.
À noter enfin, que les signes d’IRM cardiaque une fois présents, ne sont pas différents de ceux des autres types de myocardite.
Figure 5 : Exemple d’un diagnostic de myocardite aiguë chez une patiente récemment traitée par Immunothérapie
- Réhaussement tardif non-ischémique de la paroi septomédiane du VG
- Élevation du T2 Mapping de la paroi septomédiane du VG
Place de l’IRM cardiaque pour le pronostic de myocardite
Alors que plusieurs critères cliniques sont connus de longue date pour leur valeurs pronostiques péjoratives, notamment une classe haute NYHA ou une faible valeur de FEVG, la valeur pronostique des paramètres d’IRM cardiaque est plus récente (4). Parmi eux, la présence de rehaussement tardif au sein du myocarde est le prédicteur indépendant le plus puissant concernant la mortalité totale (HR à 8.4) et la mortalité cardiovasculaire (HR à 12.8) (17). Dans une méta-analyse, la présence de rehaussement tardif est associée à la survenue de trois fois plus d’évènements cardiovasculaires majeurs (MACE) que ceux sans rehaussement tardif (18). De plus, au-delà de sa présence, l’extension du rehaussement tardif indexée à la masse myocardique, la localisation antéroseptale, la distribution intra-myocardiaque et un profil patchy sont fortement corrélés à la survenue d’évènements cardiovasculaires (19, 20). Enfin, selon une étude récente, la progression dynamique du rehaussement tardif indexé à la masse myocardique serait un facteur de mauvais pronostic au cours du suivi (21).
À l’inverse, et de manière très intéressante, la normalité des paramètres d’IRM cardiaque est associée à un très faible risque de survenue d’évènements cardiovasculaires (19, 20, 22).
Plusieurs études sont en cours concernant la valeur pronostique des techniques de cartographies T1 et T2 ainsi que de l’ECV. L’augmentation de l’ECV > 35 % pourrait être un facteur indépendant de survenue d’évènements cardiovasculaires, y compris chez des patients atteints de myocardite sans présence de rehaussement tardif (23).
Conclusion
L’IRM cardiaque a aujourd’hui prouvé son rôle diagnostique incontournable, mais a également montré une valeur pronostique prometteuse dans la stratification du risque et le suivi de ces patients, notamment grâce à l’importance croissante des techniques de cartographies quantitatives. Les critères de Lake Louise mis à jour en 2018 constituent la principale approche diagnostique non invasive dans le contexte d’une suspicion de myocardite aiguë.
Cependant, compte tenu du large éventail de paramètres quantitatifs que propose l’IRM cardiaque, il sera nécessaire de s’entendre sur des normes spécifiques pour l’interprétation des images et le post-traitement des études afin de garantir une qualité et une reproductibilité des comptes-rendus.
Enfin, l’utilisation de nouvelles techniques modernes comme l’intelligence artificielle, la radiomique et l’analyse des textures, ouvriront probablement de nouvelles perspectives à l’avenir pour couvrir l’ensemble du spectre des myocardites, afin d’affiner le diagnostic et le pronostic de ces patients.
Références
- Caforio AL, et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2013 Sep;34(33):2636-48, 2648a-2648d. doi: 10.1093/eurheartj/eht210.
- Lopez-Ayala JM, et al. Genetics of myocarditis in arrhythmogenic right ventricular dysplasia. Heart Rhythm. 2015 Apr;12(4):766-73. doi: 10.1016/j.hrthm.2015.01.001.
- Ferreira VM, et al. Cardiovascular Magnetic Resonance in Nonischemic Myocardial Inflammation: Expert Recommendations. J Am Coll Cardiol. 2018 Dec 18;72(24):3158-3176. doi: 10.1016/j.jacc.2018.09.072.
- Eichhorn C, et al. Multiparametric Cardiovascular Magnetic Resonance Approach in Diagnosing, Monitoring, and Prognostication of Myocarditis. JACC Cardiovasc Imaging. 2022 Jul;15(7):1325-1338. doi: 10.1016/j.jcmg.2021.11.017.
- Stiermaier T, et al. Biventricular endomyocardial biopsy in patients with suspected myocarditis: Feasibility, complication rate and additional diagnostic value. Int J Cardiol. 2017 Mar 1;230:364-370. doi: 10.1016/j.ijcard.2016.12.103.
- Ammirati E, et al. Management of Acute Myocarditis and Chronic Inflammatory Cardiomyopathy: An Expert Consensus Document. Circ Heart Fail. 2020 Nov;13(11):e007405. doi: 10.1161/CIRCHEARTFAILURE.120.007405.
- Ammirati E, et al. Registro Lombardo delle Miocarditi. Clinical presentation and outcome in a contemporary cohort of patients with acute myocarditis: multicenter lombardy registry. Circulation. 2018;138:1088–1099. doi: 10.1161/CIRCULATIONAHA.118.035319
- Cooper LT, et al. The role of endomyocardial biopsy in the management of cardiovascular disease: a scientific statement from the American Heart Association, the American College of Cardiology, and the European Society of Cardiology. Endorsed by the Heart Failure Society of America and the Heart Failure Association of the European Society of Cardiology. J Am Coll Cardiol. 2007 Nov 6;50(19):1914-31. doi: 10.1016/j.jacc.2007.09.008.
- Friedrich MG, et al. Cardiovascular magnetic resonance in myocarditis: A JACC White Paper. J Am Coll Cardiol. 2009 Apr 28;53(17):1475-87. doi: 10.1016/j.jacc.2009.02.007.
- Agewall S, et al. ESC working group position paper on myocardial infarction with non-obstructive coronary arteries. Eur Heart J. 2017 Jan 14;38(3):143-153. doi: 10.1093/eurheartj/ehw149.
- Lagan J, et al. Clinical applications of multi-parametric CMR in myocarditis and systemic inflammatory diseases. Int J Cardiovasc Imaging. 2018 Jan;34(1):35-54. doi: 10.1007/s10554-017-1063-9.
- Kotanidis CP, et al. Diagnostic Accuracy of Cardiovascular Magnetic Resonance in Acute Myocarditis: A Systematic Review and Meta- Analysis. JACC Cardiovasc Imaging. 2018 Nov;11(11):1583-1590. doi: 10.1016/j.jcmg.2017.12.008.
- Adler Y, et al. 2015 ESC Guidelines for the diagnosis and management of pericardial diseases: The Task Force for the Diagnosis and Management of Pericardial Diseases of the European Society of Cardiology (ESC) Endorsed by: The European Association for Cardio- Thoracic Surgery (EACTS). Eur Heart J. 2015 Nov 7;36(42):2921-2964. doi: 10.1093/eurheartj/ehv318.
- Chu GC, et al. Assessment of acute myocarditis by cardiovascular MR: diagnostic performance of shortened protocols. Int J Cardiovasc Imaging. 2013 Jun;29(5):1077-83. doi: 10.1007/s10554-013-0189-7.
- Von Knobelsdorff-Brenkenhoff F, et al. Detection and Monitoring of Acute Myocarditis Applying Quantitative Cardiovascular Magnetic Resonance. Circ Cardiovasc Imaging. 2017 Feb;10(2):e005242. doi: 10.1161/CIRCIMAGING.116.005242.
- Luetkens JA, et al. Incremental value of quantitative CMR including parametric mapping for the diagnosis of acute myocarditis. Eur Heart J Cardiovasc Imaging. 2016 Feb;17(2):154-61. doi: 10.1093/ehjci/jev246.
- Grün S, et al. Long-term follow-up of biopsy-proven viral myocarditis: predictors of mortality and incomplete recovery. J Am Coll Cardiol. 2012 May 1;59(18):1604-15. doi: 10.1016/j.jacc.2012.01.007.
- Georgiopoulos G, et al. Prognostic Impact of Late Gadolinium Enhancement by Cardiovascular Magnetic Resonance in Myocarditis: A Systematic Review and Meta-Analysis. Circ Cardiovasc Imaging. 2021 Jan;14(1):e011492. doi: 10.1161/CIRCIMAGING.120.011492.
- Gräni C, et al. Prognostic Value of Cardiac Magnetic Resonance Tissue Characterization in Risk Stratifying Patients With Suspected Myocarditis. J Am Coll Cardiol. 2017 Oct 17;70(16):1964-1976. doi: 10.1016/j.jacc.2017.08.050. Erratum in: J Am Coll Cardiol. 2017 Nov 28;70(21):2736.
- Aquaro GD, et al. Cardiac MR With Late Gadolinium Enhancement in Acute Myocarditis With Preserved Systolic Function: ITAMY Study. J Am Coll Cardiol. 2017 Oct 17;70(16):1977-1987. doi: 10.1016/j.jacc.2017.08.044.
- Aquaro GD, et al. Prognostic Value of Repeating Cardiac Magnetic Resonance in Patients With Acute Myocarditis. J Am Coll Cardiol. 2019 Nov 19;74(20):2439-2448. doi: 10.1016/j.jacc.2019.08.1061.
- Schumm J, et al. Cardiovascular magnetic resonance risk stratification in patients with clinically suspected myocarditis. J Cardiovasc Magn Reson. 2014 Jan 26;16(1):14. doi: 10.1186/1532-429X-16-14.
- Gräni C, et al. Incremental value of extracellular volume assessment by cardiovascular magnetic resonance imaging in risk stratifying patients with suspected myocarditis. Int J Cardiovasc Imaging. 2019 Jun;35(6):1067-1078. doi: 10.1007/s10554-019-01552-6.
Auteur
Jeremy FLORENCE
Interne de Cardiologie,
CHU de Clermont Ferrand
Relecteur
Dr Théo PEZEL
CCA de Cardiologie en imagerie,
CHU Lariboisière, APHP, Paris
Article paru dans la revue « Le magazine des jeunes cardiologues - Collège des Cardiologues en Formation » / CCF N° 18

