Points forts et actualités dans le traitement
La cardiomyopathie hypertrophique (CMH) est la pathologie cardiaque d’origine génétique la plus fréquente avec une prévalence de 1/500 (1). Il s’agit de la principale cause de mort subite chez les athlètes aux Etats Unis (2). Dans 60 % des cas, la cause est une mutation des protéines sarcomériques (3).
La CMH est définie comme une cardiopathie avec épaississement pathologique de la paroi du ventricule gauche (VG) (> 15mm) ne pouvant être expliquée par des conditions de charge anormale (HTA, valvulopathie aortique,…) (3).
Par définition, une CMH est dite obstructive si le gradient intra-ventriculaire gauche maximal > 30 mmHg à l’échographie transthoracique (ETT) sur le flux doppler continu transaortique avec un aspect typique en lame de sabre (70 % des cas) (4).
Mesures générales
Certaines mesures doivent être prises en cas de CMH, notamment éviter toute situation de déshydratation, d’hypovolémie, de consommation excessive d’alcool. Les vasodilatateurs artériels ou veineux, tels que les dérivés nitrés ou les inhibiteurs des phosphodiestérases de type 5 sont également à proscrire car ils peuvent majorer le gradient.
Traitement médicamenteux
Dans un contexte de CMHO asymptomatique, l’objectif du traitement médicamenteux est de réduire les symptômes du patient en réduisant l’inotropisme et en diminuant la fréquence cardiaque afin d’accroître le remplissage diastolique (recommandations IIbC) (3).
Le traitement de base des patients ayant une CMH obstructive symptomatique repose sur les inotropes négatifs : les bétabloquants (Propranolol). En cas de contre-indication ou d’intolérance aux bétabloquants, les inhibiteurs calciques bradycardisants de type Verapamil ou Diltiazem sont prescrits afin d’améliorer les symptômes (3).
Actuellement un traitement est en cours d’étude chez les patients avec une CMHO symptomatique : il s’agit d’un modulateur de la myosine cardiaque, agent inotrope négatif puissant, Mavacamten (MyoKardia), qui entre actuellement en phase III de l’essai clinique EXPLORER–HCM. Il s’agit d’une étude multicentrique randomisée contre placebo, en double aveugle, qui vise une sélection de 220 patients présentant une CMHO symptomatique. Le critère de jugement principal évalué est la réponse clinique évaluée sur des critères de VO2max à 30 jours. Les résultats seront disponibles au second semestre 2020 (5).
Traitement invasif
Deux méthodes de réduction septale sont possibles : la chirurgie de myectomie septale ou l’alcoolisation septale au cours d’une coronarographie.
Les indications retenues pour une réduction septale invasive sont (3) :
- Obstruction de repos avec Gradient max > 50 mmHg avec NHYA ≥ III malgré un traitement médical optimal (IB).
- Syncope récidivante avec Gradient max > 50 mmHg malgré un traitement médical optimal (IIaC).
Si le gradient de repos reste compris entre 30 et 50 mmHg chez un patient symptomatique malgré un traitement médical optimal, une réduction septale invasive peut être envisagée (3).
Les interventions doivent être réalisées dans un centre expert avec des opérateurs expérimentés, après décision multidisciplinaire par une équipe experte en CMH (IC) (3).
Le choix de la technique de réduction septale est basé sur l’évaluation de la valve mitrale et de l’anatomie septale, il faut rechercher la présence d’un mouvement systolique antérieur de la valve mitrale (SAM), ou d’une anomalie mitrale autre, telle que l’insertion anormale des piliers.
Le SAM correspond à un contact entre la valve antéro- médiale de la valvule mitrale et le septum hypertrophié durant la systole ventriculaire. Il en résulte une obstruction dynamique de la chambre de chasse du ventricule gauche avec pour conséquence une gêne à l’éjection ventriculaire gauche et une insuffisance mitrale fonctionnelle d’importance variable (6).
Une plastie mitrale ou un remplacement valvulaire doit être envisagé chez les patients qui ont également une insuffisance mitrale (IM) moyenne à sévère, non due exclusivement au SAM causé par l’obstruction (prolapsus ou anomalie d’insertion des piliers ou cordages, par exemple) (IIa C) (3).
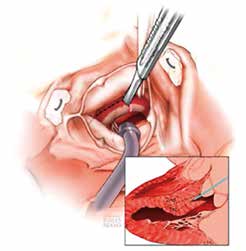
La myectomie chirurgicale
La myectomie chirurgicale est considérée comme le gold standard depuis des décennies. La levée de l’obstruction est réalisée par le retrait de 5 à 10 g de myocarde du septum basal par la procédure de Morrow.
La myectomie de Morrow est réalisée sous contrôle ETO peropératoire avec une attention particulière portée sur l’anatomie du septum et le fonctionnement de la valvule mitrale.
Une aortotomie de l’aorte ascendante est réalisée, puis les feuillets de la valvule aortique sont écartés, ce qui permet d’avoir une vue sur une large partie du septum hypertrophique et de guider sa résection. Deux myectomies, parallèles et distantes de 1 cm sont réalisées, et la couche intermédiaire de septum est ensuite réséquée. La résection permet de lever l’obstruction de la chambre de chasse du ventricule gauche. Plus récemment, une modification de l’opération de Morrow, appelée « myectomie étendue », a été développée. Il s’agit d’une résection étendue vers l’apex du ventricule gauche, en tout cas jusqu’au niveau de la base des muscles papillaires, à laquelle une plastie ou prothèse de la valve mitrale est associée (6).
Lors du 6e congrès international sur la CMH à Boston en 2017, trois arguments forts ont été mis en avant en faveur de la myectomie chirurgicale réalisée dans les centres très expérimentés :
- Le faible risque opératoire (0,3 %),
- Normalisation de la FEVG chez 90 à 95 % des patients,
- Le bénéfice sur la survie au long cours et une baisse probable du risque de mort subite (5).
L’alcoolisation septale
L’alcoolisation septale est une technique moins invasive que la myomectomie chirurgicale. En accord avec les recommandations de 2011 de l’ACC/ AHA, cette procédure reste réservée aux patients qui nécessitent une alternative au traitement chirurgical dû à un âge avancé ou à de nombreuses comorbidités, et dont l’anatomie coronaire permet le geste d’alcoolisation (1).
Cependant, malgré les différents arguments cités au sommet tenu à Boston, l’alcoolisation septale est souvent privilégiée en France en pratique clinique dans les centres expérimentés de par sa facilité d’accès et ses bons résultats en terme de mortalité post opératoire.
C’est Sigwart et al. qui ont proposé cette méthode pour la première fois en 1995. Le concept de l’alcoolisation septale est de provoquer un infarctus au niveau de la zone septale sous-aortique épaissie responsable de l’obstruction, de telle sorte que la zone infarcie s’amincisse après nécrose des myocytes. Cela permettant un élargissement de la chambre de chasse du VG, ainsi qu’une diminution du gradient obstructif (9).
La première étape consiste à réaliser une coronarographie, afin de juger de la faisabilité de la technique. La coronarographie est couplée à la réalisation d’une ETT afin de bien préciser la zone vascularisée par l’artère qui sera alcoolisée. En effet on réalise une opacification coronaire avant toute alcoolisation en injectant du produit de contraste dans la 1ère artère septale de l’IVA. L’ETT met alors en évidence un blanchiment du septum sous-aortique dans le territoire de l’artère injectée (10,11). Cette étape permet d’identifier exactement l’étendue du territoire vascularisé par l’artère et permet ainsi d’éviter d’alcooliser un territoire au-delà de la zone septale sous-aortique.
Une fois que l’artère cible a été repérée, elle est cathétérisée avec injection lente d’alcool (1 à 2 cc) sur 5 à 10 minutes, avec une surveillance permanente de l’aspect ECG (9).
On précisera que les conditions suivantes nécessiteront la mise en place d’une SEES temporaire : QRS larges, BAV1, HBAG avant la procédure, ou alors élargissement des QRS lors du monitoring ECG au cours de l’injection d’alcool.
L’efficacité de l’alcoolisation est confirmée sur :
- La coronarographie : l’aspect de NO-REFLOW au niveau de l’artère septale alcoolisée : absence de flux dans l’artère septale alcoolisée,
- L’échographie post-procédure : diminution du gradient ≥ 50 % ou inférieur à 30 mmHg.
Le taux de CPK post-procédure (> 1200 UI/ml) est un bon critère de succès (13). Néanmoins, il est parfois nécessaire d’attendre 8 à 12 semaines, voire plus, pour juger de l’efficacité de l’alcoolisation septale (9).
Les complications de l’alcoolisation septale sont le bloc atrio-ventriculaire (BAV) complet (environ 10 %), la dissection coronaire (<1 %), la tachycardie ou fibrillation ventriculaire (1 %), l’épanchement péricardique ou la tamponnade causée par la SEES (<1 %) et les complications vasculaires au point de ponction (<1 % avec l’abord radial) (13).
Technique de l’alcoolisation septale
Le MITRA-CLIP®
Cette intervention consiste à poser un clip qui réunit les feuillets de la valve mitrale afin de corriger le défaut de fermeture et de réduire le reflux de sang du ventricule gauche vers l’oreillette gauche.
Certaines équipes développent l’utilisation du MITRA-CLIP® chez les patients porteurs de CMHO associé à un SAM.
Le traitement de la CMHO par MITRACLIP comme traitement de première ligne a été étudié par l’équipe de Sorajja et al. chez 6 patients récusés de la myectomie septale, présentant une CMHO symptomatique avec élongation de la valve mitrale associée à une IM au moins moyenne et un SAM. Chez les 6 patients de l’étude, il est à noter 1 tamponnade ayant nécessité l’arrêt de la procédure, et 5 patients avec suppression du SAM, réduction du gradient per-opératoire (91 ± 44 vs. 12 ± 6 mmHg ; p=0,007), diminution du grade de l’IM et amélioration du débit cardiaque, justifiant la nécessité de poursuivre l’étude dans une population plus large (14).
Ablation par radiofréquence
Quelques centres ont testé l’application de la radiofréquence comme alternative à l’alcoolisation septale pour réduire l’épaisseur septale et l’obstruction (ERASH), avec de bons résultats sur la réduction du gradient et l’amélioration des symptômes (16,17).
La stimulation double chambre
La stimulation double chambre avec délai atrio-ventriculaire court est envisagée chez les patients chez qui les principales thérapies de réductions septales sont contre indiquées (IIb C) (3).
Elle est proposée également en cas d’indication à un DAI (double chambre au lieu de simple), afin de faciliter le traitement par bêtabloquants et de réduire le gradient (IIb C) (3).
Conclusion
Ainsi, même si pour le moment seules la myectomie chirurgicale et l’alcoolisation septale (en cas d’échec du traitement médical) figurent en bonne place dans les recommandations européennes (2014) et américaines (2011), de nouvelles thérapeutiques se développent pour les patients atteints de CMHO avec pour certaines, de bons résultats sur le plan clinique et échocardiographique.
Références bibliographiques
- American College of Cardiology Foundation/American Heart Association Task Force on Practice, American Association for Thoracic Surgery, American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, et al. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Thorac Cardiovasc Surg. déc 2011;142(6):e153-203.
- Maron BJ, Harris KM, Thompson PD, Eichner ER, Steinberg MH. Eligibility and Disqualification Recommendations for Competitive Athletes With Cardiovascular Abnormalities: Task Force 14: Sickle Cell Trait: A Scientific Statement From the American Heart Association and American College of Cardiology. J Am Coll Cardiol. 1 déc 2015;66(21):2444‑6.
- Authors/Task Force members, Elliott PM, Anastasakis A, Borger MA, Borggrefe M, Cecchi F, et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J. 14 oct 2014;35(39):2733‑79.
- Maron MS, Olivotto I, Zenovich AG, Link MS, Pandian NG, Kuvin JT, et al. Hypertrophic cardiomyopathy is predominantly a disease of left ventricular outflow tract obstruction. Circulation. 21 nov 2006;114(21):2232‑9.
- Maron BJ, Maron MS. Summary of Presentations and Discussions of Hypertrophic Cardiomyopathy at the 2018 Boston International Summit VI Including Consensus, Controversies, and Unmet Needs. Am J Cardiol. 4 juill 2018; Le reste des références bibliographiques est disponible en ligne sur le site du CCF.
Article paru dans la revue “Collèges des Cardiologues en Formation” / CCF N°6

