Prolapsus valvulaire mitral arythmique
Introduction
Le prolapsus valvulaire mitral (PVM) est l’anomalie valvulaire la plus fréquente dans les pays occidentaux, avec une prévalence estimée à 2,4 % de la population (1). En l’absence de fuite mitrale significative associée et ses conséquences atriales et ventriculaires gauches, le PVM est généralement de bon pronostic, avec une survie comparable à la population générale (2). Cependant, il existe un sous-groupe de patients porteurs de PVM sans fuite significative à risque plus élevé d’arythmies ventriculaires et de morts subites, dont la prévalence est estimée à 0,2-0,4 % par an (3-6). Dans ce contexte, une disjonction annulaire mitrale, ou MAD en anglais, est une caractéristique phénotypique fréquemment associée, et observée en échographie (7). Elle se définie par un détachement de l’anneau mitral postérieur du myocarde ventriculaire gauche sous-jacent, et est à l’origine d’un mouvement anormal de l’anneau mitral en systole appelé curling.
L’évaluation rapprochée de ces patients au cours des dernières années a permis de déterminer des facteurs prédictifs de la survenue de ces évènements rythmiques, et une approche multidisciplinaire aura pour intérêt la stratification de leur risque de mort subite et sa prévention.
Définitions et critères diagnostiques
Prolapsus valvulaire mitral
Il se définit comme le déplacement systolique de la grande et/ou de la petite valve(s) mitrale(s) de ≥ 2 mm au-dessus du plan de l’anneau (vers l’oreillette gauche) (8).
On en distingue deux principales étiologies :
- D’une part, la dégénérescence fibroélastique, la plus fréquente, caractérisée par un amincissement des cordages avec forte probabilité de rupture, à l’origine de prolapsus et d’insuffisance mitrale.
- D’autre part, la dégénérescence myxoïde, ou maladie de Barlow, caractérisée par un excès de tissus, incluant un épaississement des cordages, une dilatation annulaire et des calcifications, avec une probabilité faible de rupture.
Néanmoins, il faut souligner qu’il existe entre ces deux formes typiques, un large éventail de cas intermédiaires réunissant seulement une partie de ces caractéristiques.
Disjonction annulaire mitrale
Elle correspond à la séparation systolique entre le myocarde du ventricule gauche, et l’anneau mitral postérieur. On observe alors une perte de fonction mécanique de l’anneau (qui ne s’ancre plus sur le ventricule gauche), mais pas de sa fonction électrique « d’isolant » entre les oreillettes et les ventricules.
Elle ne peut pas s’observer en avant de l’anneau mitral à cause du continuum fibroélastique que constitue l’insertion des valves mitrale et aortique. Latéralement, elle peut néanmoins s’étendre de façon variable.
Le mouvement caractéristique de ce glissement de l’anneau en systole est nommé « curling ».
Son diagnostic repose donc sur une évaluation dynamique, en coupe 3 cavités en échocardiographie ou en IRM, permettant également d’en déterminer son amplitude maximale.
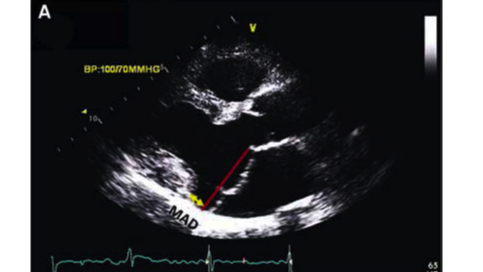
D’après Sabbat A, Essayagh B, Ramirez Barrera JD, et al. EHRA expert consensus statement on arrhythmic mitral valve prolapse and mitral annular disjunction complex in collaboration with the ESC Council on valvular heart disease and the European Association of Cardiovascular Imaging endorsed by the Heart Rhythm Society, by the Asia Pacific Heart Rhythm Society, and by the Latin American Heart Rhythm Society. EP Europace, 2022.
A = coupe échographique parasternale grand axe en télésystole, permettant de définir le prolapsus de la valve mitrale antérieure et postérieure au-delà du plan de l’anneau (en rouge) ; et la disjonction annulaire mitrale (MAD, en jaune).
B = coupe IRM en séquence Ciné, coupe grand axe 3 cavités, en télésystole, permettant de définir le prolapsus de la valve mitrale antérieure et postérieure au-delà du plan de l’anneau (en rouge) ; et la disjonction annulaire mitrale (MAD, en jaune).
Prolapsus de valve mitrale arythmique (PVMA)
C’est un phénotype particulier de PVM défini par l’association d’un prolapsus valvulaire mitral (+/- d’une disjonction de l’anneau mitral) et de troubles du rythme ventriculaires (9).
Le diagnostic est posé par l’association :
- D’un prolapsus valvulaire mitral, touchant l’un ou les deux feuillets valvulaires, avec ou sans disjonction annulaire ;
- Et d’une arythmie ventriculaire considérée comme :
- Fréquente (charge ≥ 5 % des battements cardiaques totaux sur 24 heures) ;
- Ou Complexe (tachycardie ventriculaire non soutenue (TVNS), tachycardie ventriculaire (TV), ou fibrillation ventriculaire (FV)) ;
- En l’absence d’autre cause expliquant l’arythmie.
Se distinguent alors 2 phénotypes principaux de la maladie, parmi le large spectre correspondant à cette définition.
Insuffisance mitrale sévère dégénérative
Quelle que soit la morphologie valvulaire et de façon indépendante à celle-ci, elle sera à l’origine d’un excès de mortalité et de mort subite (2, 10). Certains facteurs de risque vont encore augmenter cette incidence : la présence de symptômes sévères (notamment de syncope), une fibrillation atriale, ou une altération de la FEVG.
Son traitement consiste en la correction chirurgicale de cette insuffisance mitrale sévère, de façon similaire à n’importe quelle autre valve mitrale fuyante. Il permettra de normaliser l’excès de risque de mortalité, et le risque de mort subite.
Prolapsus valvulaire myxoïde marqué
Ce phénotype est, lui, indépendant de la sévérité de l’insuffisance mitrale, et sa mortalité sera similaire à celle de la population générale (sans IM sévère ni altération de la FEVG) (10).
Morphologiquement, la valve est d’allure myxoïde marquée, très redondante, avec un excès de longueur et d’épaisseur, parfois associée à la présence de piliers bifides.
On décrit également dans ce phénotype la présence d’une disjonction annulaire mitrale associée.
Chez les patients présentant PVM et disjonction annulaire, la hauteur de l’anneau, et le ratio hauteur / largeur de la commissure vont diminuer, entraînant un aplatissement paradoxal de l’anneau en systole et une augmentation de son diamètre.
L’insuffisance mitrale, secondaire à cette anomalie morphologique, peut varier en termes d’intensité, de totalement absente à sévère.
Ce phénotype est associé de façon significative à la survenue d’arythmies ventriculaires, de façon indépendante au sexe et à l’âge du patient, à la sévérité de l’IM, à la FEVG, et à la présence de pilier bifide (11).
Physiopathologie
La physiopathologie retenue pour ce tableau phénotypique (hypothèse de Padua) met les anomalies morphologiques à l’origine de la cascade d’évènements menant aux troubles du rythme ventriculaires.
La disjonction annulaire mitrale et son mouvement de curling, donnant l’augmentation paradoxale du diamètre de l’anneau en systole, et la dégénérescence myxoïde progressive des feuillets, entraînent l’étirement du myocarde ventriculaire gauche dans son segment inféro-basal et des piliers mitraux, résultant en l’apparition progressive de fibrose dans ces zones, consécutives à des réactions apoptotiques.
La genèse des arythmies ventriculaires dans le prolapsus valvulaire mitral est probablement liée à la combinaison entre ce substrat, la fibrose localisée ; et le facteur déclenchant, les étirements mécaniques qui sont à l’origine d’activités déclenchées ; bien que ces hypothèses résultent d’études d’un nombre très limité de cas (5, 7, 12).
D’après Basso C, Iliceto S, Thiene G, Perazzolo Marra M. Mitral valve prolapse, ventricular arrhythmias, and sudden death. Circulation 2019;140:952–64. Physiopathologie des arythmies ventriculaires chez les patients porteurs de PVM : combinaison entre facteurs déclenchants mécaniques et substrats anormaux (hypothèse de Padua).
Déterminants de l’arythmie ventriculaire
Certaines caractéristiques retrouvées lors de l’évaluation des patients porteurs de ce phénotype vont permettre d’estimer le risque de survenue de trouble du rythme ventriculaire.
Sur l’électrocardiogramme
De la même façon que pour la survenue des arythmies ventriculaires, les anomalies ECG retrouvées sont probablement secondaires à l’étirement anormal des muscles papillaires et du myocarde adjacent, bien que cela ne soit pas prouvé à ce jour. La fibrose qu’il entraîne serait elle-même à l’origine de troubles de la repolarisation et d’un raccourcissement du potentiel diastolique de repos.
Il en résulte sur l’électrocardiogramme de surface :
- Des ondes T négatives ou biphasiques dans les territoires inférieur et latéral.
- Un allongement du QT.
Les patients ayant présenté des arythmies ventriculaires au cours de leur suivi présentaient de façon significative ces modifications de l’ECG de surface (11).
L’arythmie ventriculaire va se manifester fréquemment par la survenue d’extrasystoles ventriculaires (ESV), de tachycardies ventriculaire non-soutenues (TVNS) ; ou a maxima, mais de façon heureusement plus rare, par une tachycardie ventriculaire (TV) soutenue ou une fibrillation ventriculaire, alors responsable de mort subite.
L’analyse de la morphologie des ESV va permettre de définir leur origine, qui se situe préférentiellement au niveau de l’appareil valvulaire mitral. Les ESV et les arythmies ventriculaires secondaires à ce prolapsus mitral seront ainsi plutôt de retard droit.
Il faudra ensuite déterminer si elles proviennent des piliers mitraux antérieur ou postérieur, ou de l’anneau mitral en lui-même, dans sa partie antérieure ou postérieure.
L’origine la plus fréquente est le pilier mitral postérieur, devant le pilier mitral antérieur et l’anneau mitral en lui-même (13).
D’après Sabba, A, Essayagh B, Ramirez Barrera JD, et al. EHRA expert consensus statement on arrhythmic mitral valve prolapse and mitral annular disjunction complex in collaboration with the ESC Council on valvular heart disease and the European Association of Cardiovascular Imaging endorsed by the Heart Rhythm Society, by the Asia Pacific Heart Rhythm Society, and by the Latin American Heart Rhythm Society. EP Europace, 2022. Exemples typiques d’ESV provenant de l’appareil mitral. PPM = muscle papillaire postérieur ; APM = muscle papillaire antérieure ; AMA = anneau mitral antérieur ; PMA = anneau mitral postérieur.
Sur l’échocardiographie
L’analyse de la morphologie de la valve est essentielle car directement corrélée au pronostic rythmique (7, 11).
D’une part, de façon indépendante, la présence d’une disjonction annulaire mitrale est associée à une probabilité presque 3 fois plus importante de présenter une arythmie ventriculaire. Elle sera d’autant plus importante que la taille du MAD sera grande (11).
D’autre part, le MAD en lui-même est associée à un PVM plutôt bi-valvulaire (bien que le caractère bi-valvulaire du prolapsus ne soit pas en lui-même associé à une surmortalité (11), avec des feuillets plus longs et plus redondants. Ces valves myxoïdes, seront ellesmêmes beaucoup plus fréquemment associées à la survenue de troubles du rythme ventriculaire (7).
De plus, les patients avec MAD présentent des ventricules plus dilatés par rapport à ceux sans MAD (7).
Ces caractéristiques sont les seules associées statistiquement à la présence de la disjonction annulaire et confirment donc que ce phénotype est indépendant de l’importance de la fuite mitrale dans la survenue des troubles du rythme ventriculaire, et qui le plus souvent n’est pas significative.
D’après Essayagh B, et al. The Mitral Annular Disjunction of Mitral Valve Prolapse - Presentation and Outcome. JACC, 2021. Echographie transthoracique en coupe parasternale grand axe en télé-systole présentant un PVM sans DAM (A) et avec DAM (B), sans IM (C) et avec IM sévère (D).
Sur l’IRM
L’IRM cardiaque, bien qu’elle ne fasse pas encore partie de l’évaluation systématique de l’IM dégénérative (14, 15), est un outil d’aide diagnostique et pronostique essentiel dans notre pratique quotidienne.
Elle permettra une évaluation morphologique et dynamique précise du phénotype de prolapsus valvulaire mitral arythmique.
Il faudra y recourir lorsque l’échographie ne permet pas une évaluation suffisante, ou qu’un patient présente une syncope inexpliquée et/ou une TVNS avec prolapsus valvulaire mitral (9), pour la recherche de zone de fibrose, pouvant être à l’origine des troubles du rythme ventriculaires.
Cette étude se réalise grâce aux séquences de réhaussement tardif (hypersignal localisé d’allure sous endocardique, voire transmural), ainsi qu’au séquences de relaxométrie (élévation des relaxométries T1 et du volume extra-cellulaire).
D’après Sabba A, Essayagh B, Ramirez Barrera JD, et al. EHRA expert consensus statement on arrhythmic mitral valve prolapse and mitral annular disjunction complex in collaboration with the ESC Council on valvular heart disease and the European Association of Cardiovascular Imaging endorsed by the Heart Rhythm Society, by the Asia Pacific Heart Rhythm Society, and by the Latin American Heart Rhythm Society. EP Europace, 2022.
Coupe IRM en séquence de réhaussement tardif, coupe petit axe médian, montrant une fibrose inféro-latéro-médiane ainsi que du pilier mitral postérieur en hypersignal.
Comment stratifier le risque de mort subite ?
L’arythmie ventriculaire et le risque de mort subite étant plus fréquents chez les patients porteurs de prolapsus valvulaire mitral, il est donc important de l’étudier chez chaque patient porteur d’un PVM.
Bien que les symptômes classiquement décrits chez les patients porteurs de PVMA sont les palpitations, la douleur thoracique et la dyspnée ; la survenue de symptômes plus graves tels que des syncopes est prédictive de mort subite et nécessite de plus amples investigations (13).
De plus, en dehors des différentes caractéristiques phénotypiques retrouvées en ECG, ETT et IRM, la présence d’antécédents familiaux sera un marqueur de risque important de mort subite.
Le dépistage des arythmies ventriculaires secondaires au PVM sera essentiel dans le suivi des patients. Il sera basé sur :
- La réalisation régulière de Holter des 24h, dont la fréquence sera fonction des caractéristiques phénotypiques présentes, et des troubles du rythme dépistés ;
- L’implantation d’un Holter implantable (type REVEAL) chez les patients présentant des TV considérées non à haut risque, des syncopes inexpliquées et/ ou de multiples caractéristiques phénotypiques marqueurs d’un risque plus élevé. Les arythmies ventriculaires dépistées pourront être classées en fonction du risque de mort subite qu’elles entraînent en 3 groupes :
- Risque élevé : TV soutenue, TVNS polymorphe ou TVNS monomorphe rapide avec une fréquence > 180/min ;
- Risque intermédiaire : TV ou TVNS monomorphe entre 120 et 179/min, ESV fréquentes ou complexes (bigéminées, couplées…) avec une charge ≥ 5 % ;
- Risque faible : ESV < 5 %.
Bien que de survenue plus rare, les patients présentant des troubles du rythme considérés comme sévère vont avoir un risque de mortalité trois fois supérieur à ceux ne présentant pas d’arythmie (11).
D’après Essayagh B, Sabbag A, Clémence A, et al. Presentation and Outcome of Arrhythmic Mitral Valve Prolapse. JACC, 2020. Classification des arythmies ventriculaires en fonction de leur sévérité et mortalité associée. PVC = extrasystole ventriculaire ; VT = tachycardie ventriculaire.
Gestion thérapeutique
Place du traitement médicamenteux
La gestion thérapeutique du prolapsus valvulaire mitral arythmique reste limitée sur le plan médical en l’absence d’essais randomisés sur le sujet. L’objectif du traitement médicamenteux sera d’une part l’amélioration des symptômes (notamment des palpitations), et d’autre part l’amélioration de la survie (par réduction de la survenue d’arythmies ventriculaires).
Il repose sur la prescription de Bêtabloquants et de Vérapamil pour l’amélioration des symptômes. En cas de survenue de cardiopathie rythmique, la prescription de traitements anti-arythmiques, comme l’Amiodarone ou le Sotalol, pourra être envisagée.
Enfin, il ne faudra pas négliger les traitements habituels de l’insuffisance cardiaque, en cas d’altération de la FEVG, et de l’insuffisance mitrale.
Prévention du risque de mort subite : la place du défibrillateur automatique implantable (DAI)
Bien qu’il ait montré un intérêt indiscutable chez les patients porteurs d’une cardiopathie à FEVG altérée < 35 % malgré la titration des médicaments de l’insuffisance cardiaque en prévention primaire, ainsi qu’en prévention secondaire dans les suites d’un trouble du rythme ventriculaire grave, la place du défibrillateur automatique implantable dans le cadre du PVMA est beaucoup plus discutable en prévention primaire.
La stratification du risque abordée ci-dessus sera essentielle dans la prévention primaire des patients et la décision d’implantation d’un DAI (9).
Seront candidats à l’implantation d’un défibrillateur, les patients porteur de prolapsus valvulaire mitral ayant présenté :
- Une syncope inexpliquée et de la TV soutenue (de morphologie compatible avec une origine mitrale) sur le monitoring ;
- Une syncope inexpliquée et de la TVNS sur le monitoring.
Enfin, le DAI pourra être envisagé chez les patients ayant présenté sur le Holter de l’arythmie ventriculaire à haut risque, s’ils présentent par ailleurs 2 caractéristiques phénotypiques à risque (cf. ci-dessus).
Prévention du risque de mort subite : la place de l’ablation de l’arythmie ventriculaire
Les indications d’ablation de troubles du rythme ventriculaires sont indépendantes du phénotype de PVM (9).
Il est nécessaire de l’envisager devant :
- Des ESV fréquentes et symptomatiques à l’origine d’une altération de la FEVG ;
- Des TV/FV non contrôlées par le traitement médical ;
- Le recours fréquent aux thérapies du DAI malgré le traitement médical.
Dans le cadre du syndrome de PVMA, les procédures d’ablation concernent le plus souvent des ESV focales, mais elles peuvent être aussi envisagées pour des FV/TV déclenchées par des ESV et des TV par ré-entrées autour des foyers de fibrose.
Néanmoins, l’origine mitrale de ces troubles du rythme (des piliers mitraux, de l’anneau postérieur, de la paroi inféro-basale ou inféro-latéro-basale) rend beaucoup plus difficile leur accès lors des procédures interventionnelles.
De plus, les tentatives d’ablation seront chez ces patients plus à risque d’altération de la FEVG et de la valve mitrale.
La place de la chirurgie valvulaire mitrale
Bien que son apport est indiscutable dans l’insuffisance mitrale sévère, il n’est pas encore admis dans le contexte de réduction des arythmies ventriculaires en l’absence d’étude sur le sujet. Cependant, les études prospective montrent que le MAD disparait complètement après chirurgie mitrale (7), et que le lien arythmie sévère-mortalité tend à disparaître après chirurgie (11).
Des essais cliniques bien conduits sont nécessaires pour déterminer son rôle précis dans le cadre du phénotype de PVMA et sur la réduction du risque de troubles du rythme ventriculaires.
Conclusion
Le prolapsus valvulaire mitral arythmique est un syndrome regroupant de nombreux phénotypes dont les caractéristiques communes seront évaluées par une approche multimodale reposant à la fois sur l’échocardiographie, l’électrocardiogramme, et l’IRM cardiaque.
La description d’une disjonction annulaire mitrale, d’un phénotype myxoïde, ou encore de signes ECG tels que l’inversion des ondes T, ou l’allongement du QT seront d’importants marqueurs prédictifs de la survenue d’arythmies ventriculaires au cours du suivi des patients.
Il convient de rechercher chez tout porteur de PVM un PVMA, et en présence de ce dernier de dépister les troubles du rythme par monitoring régulier, pour stratifier sa sévérité et le risque de mort subite. Cette démarche permettra de prévenir leur survenue, notamment par l’implantation d’un défibrillateur automatique chez les patients les plus à risque.
Désormais définie de façon consensuelle sur le plan phénotypique et pronostic, de nouvelles études de large magnitude avec suivi prospectif de longue durée sont nécessaires pour définir les caractéristiques physiopathologiques, génétiques et thérapeutiques de cette nouvelle entité.
Références
- Freed LA, Benjamin EJ, Levy D, et al. Mitral valve prolapse in the general population: the benign nature of echocardiographic features in the Framingham Heart Study. J Am Coll Cardiol 2002; 40:1298–304.
- Antoine C, Benfari G, Michelena HI, Maalouf JF, Nkomo VT, Thapa P, et al. Clinical outcome of degenerative mitral regurgitation: critical importance of echocardiographic quantitative assessment in routine practice. Circulation, 2018.
- Farb A, Tang AL, Atkinson JB, McCarthy WF, Virmani R. Comparison of cardiac findings in patients with mitral valve prolapse who die suddenly to those who have congestive heart failure from mitral regurgitation and to those with non-fatal cardiac conditions. Am J Cardiol 1992;70:234–9.
- Basso C, Perazzolo Marra M, Rizzo S, et al. Arrhythmic mitral valve prolapse and sudden cardiac death. Circulation 2015;132:556–66.
- Narayanan K, Uy-Evanado A, Teodorescu C, et al. Mitral valve prolapse and sudden cardiac arrest in the community. Heart Rhythm 2016;13: 498–503.
- Basso C, Iliceto S, Thiene G, Perazzolo Marra M. Mitral valve prolapse, ventricular arrhythmias, and sudden death. Circulation 2019;140:952–64.
- Essayagh B, et al. The Mitral Annular Disjunction of Mitral Valve Prolapse - Presentation and Outcome. JACC Cardiovasc Imaging, 2021. 8. Levine R, Stathogiannis E, Newell J, Harrigan P, Weyman A. Reconsideration of echocardiographic standards for mitral valve prolapse: lack of association between leaflet displacement isolated to the apical four chamber view and independent echocardiographic evidence of abnormality. J Am Coll Cardiol 1988;11:1010–19.
- Sabba A, Essayagh B, Ramirez Barrera JD, et al. EHRA expert consensus statement on arrhythmic mitral valve prolapse and mitral annular disjunction complex in collaboration with the ESC Council on valvular heart disease and the European Association of Cardiovascular Imaging endorsed by the Heart Rhythm Society, by the Asia Pacific Heart Rhythm Society, and by the Latin American Heart Rhythm Society. EP Europace, 2022.
- Avierinos JF, Gersh BJ, Melton LJ 3rd, Bailey KR, Shub C, Nishimura RA, Tajik AJ, Enriquez-Sarano M. Natural history of asymptomatic mitral valve prolapse in the community. Circulation, 2002.
- Essayagh B, Sabba A, Clémence A, et al. Presentation and Outcome of Arrhythmic Mitral Valve Prolapse. JACC, 2020.
- Kukavica D., et al. Arrhythmic Mitral Valve Prolapse: Introducing an Era of Multimodality Imaging-Based Diagnosis and Risk Stratification. MDPI, March 8th 2021.
- Hourdain J, Clavel M-A, et al. Common Phenotype in Patients With SCD. Circulation, 2018.
- Vahanian A, Beyersdorf F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease: Developed by the Task Force for the management of valvular heart disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J, 2021.
- Otto C.M., Nishimura R.A., et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation, 2021.
Auteur
Nicolas CABAYE
Interne, Rouen
Relecteur
Benjamin ESSAYAGH
PH, Cannes
Article paru dans la revue « Le magazine des jeunes cardiologues - Collège des Cardiologues en Formation » / CCF N° 18

