Place de l’IRM cardiaque en 2023 pour le diagnostic d’Amylose cardiaque
Introduction
L’amylose est une maladie systémique rare au sein de la population générale. Il s’agit d’une maladie de surcharge, caractérisée par des dépôts extracellulaires de protéines mal conformées, appelées fi brilles amyloïdes.
Plus de 30 protéines sont connues comme étant capables de former des dépôts amyloïdes, mais seules 9 d’entre elles sont capables de s’agréger dans le cœur et de provoquer une atteinte cardiaque significative (AA, AL, ATTRv et ATTRwt, AApoAI, AApoAII, AApoAIV, Ab2M, AFib, AGel). Parmi ces 9 protéines, l’amylose à chaîne légère (AL) et l’amylose à transthyrétine (ATTRwt acquise et ATTRv héréditaire), représentent à elles seules 98 % des amyloses cardiaques(1).
L’amylose AL est caractérisée par des dépôts de chaînes légères (le plus souvent de type lambda) dans les tissus. Dans la majorité des cas, ces dernières proviennent d’une sécrétion de chaînes légères par les plasmocytes malins au cours du myélome.
L’amylose ATTR est responsable de dépôts de transthyrétine, protéine précurseur de l’albumine, mais mal conformée. Il existe de 2 types d’amylose ATTR :
• L’amylose ATTRv ou héréditaire, de transmission autosomique dominante.
• L’amylose ATTwt ou sauvage qui s’exprime alors chez la personne âgée et dont la physiopathologie reste encore à élucider.
L’atteinte cardiaque de l’amylose marque un tournant majeur dans l’histoire de la maladie : la médiane de survie est estimée à environ 2 ans après le début des symptômes pour l’amylose AL(2) et l’amylose ATTRv(3), et à 3-4 ans pour l’amylose ATTRwt(4). Le développement de nouveaux traitements pour l’amylose (ex : Tafamidis pour l’amylose ATTR) et l’amélioration de la prise en charge du myélome rendent à présent possible une prise en charge plus précoce de la maladie. Actuellement, la méthode diagnostique de référence est un prélèvement histologique invasif par biopsie myocardique. Les dépôts amyloïdes sont mis en évidence par une coloration Rouge-Congo et sont biréfringents à la lumière polarisée. Du fait de sa faible incidence en population générale, et de son atteinte cardiaque en particulier, le challenge de ces dernières années a été de développer des techniques d’imagerie afi n de dépister au mieux les cas d’amylose cardiaque, pour ainsi limiter le nombre d’acte invasif inutile voire dangereux. il est à noter que pour l’amylose ATTR, le diagnostic histologique n’est plus de rigueur lorsque la fi xation myocardique au Bisphosphonate-T99m est supérieure ou égale à celle de l’os à la scintigraphie osseuse (Stade Perugini 2 ou 3) et un bilan immunologique négatif.
En pratique courante, le rôle de l’échographie cardiaque transthoracique est bien établi, notamment pour dépister une atteinte cardiaque de l’amylose. L’aspect échographique habituel consiste en :
• Un épaississement ventriculaire gauche concentrique.
• Avec une dysfonction diastolique marquée.
• Une fraction d’éjection du ventricule gauche (FEVG) longtemps conservée au cours de l’évolution clinique.
Cependant, la performance diagnostique de l’échographie cardiaque transthoracique est apparue comme imparfaite, notamment en l’absence d’expression extracardiaque de la maladie systémique ou lorsqu’il co-existe d’autres causes d’hypertrophie ventriculaire gauche.
De plus, l’amylose cardiaque peut parfois mimer des cardiopathies hypertrophiques sarcomériques, avec d’authentiques hypertrophies asymétriques associées à une obstruction intra-ventriculaire gauche significative.
Quant à la réalisation de la scintigraphie osseuse, elle prend tout son sens dans le diagnostic de l’amylose ATTR. À noter que certaines formes d’amylose ATTR héréditaire peuvent avoir une scintigraphie osseuse négative mais une IRM cardiaque évocatrice d’amylose !
Enfin, l’IRM cardiaque bien que non indispensable au diagnostic d’amylose cardiaque, semble avoir un rôle intéressant dans la prise en charge des patients atteints d’amylose avec atteinte cardiaque.
Étude morphologique par IRM cardiaque
L’étude morphologique par IRM cardiaque permet de préciser les données échographiques, à travers une étude plus précise. Elle permet d’objectiver un épaississement diffus des parois cardiaques des 4 cavités. Cet épaississement myocardique est parfois qualifié de manière impropre d’« hypertrophie myocardique » alors que le mécanisme n’est pas une hypertrophie musculaire mais bien une infiltration du myocarde par les dépôts de fibrilles amyloïdes.
Un épaississement de plus de 6 mm du septum inter-atrial ou de la paroi postérieure de l’oreillette droite est spécifique d’atteinte amyloïde(5). Une dilatation bi-atriale importante peut également être observée. La fonction diastolique bi-ventriculaire est altérée selon un mécanisme restrictif, et contraste avec une fonction systolique longtemps conservée au cours de l’évolution de la maladie.
En outre, des épanchements péricardiques ou pleuraux peuvent également être retrouvés à l’IRM au cours de l’amylose avec atteinte cardiaque.
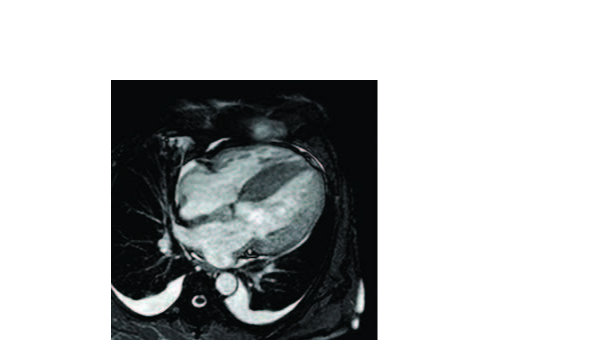
Figure 1. Séquence de ciné-IRM chez un patient atteint d’amylose cardiaque AL. (Case courtesy of Dr Gregor Savli, Radiopaedia.org, rID: 25137) Épaississement myocardique diffus (ventricules et oreillettes) incluant le septum inter-atrial. Dilatation bi-atriale. Épanchement péricardique et épanchements pleuraux bilatéraux.
Caractérisation tissulaire par IRM cardiaque
Bien que l’étude morphologique obtenue par l’IRM reste la plus précise, sa principale limite réside dans le fait qu’elle ne semble pas apporter d’informations supplémentaires par rapport à l’échographie transthoracique au moment de poser le diagnostic. Notons que 3 à 5 % des patients atteints d’amylose cardiaque ne présente pas d’hypertrophie VG avec une épaisseur télédiastolique du VG < 12 mm !(6)
La force de l’IRM repose dans la caractérisation tissulaire, en nous permettant de dévoiler « l’histopathologie non invasive » de chaque tissu.
Rehaussement tardif
Le rehaussement tardif après injection de gadolinium à l’IRM est la séquence historique de caractérisation tissulaire. L’étude du rehaussement tardif est réalisée environ 10 minutes après l’injection de gadolinium et repose sur des séquences en pondération T1 en écho de gradient ultrarapide ou en écho de gradient à l’état d’équilibre.
Celle-ci a marqué un tournant majeur dans l’évaluation par IRM de l’amylose cardiaque, aussi bien pour son diagnostic que son pronostic(7).
Pour rappel, les chélates de gadolinium diffusent librement dans le compartiment extra cellulaire. Les tissus inflammatoires, fibreux et dans notre cas les fi brilles amyloïdes, entraînent une rétention de ces sels de gadolinium, qui persistent après le wash-out vasculaire du produit de contraste.
Le rehaussement tardif en cas d’atteinte amyloïde, est le plus souvent transmural global avec un aspect pacthy ou sous-endocardique circonférentiel (83 %). Du fait d’une atteinte pan-cardiaque de l’amylose, ce rehaussement est également visible au niveau des oreillettes, des valves et du ventricule droit.
Des difficultés de réglage du temps d’inversion (TI) lors de la réalisation de l’examen doivent faire suspecter le diagnostic d’amylose. Habituellement, la séquence de rehaussement tardif force l’annulation du signal du myocarde à un temps d’inversion approprié. En cas d’amylose, le signal du myocarde n’est pas totalement annulé. Ceci a pour conséquence : un aspect granité de l’image du fait d’un ratio « signal/bruit » défavorable et un aspect noir du sang intracardiaque (appelé « dark blood pool »).
Figure 2. Rehaussement tardif sur des coupes petit axe chez 6 patients atteints d’amylose cardiaque (extraite de la référence [7]).
(A) Rehaussement tardif (RT) transmural homogène dans le ventricule gauche et droit. À noter une apparence noire du sang (« dark blood pool ») intra cardiaque du fait des difficultés de réglage du temps d’inversion.
(B) RT transmural global hétérogène au sein du ventricule gauche et droit.
(C) RT sous endocardique (flèche) avec un aspect de « dark blood pool ».
(D) Difficulté de réglage du temps d’inversion avec un mauvais rapport signal/bruit.
(E) RT focal (flèches) dans le segment inféro-latéro-basal et à moindre mesure dans le segment inferoseptal.
(F) Aspect normal de l’annulation du signal du myocarde.
Cartographie T1 (T1-Mapping) et volume extracellulaire
Bien que la mise en évidence du rehaussement tardif soit très utile dans l’évaluation IRM de l’amylose cardiaque, celle-ci n’est pas sans faille : selon les séries, jusqu’à 7 % des patients atteints d’amylose prouvée histologiquement, ne présentaient pas de rehaussement tardif à l’IRM cardiaque(7-8).
De plus, l’analyse du rehaussement tardif reste strictement qualitative, et ne permet pas de quantifi er précisément le degré d’atteinte du muscle myocardique.
Celle-ci est rendue possible par l’étude du T1-mapping (ou cartographie T1) et du volume extra-cellulaire (ECVmapping). Ces deux dernières techniques ont une meilleure sensibilité diagnostique, permettent un diagnostic plus précoce, et une évaluation pronostique(9-10).
Chaque tissu a une signature électromagnétique, qui peut être révélée par la cartographie T1. Le temps de relaxation T1 correspond au temps qu’il faut au tissu pour récupérer 63 % de sa magnétisation longitudinale initiale. Il permet la création d’une carte visuelle des temps de relaxation T1 de chaque tissu selon un code couleur. Sur une IRM 1,5T, le myocarde sain a un temps de relaxation T1 aux alentours des 1000 ms tandis que les dépôts amyloïdes ont un temps de relaxation T1 augmenté, supérieur à 1100-1200 ms (Figure 3).
Figure 3. T1 mapping d’un myocarde sain (A) et d’un myocarde atteint d’amylose ATTR (B) (extraite de la référence 10).
La cartographie du volume extra-cellulaire (ou ECV-mapping) a été développée afi n de permettre une analyse plus fi ne du volume extra-cellulaire, par soustraction de la masse vasculaire après traitement de l’image pré-injection et post-injection de gadolinium.
La cartographie du volume extra-cellulaire (ou ECV-mapping) a été développée afi n de permettre une analyse plus fi ne du volume extra-cellulaire, par soustraction de la masse vasculaire après traitement de l’image pré-injection et post-injection de gadolinium.
Une valeur de l’ECV au-delà de 59 % en cas d’amylose ATTR et 45 % pour l’amylose AL a été montrée comme associée à un pronostic péjoratif (cf. fi gure 4).
À noter qu’à la différence du T1-mapping, seul l’ECV après ajustement semble être un marqueur pronostic indépendant de mortalité, aussi bien pour l’amylose AL que pour l’amylose ATTR(9-10).
Figure 4 (extraite de la référence 10). cartographie du volume extra-cellulaire d’un myocarde sain (A) et d’un myocarde atteint d’amylose ATTR (B).
Fiche de synthèse
Envie de vous former en IRM cardiaque ?
> Téléchargez gratuitement les dernières recommandations pratiques de l’ESC traduites en français !!
Lien de téléchargement : https://cutt.ly/N2qBdXl
Références :
1. Benson MD, et al. Amyloid nomenclature 2018: recommendations by theInternational Society of Amyloidosis (ISA) nomenclature committee. Amyloid2018;25:215–219.
2. Bennani Smires Y, et al. Pilot study for left ventricular imaging phenotype of patients over 65 years old with heart failure and preserved ejection fraction: the high prevalence of amyloid cardiomyopathy. Int J Cardiovasc Imaging 2016;32:1403–13.
3. Ruberg FL, et al. Prospective evaluation of the morbidity and mortality of wild-type and V122I mutant transthyretin amyloid cardiomyopathy: TheTransthyretin Amyloi-dosis Cardiac Study (TRACS). Am Heart J 2012;164:222–8.
4. Grogan M, et al. Natural history of wild-type transthyretin cardiac amyloidosis and risk stratification using a novel staging system. J Am Coll Cardiol 2016;68:1014–20.
5. Fattori R, et al. Contribution of Magnetic Resonance Imaging in the Differential Diagnosis of Cardiac Amyloidosis and Symmetric Hypertrophic Cardiomyopathy. Am Heart J. 1998;136(5):824-30.
6. Martinez-Naharro A, et al. Magnetic Resonance in Transthyretin Cardiac Amyloidosis. J Am Coll Cardiol 2017;70:466–77.
7. Syed, I.S., et al. Role of Cardiac Magnetic Resonance Imaging in the Detection of Cardiac Amyloidosis. JACC: Cardiovascular Imaging, 3(2), 155–164.
8. Vogelsberg, H., et al. Cardiovascular Magnetic Resonance in Clinically Suspected Cardiac Amyloidosis: Noninvasive Imaging Compared to Endomyocardial Biopsy. Journal of the American College of Cardiology, 51(10), 1022–1030.
9. Banypersad, S. M., et al. Editor’s choice: T1 mapping and survival in systemic light-chain amyloidosis. European Heart Journal, 36(4), 244.
10. Martinez-Naharro, A et al. Native T1 and Extracellular Volume in Transthyretin Amyloidosis. JACC : Cardiovascular Imaging, 12(5), 810–819.
Simon VISCOGLIOSI
Interne en Cardiologie
au CHU de Lyon
Dr Théo PEZEL
CCA en Cardiologie
au CHU de Lariboisière (APHP, Paris)
Article paru dans la revue “ Collèges des Cardiologues en Formation ” / CCF n°17

