D'après l'étude "Vutrisiran in Patients with Transthyretin Amyloidosis with Cardiomyopathy" parue en août 2024 par Marianna Fontana et al dans le New England Journal of Medicine et présentée en Hotline à l'ESC 2024 à Londres.
Contexte
L'amylose cardiaque à transthyrétine (ATTR) est caractérisée par les dépôts extracellulaires de fibrilles amyloïdes infiltrant le myocarde et les voies de conduction électrique cardiaque.
Il existe deux formes d'ATTR, une sauvage, l'ATTRwt (wild-type) et une forme héréditaire dite ATTRv (variant) (1). L'ATTR représente la principale étiologie d'amylose cardiaque, elle est associée à une importante morbi-mortalité et concernerait jusqu'à 20 % des patients avec insuffisance cardiaque à fraction d'éjection préservée et 16 % des patients avec rétrécissement aortique serré ayant bénéficié d'un TAVI (2). Le tafamidis et plus récemment l'acoramidis ont fait la preuve d'une efficacité sur la réduction de mortalité et d'hospitalisation pour insuffisance cardiaque en stabilisant la protéine de TTR afin d'éviterla fibrilloformation (3, 4).
Le Vutrisiran un traitement à ARN interférent, bloque la synthèse hépatique de TTR, il s'injecte par voie sous-cutanée tous les 3 mois. Son usage était jusqu'à présent réservé à la polyneuropathie associée à l'ATTRv. Des données exploratoires ont permis d'identifier un possible bénéfice sur l'atteinte cardiaque de l'ATTRv et il pourrait exister une synergie d'effet avec les traitements stabilisateurs dans l'ATTRwt (5).
L'objectif de cette étude était donc d'évaluer l'efficacité et la sécurité de l'utilisation de utrisiran dans l'ATTRwt et l'ATTRv avec atteinte cardiaque (6).
Méthodologie
Dans cette étude de phase 3, multicentrique, internationale, randomisée, en double aveugle, les patients âgés de 18 à 85 ans avec diagnostic d'ATTRwt ou ATTRv ont été randomisés (stratification sur le type d'ATTR, NYHA, l'âge à l'inclusion et sur l'usage de Tafamidis) pour recevoir du Vutrisiran 25 mg ou un placebo en sous-cutané toutes les 3 mois pendant 36 mois. Les patients avec un NTproBNP supérieure ou égale à 8500pg/ml de NTproBNP ou de NYHA III avec NTproBNP >3000pg/ml et débit de filtration glomérulaire inférieur à 45ml/min/m étaient exclus de l'étude. Le diagnostic d'ATTR reposait sur une preuve histologique ou une scintigraphie osseuse avec fixation cardiaque sans gammapathie monoclonale chez des patients avec une épaisseur septale en échographie supérieure à 12 mm et une antériorité d'insuffisance cardiaque. Les patients pouvaient être traité par tafamidis au moment de l'inclusion et une analyse était prévue chez les patients ne prenant pas de traitement.
À la fin des 36 mois, les patients avaient la possibilité de participer à une phase d'extension en ouvert de l'étude avec prise de Vutrisiran pour l'ensemble des patients.
Le critère de jugement principal était un critère composite de mortalité toute cause et de récurrence d'évènement cardiovasculaire (hospitalisation pour une cause cardiovasculaire ou une consultation urgente pour insuffisance cardiaque) à 36 mois.
Dans un second temps, les investigateurs ont évalué la survenue de mortalité toute cause à 42 mois (incluant 6 mois de phase ouverte) et l'évolution à 30 mois du test de marche de 6 minutes et du score de qualité de vie (questionnaire de cardiomyopathies de Kansas City).
Plusieurs critères de sécurité ont également été évalués.
Résultats
Entre décembre 2019 et août 2021, 655 patients ont été inclus, 326 dans le groupe Vutrisiran (âge médian 77 ans, 92 % d'hommes) et 329 dans le groupe placebo (âge médian 76 ans, 93 % d'hommes). Parmi les principales caractéristiques, 40 % des patients recevaient du tafamidis à l'inclusion. Une nette prédominance de patients avec dyspnée NYHA2 (80 %) et de patients avec ATTRs (90 %). Dans le groupe de patients sans Tafamidis à l'inclusion, 196 (âge médian 77,5 ans, 91 % d'hommes) ont été inclus dans le bras Vutrisiran et 199 (âge médian 76 ans, 92 % d'hommes) dans le bras placebo. Dans le bras Vutrisiran seul, 22 % des patients étaient initiés au tafamidis au cours de suivi. Au total 53 % des patients sous Vutrisiran étaient traités par tafamidis à l'inclusion ou au cours de l'étude.
L'efficacité du Vutrisiran a été démontrée sur l'ensemble des critères de jugement prédéfinis. Il était associé à une réduction significative du critère de jugement principal (Figure 1) dans la population totale (HR=0,72 ; intervalle de confiance [IC] à 95 % : 0,56-0,93 ; P=0,01) et dans la population ne prenant pas de Tafamidis à l'inclusion (HR=0,67 ; 95 % IC : 0,49-0,93 ; P=0,02).
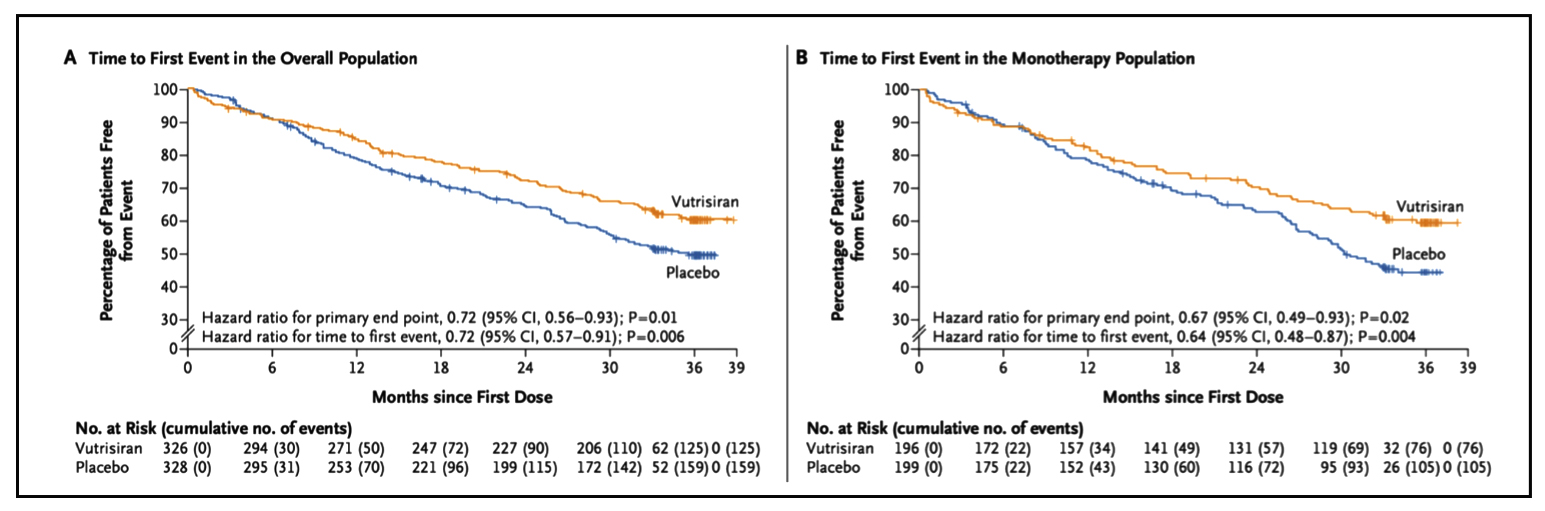
Figure 2 : Courbes de Kaplan Meier montrant la mortalité toute cause dans la population totale comparan le vutrisiran et le placebo (A) et dans sous population traité par Vutrisiran ou placebo sansTafamidis à l'inclusion (B) (6).
Au-delà de ces résultats prometteurs, il faut noter la nette amélioration du pronostic des patients avec atteinte cardiaque d'ATTR depuis la première étude ayant validé le Tafamidis publiée en 2018 avec une survie à 30 mois passée de 70 % à 85 % sous traitement (3, 6). Cette différence du pronostic des patients sur une période courte s'explique par un diagnostic survenant à un stade plus précoce de la maladie grâce à une meilleure connaissance des praticiens et à l'utilisation de la scintigraphie osseuse mais aussi aux critères d'inclusion et d'exclusion de l'étude limitant l'inclusion des patients plus sévère. Il faut de plus noter l'utilisation des nouveaux traitements de l'insuffisance cardiaque comme les gliflozines, inhibiteurs du SGLT2, chez près d'un tiers des patients inclus dans l'étude.
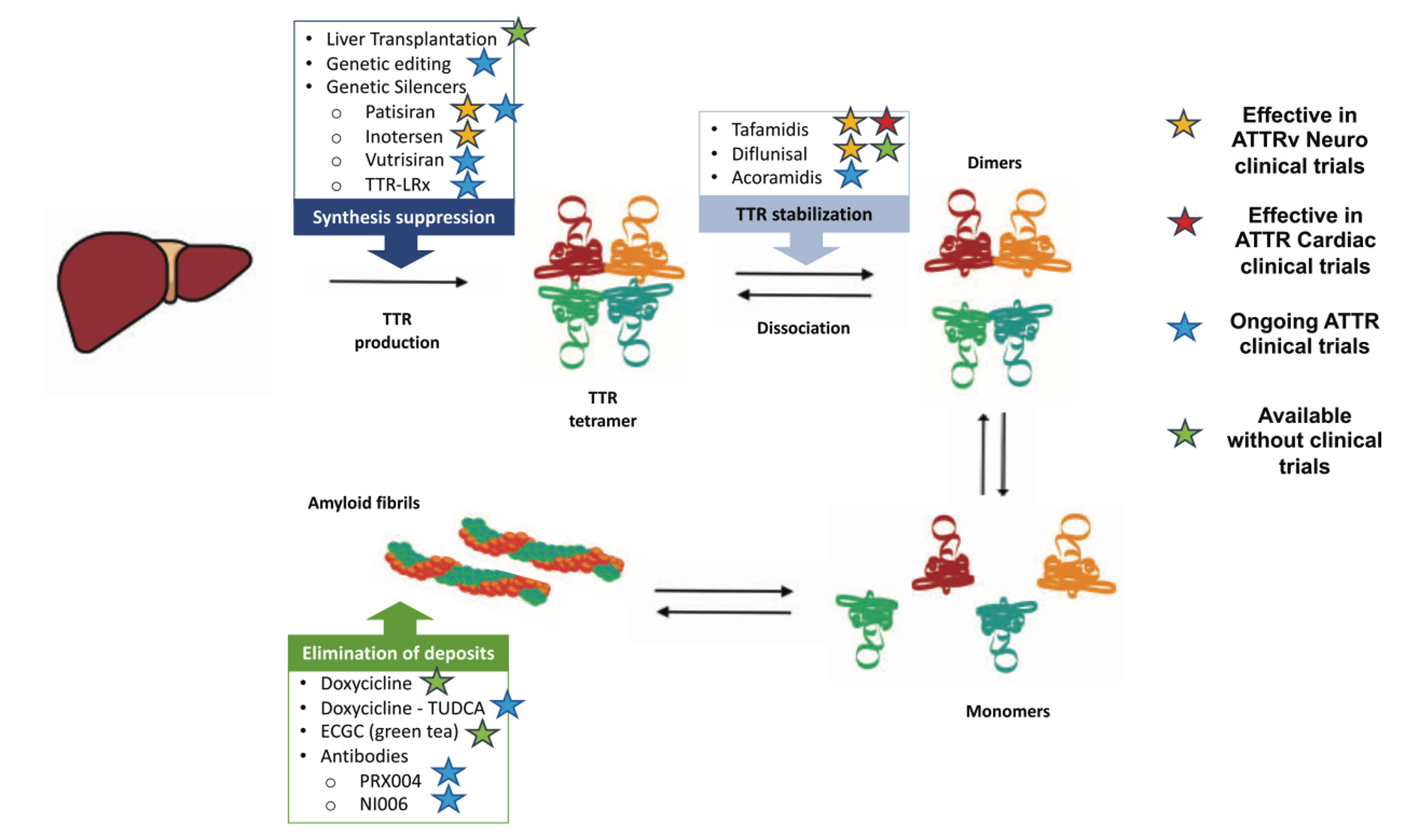
Figure 3 : Mécanisme d'action des différents traitements disponibles dans l'ATTR (1)
Le protocole de l'étude ne permettait pas une puissance statistique suffisante pour conclure sur l'efficacité du traitement par Vutrisiran seul ou en combinaison avec le tafamidis ou versus tafamidis seul. Des études randomisées complémentaires pourraient être menées pour évaluer l'efficacité du traitement vis-à-vis des stabilisateurs de TTR.
L'ordre d'introduction des traitements en fonction du stade de la pathologie pourrait également présenter un intérêt.
Discussion
L'étude HELIOS-B a démontré l'efficacité d'un nouveau traitement pour la réduction de la mortalité toute cause et de la récurrence d'évènements cardiovasculaires chez les patients avec atteinte cardiaque d'ATTR mais également un ralentissement du déclin fonctionnel de ces patients. Par un mécanisme différent des stabilisateurs de la TTR (Tafamidis et Acoramidis), le Vutrisiran, traitement ARN interférent, pourrait constituer une option thérapeutique complémentaire dans l'atteinte cardiaque d'ATTR.
Points clés
• Le Vutrisiran, un traitement ARN interférent, bloque la synthèse hépatique de transthyrétine (TTR).
• Dans un essai randomisé en double aveugle, le Vutrisiran a démontré une efficacité contre placebo sur la réduction d'un critère composite comprenant mortalité toute cause et récurrence d'évènements cardiovasculaires.
• L'étude est également positive sur des critères fonctionnels et de qualité de vie avec un bon profil de tolérance.
• Amélioration pronostique dans l'ensemble de la population (40 % de patients sous Tafamidis à l'inclusion) et chez les patients sans autre traitement spécifique.
• Ce nouveau traitement efficace a une action complémentaire avec les stabilisateurs de la TTR (Tafamidis et Acoramidis) et d'autres études seront nécessaires pour évaluer l'intérêt d'une combinaison de ces traitements.
Auteur

Raphael MIRAILLES
CHU de Poitiers
Relecteur

Pr Thibaud DAMY
CHU de Créteil
Références
1. Garcia-Pavia P, Rapezzi C, Adler Y, Arad M, Basso C, Brucato A, et al. Diagnosis and treatment of cardiac amyloidosis: a position statement of the ESC Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2021 Apr 21;42(16):1554–68.
2. Ruberg FL, Grogan M, Hanna M, Kelly JW, Maurer MS. Transthyretin Amyloid Cardiomyopathy: JACC State-of-the-Art Review. J Am Coll Cardiol. 2019 Jun 11;73(22):2872–91.
3. Maurer MS, Schwartz JH, Gundapaneni B, Elliott PM, Merlini G, Waddington-Cruz M, et al. Tafamidis Treatment for Patients with Transthyretin Amyloid Cardiomyopathy. N Engl J Med. 2018 Sep 13;379(11):1007–16.
4. Gillmore JD, Judge DP, Cappelli F, Fontana M, Garcia-Pavia P, Gibbs S, et al. Efficacy and Safety of Acoramidis in Transthyretin myloid Cardiomyopathy. N Engl J Med. 2024 Jan 11;390(2):132–42.
5. Garcia-Pavia P, Grogan M, Kale P, Berk JL, Maurer MS, Conceição I, et al. Impact of vutrisiran on exploratory cardiac parameters in hereditary transthyretin-mediated amyloidosis with polyneuropathy. Eur J Heart Fail. 2024 Feb;26(2):397–410.
6. Fontana M, Berk JL, Gillmore JD, Witteles RM, Grogan M, Drachman B, et al. Vutrisiran in Patients with Transthyretin Amyloidosis with Cardiomyopathy. N Engl J Med. 2024 Aug 30;

