D'après l'étude : “2-Year Outcomes of an Atrial Shunt Device in HFpEF/HFmrEF” par Finn Gustafsson et al, parue dans JACC Heart Failure en juin 2024
Points clés
1. Malgré des progrès pharmacologiques récents, les patients atteints d'insuffisance cardiaque (HF) à FEVG modérément réduite (HFmrEF) et à FEVG préservée (HFpEF) gardent un risque d'hospitalisation pour HF important, associé à une altération de la qualité de vie.
2. L'objectif de cette étude était d'évaluer l'impact sur les évènements cardiovasculaires de l'implantation d'un device permettant un shunt de décharge inter-atrial vs. non.
3. Chez ces patients, la création d'un shunt inter-atrial n'a pas montré de bénéfice sur les évènements cardiovasculaires à 2 ans.
4. Un sous-groupe répondeur est en cours d'analyse dans l'étude RESPONDER-HF.
Contexte
De plus en plus de nos patients présentent une HFmrEF ou une HFpEF (1). Malgré des progrès thérapeutiques récents (2, 3), le risque d'hospitalisation pour HF est non négligeable. L'élévation des pressions de remplissage gauches (PRVG) au repos ou à l'effort, est associée à des symptômes, une réduction de la capacité d'exercice et aux évènements cardiovasculaires. Ainsi, la pression atriale gauche (POG) et la pression artérielle pulmonaire d'occlusion (PAPO) sont des cibles potentielles à évaluer dans cette population (4, 5). Une approche invasive percutanée par création d'un shunt inter-atrial diminue la POG à l'effort (6), et est associée à une amélioration clinique dans des études ouvertes et un essai randomisé de faible effectif (7, 8).
Récemment, l'essai REDUCE LAP-HF II ne retrouvait pas d'amélioration induite par un shunt inter-atrial sur un critère composite incluant mortalité cardiovasculaire, AVC ischémiques non fatals, HF et changement de l'état de santé à 12 mois (9). Toutefois la réponse au traitement était très hétérogène.
50 % des patients qui n'avait pas de maladie vasculaire pulmonaire ou un moniteur rythmique cardiaque (MRC), semblaient être améliorés par ce device.
Cet article présente les résultats de cette étude à 2 ans, en population globale et dans les sous-groupes répondeurs/non répondeurs.
Méthodologie
Analyse pré-spécifiée à 24 mois de l'essai international REDUCE LAP-HF II, multicentrique,
randomisé, réalisé en doubleaveugle.
Les patients éligibles, âgés de plus 40 ans, insuffisants cardiaques symptomatiques,
à FEVG > 40 %, ayant une PAPO > 25 mmHg et au moins 5 mmHg au-dessus de la pression atriale droite (POD) au cathétérisme cardiaque droit à l'effort, étaient randomisés en 1:1 pour recevoir le device de shunt inter-atrial (InterAtrial Shunt Device System II, Corvia medical) ou une procédure contrôle fantôme.
Les critères d'exclusion étaient la présence d'une maladie vasculaire pulmonaire latente (avec résistances vasculaires pulmonaires (RVP) ≥ 3.5 UW), d'une resynchronisation (CRT) < 6 mois, d'une anatomie de septum interatrial non adéquate pour l'implantation du dispositif, d'une insuffisance rénale sévère (DFG < 25 mL/ min/1,73m2) ou autres conditions médicales graves pouvant affecter la participation à l'étude (MACE < 6 mois, valvulopathies sévères, arythmie et facteurs de risque cardiovasculaire non contrôlés).
Le critère de jugement principal était le composite hiérarchique des évènements cardiovasculaires à 24 mois : décès cardiovasculaire, AVC non fatals, nombre total d'événements d'insuffisance cardiaque (définis comme des hospitalisations ou visites urgentes pour cure de diurétiques IV ou intensification per os) et/ou amélioration du score de santé KCCQ-OSS (évaluant symptômes, limitation fonctionnelle et qualité de vie).
Les critères de jugement secondaires étaient les éléments du critère de jugement principal pris individuellement, l'apparition ou l'aggravation d'une insuffisance rénale (> 20 mL/min/1.73m2), les MACE (décès d'origine cardiovasculaire, infarctus du myocarde, tamponnade ou chirurgie cardiaque en urgence), les complications thrombo-emboliques (AIT et embolies systémiques) et hémorragiques (principalement vasculaires : hématome au point de ponction > 5 cm2, pseudo-anévrysme, fistule artério-veineuse, saignement rétro-péritonéal, ischémie périphérique, lésion nerveuse, hémorragie nécessitant la transfusion de culots globulaires, nécessité d'une réparation chirurgicale vasculaire), l'apparition d'une arythmie supra-ventriculaire (flutter atrial ou FA), une augmentation de plus de 30 % du volume ventriculaire droit ou une diminution de 30 % du TAPSE depuis la baseline.
Le suivi comprenait une évaluation non invasive par ETT à 1, 6, 12, et 24 mois, ainsi que des consultations de suivi à 1, 3, 6, 12, 24 mois puis annuellement jusqu'à 5 ans.
Les analyses ont été réalisées en intention de traiter modifiée (mITT) soit ayant inclus tous les patients randomisés exceptés les 5 patients inclus dans le groupe test après randomisation, qui n'ont pas été implantés devant une inéligibilité à cette technique (filtre cave, anatomie non compatible).
Après randomisation, les patients ont été stratifiés en « répondeurs » s'ils avaient des RVP à l'effort < 1.74 UW et pas de MRC ou « non répondeurs » dans le cas contraire. 34 patients sans MRC n'ont pas été analysés devant une absence de RVP ou des données aberrantes.
Les analyses statistiques ont été réalisées selon le winratio pour le critère de jugement principal puis en utilisant une régression logistique, une régression binomiale négative et une régression linéaire pour les critères de jugements secondaires, avec une analyse en sous-groupe selon le statut « répondeur » ou « non répondeur ».
Résultats
Au total, 1072 patients ont été screenés et 626 patients inclus dans l'étude dont 309 dans le groupe expérimental et 312 dans le groupe témoin (621 analysés, d'âge médian 72.5 ans, 38.6 % étaient des hommes, avec un ratio E/E' médian de 12.5, une PAPO médiane au repos de 18 mmHg soit des PRVG élevées). On note plusieurs différences statistiquement significatives entre les sous-groupes (résultats exprimés en médiane), avec des patients répondeurs atteints d'une forme moins sévère que les autres. Sur le plan clinico-biologique, ces patients étaient plus jeunes (âgés de 71 ans vs. 74 ans, p < 0.001), moins symptomatiques (74.9 % vs. 82.1 % de dyspnée NYHA 3, p = 0.040), présentaient moins de FA (40.9 % vs. 67.4, p < 0.001) et avaient des taux de peptides natriurétiques plus faibles (NTproBNP de 299 vs. 599 pg/mL, p < 0.001). L'ETT retrouvait une meilleure fonction biventriculaire (FEVG > 50 % dans 96.5 % vs. 88.3 % des cas, p < 0.001 ; FEVD de 50 % vs. 48.6 %, p = 0.001) et des PRVG plus faibles (ratio E/E' de 12.2 vs.
13.8, p = 0.002).
L'analyse du critère de jugement principal n'a pas mis en évidence de différence significative entre les groupes (win ratio : 1.01, IC 95 % : 0.82-1.24, p = 0.84), de même que l'analyse de chaque critère pris individuellement (Figure 1). L'analyse des critères de jugement secondaires retrouve dans le groupe expérimental une augmentation significative de la mortalité cardiovasculaire et des AVC ischémiques non fatals (6.1 % vs. 2.7 %, p = 0.047), des MACE (6.9 % vs. 2.7 %, p = 0.018), sans différence sur les autres événements indésirables, avec une incidence globale faible (36 soit 11.7 % vs. 16 soit 5.1 % d'évènements indésirables totaux).
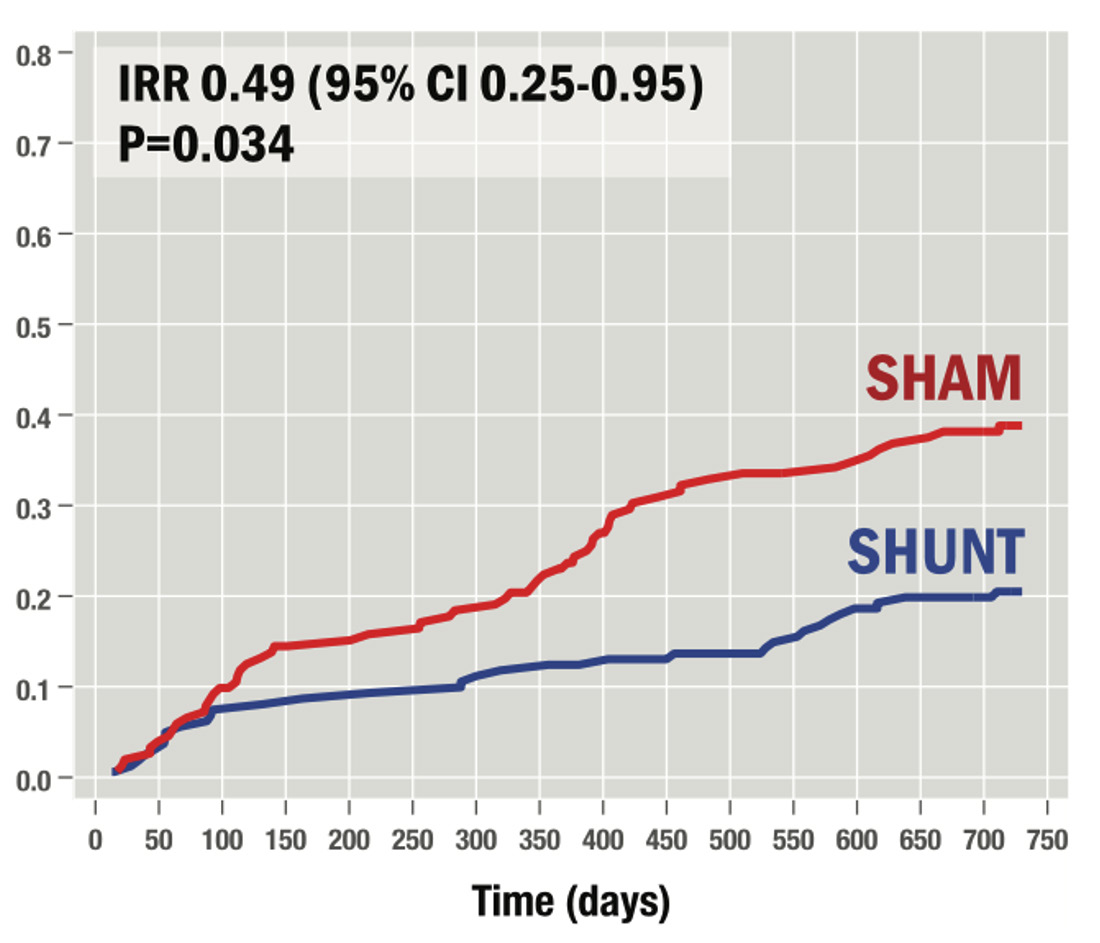
Figure 1.
Courbes de Kaplan-Meier du nombre total d'évènements d'insuffisance cardiaque à 2 ans.
Concernant les autres critères de jugement secondaires, on observe dans le groupe expérimental une tendance à l'amélioration du score global KCCQ-OSS (+ 12.1, IC 95 % 9.4-14.8 vs. + 9.0, IC 95 % 6.6-11.6, p = 0.09), drivée par une amélioration significative de la partie “qualité de vie” (+19.0, IC 95 % (15.7-22.4) vs. +14.1, IC 95 % (10.9-17.3), p = 0.03) et une amélioration significative de la dyspnée d'au moins 1 grade NYHA (OR 1.66, IC 95 % (1.15-2.42), p = 0.01).
L'analyse en sous-groupes retrouvait dans le groupe “répondeur” une amélioration globale sur le critère de jugement principal (win ratio : 1,36, IC 95 % : 1,02-1,83), drivée par une réduction de 50 % du nombre total d'événements d'insuffisance cardiaque (10 vs. 20 évènements induits par l'HF/100 patients-années, IRR : 0.49, IC 95 % (0.25-0.95), p = 0.034), une amélioration du questionnaire de santé KCCQ-OSS (+ 4.4, IC 95 % : 0.1-8.9,
p = 0.058), au prix d'un nombre d'AVC plus important (3 vs. 0), sans différence sur les autres critères de sécurité (MACE) (Figure 2).
Chez les patients “non répondeurs”, les patients du groupe expérimental avaient un moins bon devenir (win ratio : 0.73, IC 95 % 0.52-0.98), avec notamment un nombre total d'événements d'insuffisance cardiaque plus important (37 vs. 22 évènements induits par l'HF/100 patients-années, IRR : 2.26, IC 95 % : 1.32-3.84, p = 0.003) et une augmentation des MACE (9.3 % vs. 3.1 %, p = 0.047).
À 2 ans, 36 patients étaient décédés (dont 20 d'une cause cardiovasculaire). Au cours du suivi, parmi les patients avec une ETT interprétable (84 %), la quasi-totalité
(98 %) présentaient un shunt perméable. Les patients du groupe expérimental présentaient plus de dilation VD sans dysfonction significative associée (39 % vs. 28 %, p < 0.001), ainsi que plus de complications hémorragiques (4.3 % vs. 0 % ; principalement des complications vasculaires avec hématome au point de ponction).
À noter que cet essai a débuté avant la publication des résultats des essais DELIVER (3) et EMPEROR-preserved (10), ce qui explique la faible proportion de patients sous inhibiteurs des SGLT2 (2.6 %).
Conclusion
L'essai REDUCE-LAF HF II est le premier à présenter des résultats à long terme sur l'intérêt d'un shunt inter-atrial permettant une décharge des cavités gauches dans l'HFmrEF et l'HFpEF. Sur la population totale randomisée, à 2 ans, le shunt atrial vs. placebo, n'a pas permis de réduire le critère composite hiérarchique des décès cardiovasculaires, AVC non fatals, du nombre total d'événements d'insuffisance cardiaque ou du score de qualité de vie KCCQ-OSS.
La procédure était relativement sûre avec toutefois une augmentation des MACE et des saignements dans le groupe test.
Les patients du sous-groupe “répondeurs”, chez qui on observait un bénéfice du shunt à 12 mois, le conservaient à 24 mois, avec une réduction des épisodes d'insuffisance cardiaque et une amélioration de la qualité de vie. En revanche, les patients du sous-groupe “non répondeurs” à 12 mois (avec moniteur rythmique cardiaque et maladie vasculaire pulmonaire) continuaient de se dégrader à 24 mois vs. placebo.
Point Méthodo : le win ratio
Le « win ratio » est une méthode d'analyse statistique de plus en plus utilisée dans des essais randomisés de grande ampleur tels que DAPA-MI (11), EMPULSE (12), DEFENDER (13), PARAGLIDE-HF (14) ou TRILUMINATE (15). Il s'agit d'une nouvelle méthode pour étudier des critères de jugement composite qui permet l'analyse de types de critères différents selon une hiérarchie donnée.
Par exemple, grâce au win ratio, le critère de jugement principal peut comprendre à la fois un délai jusqu'à un évènement, un nombre d'évènements ponctuels et un résultat de score de qualité de vie, en priorisant l'un par rapport à l'autre.
Ainsi, après appariement des patients dans chaque groupe, il se calcule selon une stratégie hiérarchisée prédéfinie. Par exemple, si le critère hiérarchisé est la mortalité, le nombre d'épisodes d'insuffisance cardiaque et le score de qualité de vie ; chaque paire est d'abord comparée selon la mortalité. Si on ne peut les départager, la paire est ensuite comparée selon le nombre d'épisodes d'insuffisance cardiaque et ainsi de suite. Le win ratio est calculé en divisant le nombre de paires gagnantes dans les 2 groupes. In fine, le test de FINKELSTEIN-SCHOENFELD donne l'effet du traitement, avec un intervalle de confiance et une p-value.
L'avantage majeur du win ratio est donc d'augmenter la puissance statistique en exploitant un maximum d'informations disponibles sur le suivi de chaque patient.
Néanmoins, de nombreux auteurs ont rapportés des limites majeures à la technique (16). En effet, la priorisation d'un évènement par rapport à l'autre n'est pas toujours justifiée (ou justifiable) et le poids de chaque critère est identique (par exemple la mortalité a autant de poids que la qualité de vie, mais est évaluée en premier).
Ainsi, le critère de jugement peut être considéré comme « en faveur du traitement » simplement grâce à l'amélioration de la qualité de vie (3e critère du critère de jugement principal) même si la mortalité et le nombre d'épisodes d'insuffisance cardiaque ne sont pas ressortis comme significativement différents sur les 2 premières étapes de l'analyse. Ainsi, si la qualité de vie est très améliorée, le résultat global du critère de jugement principal sera très en faveur du traitement avec donc une très grande « force » de l'effet retrouvé. Pourtant, cet effet du traitement peut être tiré seulement par un seul des composants du critère de jugement principal, qui n'est souvent pas un critère dur…
Ainsi, si le win ratio permet une plus grande puissance statistique, son interprétation dépend de sa définition a priori et du classement hiérarchique des critères évalués.
La lecture d'un essai randomisé comprenant un critère évalué par win ratio doit donc comprendre : une bonne analyse de chaque composant du critère de jugement principal et de la hiérarchisation entre chaque critère, un coup d'oeil sur les analyses de chaque critère pris séparément et de l'effet du traitement sur chacun des critères.
PS : Attention le win ratio est donc une technique d'analyse de critères composite, à ne pas confondre avec l'odds radio ou le hazard ratio qui sont des manières d'exprimer le résultat d'une analyse multivariée !
Auteur

Louis PERRARD
CHU d'Amiens
Relectrice

Dr Orianne WEIZMAN
CHU de Boulogne
Références
1. Chang PP, Wruck LM, Shahar E, Rossi JS, Loehr LR, Russell SD, et al. Trends in Hospitalizations and Survival of Acute Decompensated Heart Failure in Four US Communities (2005–2014). Circulation. 2018 Jul 3;138(1):12–24.
2. Anker Stefan D., Butler Javed, Filippatos Gerasimos, Ferreira João P., Bocchi Edimar, Böhm Michael, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med. 2021 Oct 13;385(16):1451–61.
3. Solomon Scott D., McMurray John J.V., Claggett Brian, de Boer Rudolf A., DeMets David, Hernandez Adrian F., et al. Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction. N Engl J Med. 2022 Sep 21;387(12):1089–98.
4. Dorfs S, Zeh W, Hochholzer W, Jander N, Kienzle RP, Pieske B, et al. Pulmonary capillary wedge pressure during exercise and long-term mortality in patients with suspected heart failure with preserved ejection fraction. Eur Heart J. 2014 Nov 21;35(44):3103–12.
5. Wolsk E, Kaye D, Borlaug BA, Burkhoff D, Kitzman DW, Komtebedde J, et al. Resting and exercise haemodynamics in relation to six-minute walk test in patients with heart failure and preserved ejection fraction. Eur J Heart Fail.
2018;20(4):715–22.
6. Feldman T, Mauri L, Kahwash R, Litwin S, Ricciardi MJ, van der Harst P, et al.
Transcatheter Interatrial Shunt Device for the Treatment of Heart Failure With Preserved Ejection Fraction (REDUCE LAP-HF I [Reduce Elevated Left Atrial Pressure in Patients With Heart Failure]). Circulation. 2018 Jan 23;137(4):364–75.
7. Shah SJ, Feldman T, Ricciardi MJ, Kahwash R, Lilly S, Litwin S, et al. One-Year Safety and Clinical Outcomes of a Transcatheter Interatrial Shunt Device for the Treatment of Heart Failure With Preserved Ejection Fraction in the Reduce Elevated Left Atrial Pressure in Patients With Heart Failure (REDUCE LAP-HF I) Trial: A Randomized Clinical Trial. JAMA Cardiol. 2018 Oct 1;3(10):968–77.
8. A transcatheter intracardiac shunt device for heart failure with preserved éjection fraction (REDUCE LAP-HF): a multicentre, open-label, single-arm, phase 1 trial. The Lancet. 2016 Mar 26;387(10025):1298–304.
9. Shah SJ, Borlaug BA, Chung ES, Cutlip DE, Debonnaire P, Fail PS, et al. Atrial shunt device for heart failure with preserved and mildly reduced éjection fraction (REDUCE LAP-HF II): a randomised, multicentre, blinded, shamcontrolled trial. The Lancet. 2022 Mar 19;399(10330):1130–40.
10. Anker SD, Butler J, Filippatos G, Ferreira JP, Bocchi E, Böhm M, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med.
2021 Oct 14;385(16):1451–61.
11. James S, Erlinge D, Storey RF, McGuire DK, de Belder M, Eriksson N, et al. Dapagliflozin in Myocardial Infarction without Diabetes or Heart Failure. NEJM Evid. 2024 Jan 23;3(2):EVIDoa2300286.
12. Tromp J, Kosiborod MN, Angermann CE, Collins SP, Teerlink JR, Ponikowski P, et al. Treatment effects of empagliflozin in hospitalized heart failure patients across the range of left ventricular ejection fraction – Results from the EMPULSE trial. Eur J Heart Fail. 2024;26(4):963–70.
13. Tavares CAM, Azevedo LCP, Rea-Neto Á, Campos NS, Amendola CP, Kozesinski- Nakatani AC, et al. Dapagliflozin for Critically Ill Patients With Acute Organ Dysfunction: The DEFENDER Randomized Clinical Trial. JAMA [Internet].
2024 Jun 14 [cited 2024 Jul 11]; Available from: https://doi.org/10.1001/ jama.2024.10510
14. Murray EM, Cyr D, Fudim M, Ward JH, Hernandez AF, Lepage S, et al. Effects of Sacubitril/Valsartan vs Valsartan in De Novo vs Acute on Chronic HFpEF and HFmrEF. JACC Adv. 2024 Jun;3(6):100984.
15. Sorajja P, Whisenant B, Hamid N, Naik H, Makkar R, Tadros P, et al. Transcatheter Repair for Patients with Tricuspid Regurgitation. N Engl J Med. 2023 May 17;388(20):1833–42.
16. Butler J, Stockbridge N, Packer M. Win Ratio: A Seductive But Potentially Misleading Method for Evaluating Evidence from Clinical Trials. Circulation [Internet]. 2024 May 14 [cited 2024 Jul 1]; Available from: https://www. ahajournals.org/doi/10.1161/CIRCULATIONAHA.123.067786

