Case report
Jules B., nouveau-né de 7 jours était amené aux urgences pour mauvaise prise alimentaire, selles liquides et mouvements anormaux du membre supérieur gauche.
Il s’agissait du deuxième enfant de parents non consanguins d’origine caucasienne. La grossesse et l’accouchement s’étaient déroulés sans particularité. Il n’existe aucun facteur de risque d’infection materno-foetale.
Il était né à 40 SA et 1 jours : PN 4120g, TN 52,5 et PC 37,5. Score d’apgar 10/10. Il avait présenté un ictère pour lequel il avait eu 3 séances de photothérapie. Il était sorti de maternité à J4 de vie sous allaitement artificiel avec un poids de 3930g.
Depuis sa sortie, il prenait mal ses biberons, paraissait inconfortable et présentait des selles liquides glaireuses sans rectorragie et sans vomissement. Devant ces symptômes et la survenue de mouvements anormaux du membre supérieur gauche, évocateurs de clonies, ses parents l’avait amené aux urgences.
Lors de l’examen, l’enfant était apyrétique. Il pesait 3850g, la FC à 170/minutes, la TA à 85/45mmHg. On notait des signes de déshydratation modérés. L’enfant était hypotonique avec une fontanelle antérieure tendue et un PC mesuré à 40 cm. On notait également un érythème érosif du siège. Le reste de l’examen était normal.
Il a présenté aux urgences une crise convulsive avec perte de contact, mouvements cloniques du membre supérieur gauche avec déviation du regard vers la gauche. Une injection IR de Valium® puis secondairement un traitement par Dilantin® ont permis de faire céder la crise.
Le bilan initial retrouvait une CRP<10mg/l, une insuffisance rénale (créatinine à 137 μmol/l, urée 13 mmol/l) associée à une acidose métabolique avec hyperlactacidémie à 3,5 mmol/l. La glycémie, le ionogramme sanguin, l’ammoniémie, la calcémie ainsi que la NFS étaient dans les limites de la normale. Une TDM cérébrale ne retrouvait pas de processus évolutif intracrânien. La ponction lombaire réalisée retrouvait 28 000/mm3 hématies, 11/mm3 éléments, une protéinorachie à 2,41g/l, une glycorachie à 2,9mmol/l (glycémie 3,9 mmol/l). La recherche d’Interféron dans le LCR était négative de même que les PCR Herpes et Enterovirus. Sur le plan bactériologique, la culture du LCR et les hémocultures sont négatives.
La suite a été marquée par la survenue d’un nouvel épisode convulsif sous Dilantin® motivant la mise sous Gardenal® et le transfert en réanimation. Après 24h et poursuite du traitement par Gardenal® sans récidive de convulsions cliniques, correction de la déshydratation avec majoration de l’insuffisance rénale, Jules a été re-transféré dans le service de pédiatrie pour poursuite de prise en charge.
L’examen clinique retrouvait une discrète asymétrie du tonus avec attitude hypertonique du membre supérieur G et une hypotonie axiale. Les ROT étaient vifs et diffusés à gauche.
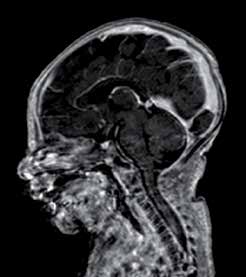
Une IRM cérébrale retrouvait un thrombus étendu du torcular, de la partie inférieure du sinus longitudinal supérieur ainsi qu’une thrombose partielle des sinus latéraux plus marquée droite. Cette thrombose était associée à des lésions ischémo-hémorragiques de la substance blanche périventriculaire. Un traitement anti-coagulant curatif par HBPM (Lovenox® 50 UI/Kg/12h) a été alors débuté avec adaptation à la fonction rénale.
Il s’est amélioré progressivement avec disparition de l’asymétrie de tonus. Devant le risque de récidive de crise convulsive, un traitement anti épileptique par Keppra® a été mis en place en relais du Gardenal®.
Un bilan de thrombophilie complet a été réalisé et ne retrouvait pas d’anomalies. Après hydratation intraveineuse, la fonction rénale s’est normalisée. Une échographie rénale réalisée à la phase initiale ne retrouvait pas d’anomalie.
Sur le plan digestif : Malgré la mise sous hydrolysat de protéines de lait de vache (Peptijunior®), les selles restaient liquides et glaireuses, les prises alimentaires restaient limitées à moins de la moitié des biberons proposés et le poids stagnait.
Des explorations digestives ont été réalisées : coproculture, virologie des selles, prick test, dialler test, RAST PLV, dosage de l’élastase fécale, dosage de la stéatorrhée : Tous normaux. Le bilan hépatique, la chromatographie des acides aminés plasmatiques et des acides organiques urinaires étaient normaux. Devant la persistance des symptômes, Jules a été mis sous hydrolysat poussé de protéines de lait de vache (Neocate®). Une normalisation du transit a lieu dans les 48h, associée à une bonne prise des biberons et une reprise pondérale. Cette évolution spectaculaire sur le plan digestif a permis de poser le diagnostic d’intolérance aux protéines de lait de vache.
Jules est finalement sorti après 3 semaines d’hospitalisation avec un examen neurologique normal. Il devait poursuivre son traitement anticoagulant pour une durée de 3 mois au total et avoir un suivi neurologique rapproché. Une IRM de contrôle à l’âge de 3 mois était également prévue.
Les TVCN sont des affections de plus en plus diagnostiquées du fait d’une plus grande sensibilisation des cliniciens face à ces tableaux cliniques peu spécifiques ainsi que grâce au développement des techniques d’imagerie.
Epidémiologie
L’incidence est estimée à 1 à 12 pour 100 000 [1, 2]. Elle est probablement sous-estimée du fait de plusieurs facteurs : tableau clinique aspécifique, accessibilité difficile aux techniques performantes d’imagerie, variabilité anatomique des systèmes veineux cérébraux et phénomènes de recanalisation rapide.
Facteurs de risque [6]
Il existe un risque plus élevé de développer une thrombose veineuse cérébrale chez le nouveau-né ; plus de la moitié des thromboses veineuses cérébrales de l’enfant surviennent avant l’âge d’un mois [3, 4].
Elles sont plus fréquentes chez les garçons avec une sexe ratio 3/1 [5].
Facteurs de risque maternels
- Chorioamniotite
- Diabete
- HTA
Facteurs de risque périnataux
- Inhalation méconiale
- Apgar<7 à M5
- Intubation à la naissance
- Infection néonatale (Méningite ++)
- Polyglobulie
- Deshydratation sévère
- Pneumonie
- Traitement par ECMO
- Cardiopathie congénitale
- CIVD
- Hernie diaphragmatique
A confronter aux facteurs de risque chez le nourrisson et l’enfant :
- Généraux : fièvre, deshydratation, infection.
- Affections de la tête et du cou : OMA, mastoïdite, méningite, sinusite, infection des VAS, TC, post opératoire de neurochirurgie, hydrocéphalie.
- Anémie : carence martiale, drépanocytose, thalassémie, anémie hémolytique auto immune, hémoglobinurie paroystique nocturne.
- Maladies auto-immunes : Lupus, SAPL, Behcet, MICI, thyrotoxicose, syndrome de cushing, PTI.
- Affections malignes : leucémie, lymphome, tumeur cérébrale.
- Pathologie cardiaque : cardiopathie congénitale cyanogène, post cathétérisme
- Pathologie rénale : syndrome néphrotique, SHU.
- Latrogène : L-asparaginase, contraceptifs oraux, corticoïdes, Erythropïétine alpha.
- Pathologie métabolique : acidocétose diabétique, homocystinurie.
Comme chez l’adulte, il est recommandé de réaliser un bilan de thrombophilie complet avec :
- Recherche de mutation des facteurs II, V et MTHFR.
- Déficit en AT3, en protéine C et S.
- Hyperhomocytéinémie.
Des facteurs de risques pro-thrombotiques ont été identifiés chez 20 % des enfants testés dans des séries récentes [7]. Il est à noter que ce bilan doit être recontrôlé (hormis la génétique) à l’âge de Les thromboses veineuses centrales néonatales 6 mois afin de mettre en évidence des déficits passés inaperçus en période néonatale.
Chez le nouveau-né, il existe un déficit des inhibiteurs naturels de la coagulation tels que l'Antithrombine III, la Protéine C ou la Protéine S. Leur taux rejoignent les taux de l'adulte respectivement en 3 mois pour l'Antithrombine III, 6 mois à 4 ans pour la Protéine C et 6 mois à 1 an pour la Protéine S. Ces facteurs devront donc être réévalués à distance.
Physiopathologie et clinique
Survenue d’une occlusion veineuse menant à une congestion en amont du thrombus et à un oedème cérébral local secondaire par augmentation de la pression hydrostatique. Les complications habituelles sont la survenue de lésions hémorragiques (les plus fréquentes) corticales, sous-corticales ou des noyaux gris centraux ainsi que de lésions ischémiques. Ces lésions existent chez 30 à 66 % des enfants selon les études tous âges confondus [8].
Les manifestations cliniques des TVCN sont peu spécifiques :
- Crises convulsives (partielles ou généralisées).
- Altération de la conscience, coma.
- Léthargie.
- Nausées, vomissements, anorexie.
- Céphalées.
- Hémiparésie, hémianesthésie.
- Ataxie.
- Paralysie des nerfs crâniens.
- Défaillance respiratoire.
Chez les nouveau-nés, on rencontre une plus grande fréquence des crises convulsives alors que chez l’enfant les signes déficitaires sont plus fréquents [9].
Diagnostic et traitement
Le diagnostic positif repose sur l’IRM cérébrale avec injection de gadolinium. En effet, la TDM cérébrale avec injection ne permet pas le diagnostic dans 40 % des cas [10, 11]. Les signes évocateurs sont le signe du triangle dense avant injection au niveau du sinus en question (= hyperdensité spontanée du thrombus) et le signe du delta après injection (= rehaussement des parois du sinus avec défect endoluminal).
A l’IRM, le thrombus est facilement identifiable à la phase aiguë : il apparait en isosignal sur les séquences T1, en hyposignal sur les séquences T2. A la phase subaiguë, le thrombus est en hypersignal T1 et T2 [12]. Les sites les plus fréquents de TVC sont les sinus transverse, sagittal supérieur, sigmoïde et droit.
Le traitement de référence de la TVC de l’enfant est l’anticoagulation par Héparine de bas poids moléculaire ou héparine non fractionnée avec relais par Anti-vitamine K. Ce traitement est validé chez l’enfant y compris lorsqu’il existe des lésions ischémo-hémorragiques [13]. Ce traitement n’augmente pas le risque hémorragique et améliore le pronostic. Le traitement anticoagulant sera poursuivi pour une durée de 3 à 6 mois. Des études récentes [14, 15] semblent montrer que ce traitement est également efficace chez les nouveau-nés et il n’est pas noté d’augmentation des accidents hémorragiques bien que le maniement des anticoagulants en période néonatale soit difficile avec une exposition au surdosage et donc aux accidents hémorragiques. La société française de neurologie préconise un traitement d’une durée de 6 à 12 semaines en l’absence de contre-indication. (situation à haut risque hémorragique : chirurgie, traumatisme…). (Pour les posologies et le maniement des anticoagulants, se référer à cet article [13]). En dehors du traitement anticoagulant, il faut traiter le facteur déclenchant et prendre en charge les complications (avec entre autres la mise en place d’un traitement anti-épileptique notamment si survenue de crises convulsives).
Pronostic
Les TVCN sont des affections graves. La mortalité à la phase aiguë varie de 2 à 19 % selon les études [2, 4, 15]. On retrouve des séquelles modérées à sévères chez 40 à 45 % des survivants [2, 4, 15]. Une épilepsie est retrouvée dans 16 à 41 % des cas [2, 15]. Il semblerait exister une association significative entre la présence à la phase aiguë de lésions ischémiques et les séquelles à long terme [15]. Un suivi prolongé de ces enfants est donc nécessaire en milieu spécialisé.
Dans ce cas, le patient a fait sa thrombose veineuse cérébrale sur un épisode de déshydratation sévère sur une APLV.
Nous ne ferons pas de rappel sur l’APLV ici mais il ne faut pas oublier que :
- Dans les allergies IgE médiées, les prick tests sont positifs et permettent de conforter le diagnostic.
- Dans les allergies non IgE médiées, les pricks tests sont rarement positifs (25 % des cas) [16] et les IgE sériques spécifiques sont, par définition, négatifs. On utilise alors les patchs tests (Diallertest®) qui sont facile d’emploi. Ces derniers sont positifs uniquement dans 50 % des cas avant 1 an et dans 82 % des cas après 1 an [17].
- 10 % des APLV sont résistantes à un traitement par hydrolysat partiel de protéines de lait de vache et guérissent sous hydrolysat poussé.
Michael Levy
Références
- Yang YK, Chan AK, Callen DJ, Paes BA. Neonatal cerebral sinovenous thrombosis: sifting the evidence for a diagnostic. Pediatrics. 2010;126:e693-e700.
- Berfelo FJ, Kersbergen KJ, van Ommen CH, et al. Neonatal cerebral sinovenous thrombosis from symptom to outcome. Stroke. 2010;41:1382-1388.
- deVeber G, Andrew M, Adams C, et al. Canadian Pediatric Ischemic Stroke Study Group. Cerebral sinovenous thrombosis in children. N Engl J Med. 2001;345:417-423.
- Moharir MD, Shroff M, Stephens D, et al. Anticoagulants in pediatric cerebral sinovenous thrombosis: a safety and outcome study. Ann Neurol. 2010;67:590-599.
- Golomb MR, Dick PT, MacGregor DL, Curtis R, Sofronas M, deVeber GA. Neonatal arterial ischemic stroke and cerebral sinovenous thrombosis are more commonly diagnosed in boys. J Child Neurol. 2004;19:493– 497.
- Dlamini N, Billinghurst L, Kirkham FJ. Cerebral venous sinus (sinovenous) thrombosis in children. Neurosurg Clin N Am. 2010 Jul;21(3):511-27.
- Wu YW, Miller SP, Chin K, et al. Multiple risk factors in neonatal sinovenous thrombosis. Neurology. 2002;59:438–40.
- Teksam M, Moharir M, deVeber G, et al. Frequency and topographic distribution of brain lesions in pediatric cerebral venous thrombosis. AJNR Am J Neuroradiol. 2008;29:1961–5.
- deVeber G, Andrew M, Adams C, et al. Cerebral sinovenous thrombosis in children. N Engl J Med. 2001;345:417–23.
- Barron TF, Gusnard DA, Zimmerman RA, et al. Cerebral venous thrombosis in neonates and children. Pediatr Neurol. 1992;8:112–6.
- deVeber G, Andrew M. The Canadian Paediatric Ischemic Stroke Study group. The epidemiology and outcome of sinovenous thrombosis in pediatric patients. N Engl J Med. 2001;345:417–23.
- Leach JL, Fortuna RB, Jones BV, Gaskill-Shipley MF. Imaging of cerebral venous thrombosis: current techniques, spectrum of findings, and diagnostic pitfalls. Radiographics. 2006 Oct;26 Suppl 1:S19-41; discussion S42.
- Jordan LC, Rafay MF, Smith SE, Askalan R, Zamel KM, deVeber G, Ashwal S; International Pediatric Stroke Study Group. Antithrombotic treatment in neonatal cerebral sinovenous thrombosis: results of the International Pediatric Stroke Study. J Pediatr. 2010 May;156(5):704-10, 710.e1-710.e2.
- Vieira JP, Luis C, Monteiro JP, Temudo T, Campos MM, Quintas S, Nunes S. Cerebral sinovenous thrombosis in children: clinical presentation and extension, localization and recanalization of thrombosis. Eur J Paediatr Neurol. 2010 Jan;14(1):80-5.
- Fitzgerald KC, Williams LS, Garg BP, Carvalho KS, Golomb MR. Cerebral sinovenous thrombosis in the neonate. Arch Neurol. 2006 Mar;63(3):405-9.
- Isolauri E, Turjanmaa K. Combined skin prick and patch testing enhances identification of food allergy in infants with atopic dermatitis. J Allergy Clin Immunol 1996;97:9–15.
- De Boissieu D, Dupont C. Diagnosis of non-IgE mediated digestive manifestations of cow’s milk allergy. J Pediatr 2004;145:716.
Vous souhaitez nous faire partager votre expérience clinique ? Vous souhaitez une mise au point sur un domaine particulier ? Ecrivez-nous ! [email protected]
Rejoignez nous aussi sur la page facebook de l’AJP : www.facebook.com/AjPediatrie ou sur notre site internet www.ajpediatrie.org
Article paru dans la revue “Association des Juniors en Pédiatrie” / AJP n°08

