Cas clinique issu du service de pneumologie de l’hôpital Saint Joseph, Paris
La nocardiose est une infection bactérienne rare causée par un bacille gram positif filamenteux aérobie, saprophyte du sol du type Nocardia spp (appartenant à l’ordre Actinomycetales et au sous ordre des actinomycètes aérobies). Ce germe de la famille des pyogènes est responsable de deux types de présentations cliniques : la nocardiose dite invasive (80-90 % des cas) survenant après inhalation chez un patient immunodéprimé, pouvant être isolée à un organe ou disséminée et la nocardiose cutanée primitive observée après un traumatisme tellurique chez un patient immunocompétent. La nocardiose invasive a un tropisme particulier pour le poumon (et le système nerveux central).
Le déficit de l’immunité cellulaire, la corticothérapie prolongée, l’infection à VIH, les hémopathies et cancers solides, et la transplantation sont les principaux facteurs favorisant la nocardiose invasive. Les pathologies broncho-pulmonaires chroniques, telles que la bronchopneumopathie chronique obstructive, les dilatations des bronches, les fibroses pulmonaires sont également associées à un risque accru de nocardiose invasive (baisse de l’immunité locale) (1-7).
La colonisation humaine étant rare, la mise en évidence du germe dans un prélèvement doit conduire à une approche diagnostique rigoureuse afin de ne pas méconnaître une infection active.
Nous rapportons ici le cas d’une patiente ayant présenté une nocardiose invasive disséminée de diagnostic retardé et difficile survenue dans un contexte de co-infection à Pseudomonas Aeruginosa. Ce cas illustre les difficultés diagnostiques et rappelles les manifestations cliniques et scanographiques de la nocardiose invasive.
Description du cas
Une patiente de 49 ans est prise en charge en réanimation fin septembre 2022 pour une détresse respiratoire aiguë hypoxémique. Elle a pour principal antécédent un thymome métastatique, diagnostiqué en 2012 traité par thymectomie suivie d’une radiothérapie puis par radiothérapie stéréotaxique et pleurectomie droite sub-totale devant une rechute pleurale en 2016. La suite a été marquée par une progression tumorale traitée par radiothérapie (dernière séance en février 2022). Elle n’a pas reçu de chimiothérapie.
Les symptômes ayant précédé la détresse respiratoire aiguë étaient une toux grasse ramenant des expectorations jaunâtres, une diarrhée non glairo-sanglante et une asthénie marquée. À l’arrivée en réanimation, la patiente est apyrétique, polypnéique et la saturation pulsée en oxygène (O2) est à 82 % sous 6L/min d’oxygène. Elle n’a pas de défaillance hémodynamique ou neurologique. Le gaz du sang réalisé sous 9 L/min d’O2 montre un pH à 7.49, une PaCO2 à 31 mmHg, une PaO2 à 83 mmHg des bicarbonates à 24 mmol/L et des lactates à 2.8 mmol/L. La radiographie de thorax montre une condensation alvéolaire basale droite et l’angioscanner thoracique révèle une atteinte interstitielle avec un aspect de crazy paving bilatéral et la condensation de la base droite visualisée sur la radiographie (Figure 1).
Figure 1 : Angioscanner pulmonaire en coupe axiale fenêtre parenchymateuse - entrée en réanimation
Le bilan biologique montre une hyperleucocytose (14600 mm3) à polynucléaires neutrophiles (PNN) (126300/mm3) une lymphopénie à 1000/mm3 avec des lymphocytes T CD4+ à 165/mm3 et une anémie microcytaire à 10 g/dL. La CRP est à 13 mg/L et la PCT inférieure à 0.06 µg/L. À noter, une dénutrition sévère avec une albuminémie à 21 g/L.
Le dosage pondéral des immunoglobulines est normal.
La prise en charge initiale a consisté en une ventilation mécanique et une antibiothérapie probabiliste large spectre par méropénem. Les prélèvements microbiologiques (aspiration bronchique et lavage bronchoalvéolaire) ont identifié par la suite un Pseudomonas Aeruginosa à taux significatif. Un nouveau scanner thoracique est réalisé 7 jours plus tard devant une absence d’amélioration clinique. Celui-ci montre une évolution dissociée des lésions avec une majoration de l’étendue des lésions en crazy paving du lobe supérieur droit (LSD) et de la condensation basale droite et une diminution de celles touchant le lobe inférieur gauche. On note l’apparition de micronodules bronchiolaires du LSD (Figure 2). Ces éléments ont conduit à rechercher une étiologie non infectieuse. Le bilan auto-immun a mis en évidence la présence d’anticorps anti-nucléaires à plus de 1/1280 d’aspect homogène d’anticorps anti-ADN natif (IgG) à 490 UI (N< 100), DOT myosite négatif (dont MDA5), anti NOR 90 positif, et d’anticorps anti-TPO et anti-thyroglobuline élevée.
Figure 2 : Scanner thoracique en coupe axiale fenêtre parenchymateuse : ré-évaluation à J7
Le lavage broncho-alvéolaire (LBA), réalisé après 15 jours d’antibiothérapie a montré une alvéolite (780 000 cellules/ml), avec des PNN à 40 %, éosinophiles à 42 %, macrophages à 14 %, sidérophages à 66 %, score de GOLDE à 148. L’aspect macroscopique clair du LBA et la négativité de la coloration PAS (Periodic Acid Shiff ) n’étaient pas en faveur du diagnostic de protéinose alvéolaire.
Après discussion multidisciplinaire, un traitement par méthylprednisolone (bolus durant 3 jours puis relai par 1 mg/kg) est instauré dans l’hypothèse d’une pneumopathie infiltrante diffuse (PID) auto-immune. L’évolution est très rapidement favorable permettant une extubation trois jours après l’initiation de la corticothérapie, puis un retour rapide à domicile sous prednisone 80 mg/jour.
Six semaines plus tard, la patiente décrit une dyspnée au moindre effort, une persistance de la toux et des expectorations. Le bilan biologique montre une persistance du syndrome inflammatoire biologique avec des PNN à 12700/mm3, et une lymphopénie à 330/mm3. Un nouveau scanner thoracique est réalisé (Figure 3)
Figure 3 : Scanner thoracique coupe axiale fenêtre parenchymateuse : 6 semaines d’évolution
Une éventuelle récidive de pneumopathie à pyocyanique est traitée en probabiliste par piperacilline tazobactam 7 jours. La corticothérapie est poursuivie avec une décroissance progressive.
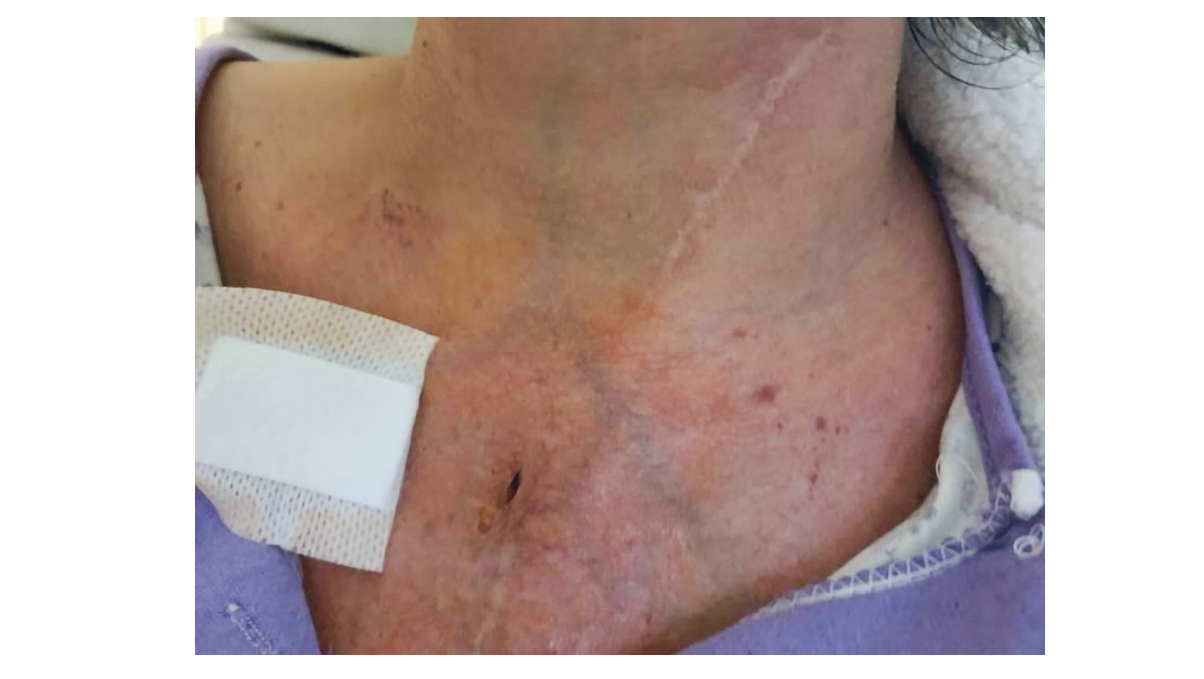
Début janvier 2023, la patiente signale la persistance de la toux, d’expectorations verdâtres et de l’essoufflement à l’effort. Elle rapporte un amaigrissement de 4 kg en une semaine, des sueurs nocturnes sans fièvre et des signes digestifs avec diarrhée non glairo-sanglante et douleurs abdominales hypogastriques et des vomissements. L’auscultation montre des crépitants diffus de l’hémichamps droit. À noter, un érythème de la joue au niveau maxillaire gauche, une tuméfaction inflammatoire douloureuse de 3 cm de diamètre située en cervical postérieur et sus-sternale (Figure 4).
Figure 4 : Coupes axiales de scanner thoracique : à gauche en fenêtre médiastinales et à droite en fenêtre parenchymateuse : ré-évaluation début janvier
Le nouveau scanner (Figure 5) montre une lésion de l’apex droit excavée de 4 cm, une condensation du lobe moyen excavée, une nouvelle condensation du lobe inférieur droit de 10 mm, et une stabilité des autres condensations.
Le bilan biologique montre un syndrome inflammatoire avec une CRP à 353 mg/L. L’immunophénotypage sanguin objective une diminution franche de la population lymphocytaire T avec un taux de lymphocytes CD4 à 62/mm3 et de CD8 à 32/mm3. L’hémoculture a mis en évidence des bacilles gram positifs ponctiformes ramifiés identifiés comme Nocardia farcinica à la culture. Le prélèvement local de la collection sus sternale a identifié le même germe.
Figure 5 : Collection sus sternale une fois drainée (accord de la patiente
Le bilan d’extension comprenant IRM cérébrale et scanner sinusien, cervical et abdomino-pelvien a montré de multiples lésions sous-cutanées (en plus des abcès cervicaux objectivés à l’examen clinique), musculaires, rénales bilatérales et au niveau cérébral un abcès occipital gauche de 7 mm. Les explorations cardiaques, réalisées compte tenue de la bactériémie et de l’antécédent de bioprothèse aortique, ont éliminé une endocardite. Une antibiothérapie par bactrim, imipénème/cilastatine, amikacine est initiée après discussion multidisciplinaire avec l’équipe d’infectiologie devant cette forme invasive disséminée. Les abcès cervicaux et sus-sternaux ont nécessité une prise en charge locale par drainage répété et technique d’incision-méchage. Les cultures ont été adressées au centre de référence pour identification, typage de l’espèce et confirmation de l’antibiogramme. L’évolution a été rapidement favorable sous traitement.
Discussion
La nocardiose est une infection bactérienne rare potentiellement grave dans sa forme invasive disséminée. Il s’agit d’un pyogène formant des foyers infectieux suppuratifs ayant la capacité de disséminer par voie hématogène à n’importe quel organe (1, 2, 6). La mortalité est élevée, de l’ordre de 20 à 30 % et de plus de 50 % en cas d’atteinte du système nerveux central (SNC) (4, 6, 7, 10). Le diagnostic est à évoquer devant toute infection pulmonaire survenant sur un terrain d’immunodépression et/ ou en cas de pathologie pulmonaire chronique.
Les facteurs de risque chez notre patiente étaient la présence d’une néoplasie active (thymome métastatique), et son antécédent de radiothérapie pleurale. L’instauration récente de corticothérapie haute dose sans prophylaxie a probablement aggravé l’infection et sa dissémination multi-organes (3, 4, 6, 7). D’autres facteurs comme la lymphopénie, être porteur d’une maladie auto-immune et l’infection à Nocardia farcinica ont été montrés comme facteur indépendant de dissémination (6, 7, 10). L’antécédent de radiothérapie thoracique semble important, il est en effet décrit de multiples infections pulmonaires compliquant une radiothérapie thoracique notamment des infections aspergillaires chroniques, mycobactériologiques et infections pulmonaires à Actinomyces (11). En cas de survenue d’une nocardiose invasive sans facteur de risque identifié (facteurs d’immunosuppression évident ou pathologie pulmonaire sous-jacente), il est alors important de vérifier l’absence d’anticorps anti GM CSF et de rechercher un déficit immunitaire primitif tel que la granulomatose septique chronique, la lymphopénie CD4 idiopathique ou encore les déficits en IL12RB1 ou ILp40 (10).
Comme chez notre patiente, des co-infections sont fréquemment décrites (4, 7, 10), retrouvées dans 20 à 40 % des cas, et peuvent être fongiques (aspergillose, histoplasmose), mycobactéries dont Mycobacterium tuberculosis, virales (CMV surtout en transplantation d’organes solides) ou bactériennes. Dans l’étude de Soueges S. et al. (7), une co-infection bactérienne a été objectivée dans 26 % des cas et fongique dans 20 % des cas environ. Le Staphylococcus aureus et le Pseudomonas aeruginosa comptaient pour 50 % des bactéries co-infectant la nocardiose. De ce fait, même en cas d’identification d’un germe à croissance rapide devant une pneumopathie d’évolution défavorable, à fortiori excavée, il faudra rechercher une nocardiose chez les patients présentant des facteurs de risque.
Plusieurs types de lésions peuvent être observées sur le scanner thoracique : nodules, masses, parfois excavées, condensations, infiltrat réticulo-nodulaire, parfois aspect de miliaire (2, 4). Les pleurésies et empyèmes sont fréquents. Les adénopathies médiastinales sont possibles (2, 4). L’aspect de crazy paving observé initialement chez notre patiente nous a interrogé quant à la présence de la nocardiose depuis le début. En effet, les infections font parties des étiologies connues de crazy paving. Néanmoins, chez notre patiente, l’amélioration spectaculaire après bolus de corticoïdes va à l’encontre de cette hypothèse.
Le diagnostic de certitude repose sur la mise en évidence du germe par la culture ou la PCR (1, 4, 5, 8). Il est important de spécifier au laboratoire la recherche de ce type de germe afin que les cultures soient poursuivies plusieurs semaines (jusqu’à 3 semaines) (2, 4, 5, 8). Les PCR ARN 16S ainsi que les PCR spécifiques visant les germes à croissance lentes pourront être demandées en cas de suspicion clinique, soulignant l’importance de la concertation clinicien - microbiologiste (4, 5).
Une biopsie guidée par le bilan d’extension est parfois nécessaire en cas de négativité des prélèvements usuels. L’anatomopathologie montre des lésions pyogranulomateuses, avec abcédations et couronne de polynucléaires neutrophiles (PNN) et un tissu fibreux renfermant des histiocytes (13). L’absence de fibrose, le faible nombre de fistules et l’absence de granules différencie l’aspect anatomopathologique de celui retrouvé dans l’actinomycose (2).
Le typage de l’espèce et l’antibiogramme avec détermination des CMI par méthode de dilution sont indispensables pour le choix du traitement (1, 3, 8, 9). Les souches de Nocardia spp ont en effet des profils variés de sensibilité aux bêtalactamines. Le cotrimoxazole, les aminosides et le linezolide semblent actifs sur plus de 95 % des espèces, mais du fait de l’utilisation prolongée, les deux dernières molécules sont à risque de toxicité (3, 9). Le cotrimoxazole est le pilier du traitement car il est actif sur presque toutes les souches, a une excellente biodisponibilité orale et une bonne diffusion cérébrale (3, 4). Une bi voire une tri-antibiothérapie (bactrim plus au choix parmi une bétalactamine selon le profil de sensibilité, un aminoside ou le linezolide) est indiquée en traitement d’attaque les 3-6 premières semaines dans les formes disséminées, en cas d’atteinte du SNC ou d’atteinte pulmonaire sévère (3, 4). La durée totale de l’antibiothérapie est de 6 mois pour une nocardiose invasive sans atteinte du SNC à 1 an pour une nocardiose avec atteinte du SNC (4, 9). Une prophylaxie secondaire par bactrim, à posologie plus élevée que celle utilisée en prophylaxie de la pneumocytose, est discutée en cas de persistance du facteur d’immunosuppression (4, 9).
Conclusion
La nocardiose invasive est une infection rare mais dont le diagnostic est à évoquer devant un terrain à risque car elle est potentiellement mortelle. Elle peut toucher virtuellement tous les organes mais a un tropisme particulier pour le poumon, le SNC et la peau. L’atteinte du système nerveux central pouvant être asymptomatique, il est recommandé de réaliser une imagerie cérébrale systématique dans les nocardioses invasives. Les co-infections avec d’autres germes sont fréquentes et leur mise en évidence ne doit pas faire oublier de rechercher la nocardiose en cas d’évolution défavorable malgré un traitement adapté. Le diagnostic repose sur la culture et les PCR. L’obtention du typage de l’espèce est essentielle pour l’adaptation du traitement. Une prophylaxie secondaire est à discuter en cas de persistance du facteur d’immunosuppression.
Références
- Shaw AT, Yeap BY, Mino-Kenudson M, Digumarthy SR, Costa DB, Heist RS, et al. Clinical features and outcome of patients with non-small-cell lung cancer who harbor EML4-ALK. J Clin Oncol Off J Am Soc Clin Oncol. 2009 Sep 10;27(26):4247–53.
- Schneider JL, Lin JJ, Shaw AT. ALK-positive lung cancer: a moving target. Nat Cancer. 2023 Mar;4(3):330–43.
- Pinsolle J. Détection des variants de fusion du gène ALK par séquençage massif parallèle ciblé à partir d’ARN et réponse au crizotinib dans les cancers bronchiques non à petites cellules. 2017 Sep 15;87.
- Mok T, Camidge DR, Gadgeel SM, Rosell R, Dziadziuszko R, Kim DW, et al. Updated overall survival and fi nal progressionfree survival data for patients with treatment-naive advanced ALK-positive non-small-cell lung cancer in the ALEX study. Ann Oncol. 2020 Aug 1;31(8):1056–64.
- Camidge DR, Kim HR, Ahn MJ, Yang JCH, Han JY, Lee JS, et al. Brigatinib versus Crizotinib in ALK-Positive Non–Small-Cell Lung Cancer. N Engl J Med. 2018 Nov 22;379(21):2027–39.
- Shaw AT, Bauer TM, de Marinis F, Felip E, Goto Y, Liu G, et al. First-Line Lorlatinib or Crizotinib in Advanced ALKPositive Lung Cancer. N Engl J Med. 2020 Nov 19;383(21):2018–29.
- Majeed U, Li S, Seegobin K, Nassar A, Manochakian R, Zhao Y, et al. First Report of Management of Sequential Small Cell Transformation and ALK I1171T Mutation as Resistance Mechanisms in a Patient With ALK-EML4 Fused Non–Small Cell Lung Adenocarcinoma With a Novel Combination of Temozolomide and Lorlatinib: A Case Report. JTO Clin Res Rep. 2023 Jul 1;4(7):100536.
- Ou SHI, Lee ATM, Nagasaka M. From preclinical efficacy to 2022 (36.7 months median follow -up) updated CROWN trial, lorlatinib is the preferred 1st-line treatment of advanced ALK+ NSCLC. Crit Rev Oncol Hematol. 2023 Jul 1;187:104019.
- Murray BW, Zhai D, Deng W, Zhang X, Ung J, Nguyen V, et al. TPX-0131, a Potent CNS-penetrant, Next-generation Inhibitor of Wild-type ALK and ALK-resistant Mutations. Mol Cancer Ther. 2021 Sep 1;20(9):1499–507.
- Tangpeerachaikul A, Bigot L, Friboulet L, Pelish HE. Abstract 3337: Preclinical activity of NVL-655 in ALK-driven cancer models beyond non-small cell lung cancer. Cancer Res. 2022 Jun 15;82(12_Supplement):3337.
- Intergroupe Francophone de Cancerologie Thoracique. A Phase II Randomized, Open-Labelled, Multicenter Study of Safety & Efficacy of Combination Brigatinib and Carboplatin-Pemetrexed Therapy or Brigatinib Monotherapy as First-Line Treatment in Advanced ALK-Positive Non-Small Cell Lung Cancer [Internet]. clinicaltrials.gov; 2023 Feb [cited 2023 Aug 1]. Report No.: NCT05200481. Available from: https://clinicaltrials.gov/study/NCT05200481
- Solomon BJ, Ahn JS, Dziadziuszko R, Barlesi F, Nishio M, Lee DH, et al. LBA2 ALINA: Efficacy and safety of adjuvant alectinib versus chemotherapy in patients with early-stage ALK+ non-small cell lung cancer (NSCLC). Ann Oncol. 2023 Oct 1;34:S1295–6.
Natalie AVIGNON
Interne
Relecture
Dr Amira BENATTIA PH,
Paris
Article paru dans la revue « du Jeune Pneumologue » /AJP02 N°03

